Щелочной гидролиз сложных эфиров, при котором происходит образование солей карбоновых кислот, называют омылением.
Определение
Сложные эфиры - производные кислот (карбоновых или минеральных, одноосновных или многоосновных), в которых атомы водорода гидроксильных групп -ОН замещены на углеводородные радикалы R.
Сложные эфиры карбоновых кислот обычно рассматривают как продукты реакции между кислотой и спиртом (реакция этерификации)
Общая формула сложных эфиров карбоновых кислот R-C(O)-O-R'
Номенклатура сложных эфиров
1. Сокращенный вариант (по аналогии с названием солей). В соответствии с систематической номенклатурой, название сложного эфира образуется следующим образом: первым указывается название радикала R, присоединенного к кислоте, затем – название кислоты (корень слова) с суффиксом «оат» (по аналогии с суффиксом "ат" в названиях неорганических солей: карбонат натрия, нитрат хрома). Например, этилпропаноат, метилэтаноат.
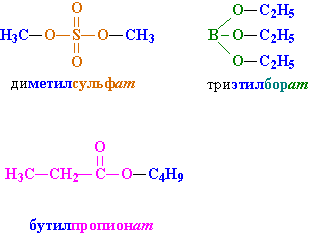
По сокращенному варианту может быть образовано и тривиальное название: к названию радикала R добавляется тривиальное название остатка кислоты (используется суффикс "ат"):
- формиат - эфир мураьвиной кислоты (HCOOR),
- ацетат - эфир уксусной кислоты (CH3COOR)
- бутират - эфир масляной (бутановой) кислоты (CH3CH2CH2COOR).
2. Полный вариант. К названию радикала R (по систематической номенклатуре) добавляется суффикс «овый», затем вставляется слово "эфир" и указывается название кислоты, например, этиловый эфир этановой кислоты или этиловый эфир уксусной кислоты. Название сложного эфира бутилпропионат в полном варианте будет выглядеть следующим образом: бутиловый эфир пропановой (пропионовой) кислоты.
|
|
|
Таким образом, возможно четыре варианта названия одного и того же эфира:

Физические свойства сложных эфиров карбоновых кислот
Сложные эфиры низших карбоновых кислот и простейших спиртов - бесцветные летучие жидкости, часто с приятным фруктовым запахом; сложные эфиры высших карбоновых кислот - твердые бесцветные воскообразные вещества, практически лишенные запаха, их температура плавления зависит как от длин углеродных цепей ацильного и спиртового остатков, так и от их структуры.
Химические свойства сложных эфиров карбоновых кислот
1. Гидролиз (омыление) сложных эфиров - основное химическое свойство. Гидролиз протекает с расщеплением сложных эфиров под действием воды. Эта обратная реакция для реакции этерификации. Реакция протекает как в кислой (катализаторы реакции – протоны Н+), так и в щелочной среде (катализаторы реакции – гидроксид-ионы ОН –).

В присутствии щелочи реакция необратима, т.к. происходит омыление – образование солей карбоновых кислот.
|
|
|
Определение
Щелочной гидролиз сложных эфиров, при котором происходит образование солей карбоновых кислот, называют омылением.
2. Реакция восстановления. При восстановлении водородом сложных эфиров образуется смесь двух спиртов:

3. Взаимодействие с аммиаком. При взаимодействии сложных эфиров с аммиаком образуется амид соответствующей кислоты и спирт:
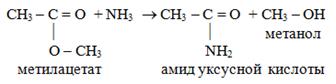
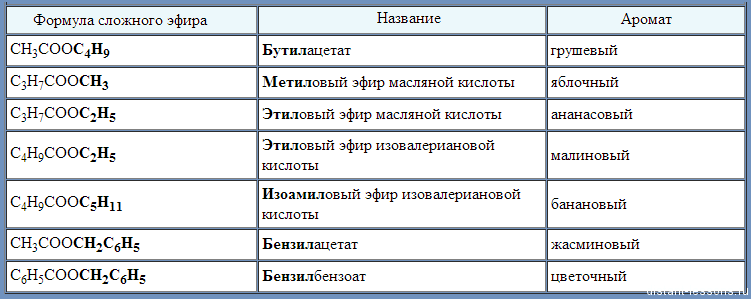
Сложные эфиры карбоновых кислот в природе
Сложные эфиры входят в состав эфирных масел многих растений и фруктов, придавая им специфический приятный запах:

В значительных количествах сложные эфиры представлены в природе восками. Основа природных восков - эфиры высших одноосновных кислот и высших одноатомных спиртов. Например, пчелиный воск содержит сложный эфир пальмитиновой кислоты и мирицилового спирта (мирицилпальмитат):
CH3(CH2)14−C(O)−O−C31H63
Сложные эфиры на основе низших спиртов и кислот используют в пищевой промышленности при создании фруктовых эссенций, а сложные эфиры на основе ароматических спиртов – в парфюмерной промышленности.
Многие сложные эфиры используются в качестве растворителей, например этилацетат, который используется в качестве растворителя лаков и красок, в органическом синтезе, а также при изготовлении лекарственных средств.
|
|
|
3. Обобщение и закрепление (второй блок)

(третий блок)
Составить уравнения реакций по схеме:
Этиловый спирт – ацетальдегид – уксусная кислота – метиловый эфир уксусной кислоты – ацетат калия.
Задача:
Какова масса твёрдого мыла, полученного на основе 400 кг 40% раствора гидроксида натрия и необходимого количества тристеарата? Каково это количество?
4. Домашнее задание. §16 стр 81-86 составить конспект
5. Литература: учебник Химия 10 класс, О.С.Габриелян, И.Г.Остроумов, С.А.Сладков. базовый уровень, М. «Просвещение» 2018г
Дата добавления: 2020-11-23; просмотров: 419; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
