Первое основное положение МКТ; молекулы, атомы
Все вещества состоят из большого количества частиц – молекул и атомов.
Атом – мельчайшая частица химического элемента. Размеры атомов (их диаметр) имеет порядок 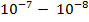 см. Стоит отметить, что различных типов атомов, в отличие от молекул, относительно немного. Все их разновидности, которые на сегодняшний день известны человеку, собраны в так называемой таблице Менделеева (рис. 4)
см. Стоит отметить, что различных типов атомов, в отличие от молекул, относительно немного. Все их разновидности, которые на сегодняшний день известны человеку, собраны в так называемой таблице Менделеева (рис. 4)

Рис. 4. Периодическая таблица химических элементов Д. И. Менделеева
Молекула – структурная единица вещества, состоящая из атомов. В отличие от атомов, они больше и тяжелее последних, а главное, они обладают огромным разнообразием.
Вещество, молекулы которого состоят из одного атома, называются атомарными, из большего количества – молекулярными. Например: кислород, вода, поваренная соль (  ) – молекулярные; гелий серебро (He, Ag) – атомарные.
) – молекулярные; гелий серебро (He, Ag) – атомарные.
Причём следует понимать, что свойства макроскопических тел будут зависеть не только от количественной характеристики их микроскопического состава, но и от качественной.
Если в строении атомов вещество имеет какую-то определённую геометрию (кристаллическую решётку), или же, наоборот, не имеет, то этим телам будут присущи различные свойства. Например, аморфные тела не имеют строгой температуры плавления. Самый известный пример – это аморфный графит и кристаллический алмаз. Оба вещества состоят из атомов углерода.


Рис. 5. Графит и алмаз соответственно
|
|
|
Второе основное положение МКТ
Все упомянутые выше частицы находятся в непрерывном тепловом хаотическом движении.
Так же, как и в рассматриваемых выше примерах, важно понимание не только количественных аспектов этого движения, но и качественных для различных веществ.
Молекулы и атомы твёрдых тел совершают лишь небольшие колебания относительно своего постоянного положения; жидких – также совершают колебания, но из-за больших размеров межмолекулярного пространства иногда меняются местами друг с другом; частички газа, в свою очередь, практически не сталкиваясь, свободно перемещаются в пространстве.
Третье основное положение МКТ
Частицы взаимодействуют друг с другом.
Взаимодействие это носит электромагнитный характер (взаимодействия ядер и электронов атома) и действует в обе стороны (как притягивание, так и отталкивание).
Пусть d – расстояние между частицами; a – размеры частиц (диаметр).

Масса и размеры молекул
Массы отдельных молекул и атомов очень малы. Например, в 1 г воды содержится 3,7·1022 молекул. Следовательно, масса одной молекулы воды (Н2O) равна:

Массы такого же порядка имеют молекулы других веществ (кроме огромных молекул органических веществ). Например, белки имеют массы, в сотни тысяч раз больше массы отдельных атомов. Но все равно их массы в макроскопических масштабах (граммах и килограммах) чрезвычайно малы.
|
|
|
Приблизительную оценку размеров молекул можно получить из опытов, проведенных немецким физиком В. Рентгеном и английским физиком Д. Рэлея. Если капнуть на поверхность воды капельку масла, то капля расплывется, образуя тонкую пленку толщиной всего лишь в одну молекулу. Толщину этого слоя нетрудно определить и тем самым оценить размеры молекулы масла. Объем V (0,001 ) слоя масла равен произведению площади его поверхности S (6000 ) на толщину слоя d, то есть V = S·d. Следовательно, размер молекулы масла равна:
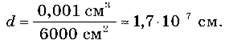
На данный момент существует ряд методов, позволяющих определить размеры молекул и атомов. Например, линейные размеры молекул кислорода составляют 3·м, воды - примерно 2,6·м. Таким образом, характерной длиной в мире молекул является размер м. Полезно не только запомнить этот параметр (м), но и образно представить его себе. Это поможет нам войти в мир молекул. Легко проверить: если молекулу воды увеличить до размеров яблока, то яблоко станет размером с земной шар.
Количество вещества
|
|
|
Относительная молекулярная масса представляет собой сумму относительных атомных масс элементов, входящих в состав молекулы. В молекулярно-кинетической теории количество вещества принято считать пропорциональным числу частиц (аналогично с химией).
Единица количества вещества называется молем (моль).
Моль– это количество вещества, содержащее столько же частиц (молекул), сколько содержится атомов в 0,012 кг (12 г) углерода 12C
Массу одного моля вещества принято называть молярной массой M.
Молярная масса – это масса вещества, взятого в количестве 1 моль.
Молярная масса выражается в килограммах на моль (кг/моль).
Опыт показывает, что в одном моле любого вещества содержится одно и то же число частиц. Это число называется числом (постоянной) Авогадро NА
Число Авогадро – количество частиц, содержащихся в одном моле любого вещества:
NА = 6,02·10-23 частиц/моль
Постоянная Авогадро – одна из важнейших постоянных в молекулярно-кинетической теории.
Количество вещества ν определяется как отношение числа N частиц вещества к постоянной Авогадро NА:
ν = N / NА
Молярная масса равна произведению массы m0 одной молекулы данного вещества на постоянную Авогадро:
|
|
|
M = NA · m0
Домашнее задание:
1. Составить конспект лекции
2. Ответить на вопросы:
a) Перечислить основные положения молекулярно-кинетической теории
b) Перечислить известные вам доказательства существования молекул, неупомянутых в тексте
c) Чему равна относительная молекулярная масса воды (Н2О)?
d) Чему равно количество вещества?
Задание отправлять на электронную почту: ludmilakorotcenkova@gmail.com
или сообщением в ВК по адресу: https://vk.com/id592950981
При отправлении задания четко указать ФИО, группу, дату, тему
Дата добавления: 2020-11-23; просмотров: 93; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
