Важно: Твердые тела сохраняют не только объем, но и форму.
Лекция 16. Строение газообразных, жидких и твердых тел. Идеальный газ в МКТ.
1. Строение газообразных, жидких и твердых тел.
Молекулярно-кинетическая теория дает возможность понять, почему вещество может находиться в газообразном, жидком и твердом состояниях.
Газы. В газах расстояние между атомами или молекулами в среднем во много раз больше размеров самих молекул (рис.1). Например, при атмосферном давлении объем сосуда в десятки тысяч раз превышает объем находящихся в нем молекул. Газы легко сжимаются, при этом уменьшается среднее расстояние между молекулами, но форма молекулы не изменяется
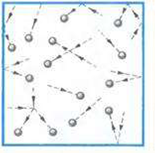

Рис 1 Рис.2
Молекулы с огромными скоростями - сотни метров в секунду – движутся в пространстве. Сталкиваясь, они отскакивают друг от друга в разные стороны подобно бильярдным шарам. Слабые силы притяжения молекул газа не способны удержать их друг возле друга. Поэтому газы могут неограниченно расширяться. Они не сохраняют ни формы, ни объема. Многочисленные удары молекул о стенки сосуда создают давление газа.
Жидкости. Молекулы жидкости расположены почти вплотную друг к другу (рис.3), поэтому молекула жидкости ведет себя иначе, чем молекула газа. В жидкостях существует так называемый ближний порядок, т. е. упорядоченное расположение молекул сохраняется на расстояниях, равных нескольким молекулярным диаметрам. Молекула колеблется около своего положения равновесия, сталкиваясь с соседними молекулами. Лишь время от времени она совершает очередной «прыжок», попадая в новое положение равновесия. В этом положении равновесия сила отталкивания равна силе притяжения, т. е. суммарная сила взаимодействия молекулы равна нулю. Время оседлой жизни молекулы воды, т. е. время ее колебаний около одного определенного положения равновесия при комнатной температуре, равно в среднем 10-11 с. Время же одного колебания значительно меньше (10-12-10-13 с). С повышением температуры время оседлой жизни молекул уменьшается.
|
|
|


Рис.3 Рис.4
Характер молекулярного движения в жидкостях, впервые установленный советским физиком Я.И. Френкелем, позволяет понять основные свойства жидкостей.
Молекулы жидкости находятся непосредственно друг возле друга. При уменьшении объема силы отталкивания становятся очень велики . Этим и объясняется малая сжимаемость жидкостей. Как известно, жидкости текучи, т. е. не сохраняют своей формы. Объяснить это можно так. Внешняя сила заметно не меняет числа перескоков молекул в секунду. Но перескоки молекул из одного оседлого положения в другое происходят преимущественно в направлении действия внешней силы (рис.4). Вот почему жидкость течет и принимает форму сосуда.
|
|
|
Твердые тела. Атомы или молекулы твердых тел, в отличие от атомов и молекул жидкостей, колеблются около определенных положений равновесия. По этой причине твердые тела сохраняют не только объем, но и форму. Потенциальная энергия взаимодействия молекул твердого тела существенно больше их кинетической энергии. Есть еще одно важное различие между жидкостями и твердыми телами. Жидкость можно сравнить с толпой людей, где отдельные индивидуумы беспокойно толкутся на месте, а твердое тело подобно стройной когорте тех же индивидуумов, которые хотя и не стоят по стойке смирно, но выдерживают между собой в среднем определенные расстояния.
Запомни: Если соединить центры положений равновесия атомов или ионов твердого тела, то получится правильная пространственная решетка, называемая кристаллической.
На рисунках 5 и 6 изображены кристаллические решетки поваренной соли и алмаза. Внутренний порядок в расположении атомов кристаллов приводит к правильным внешним геометрическим формам
|
|
|
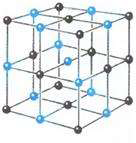

Рис.5 Рис.6
Важно: Твердые тела сохраняют не только объем, но и форму.
У газа расстояние l между молекулами много больше размеров молекулr0:l>>r0.
У жидкостей и твердых тел l≈r0. Молекулы жидкости расположены в беспорядке и время от времени перескакивают из одного оседлого положения в другое. У кристаллических твердых тел молекулы (или атомы) расположены строго упорядоченно.
Кристаллизация — процесс фазового перехода вещества из жидкого состояния в твёрдое.
Вопрос: От чего зависит то, что одно и то же вещество может находиться в разных агрегатных состояниях? (от расстояния между частицами, от сил взаимодействия и от скорости движения молекул)
Идеальный газ в МКТ.
Прежде всего, идеальный газ — это математическая модель газа. И с математической точки зрения, идея очень проста: атомы (или молекулы) этого самого газа "не видят" друг друга. То есть каждая частица воспринимает сосуд как совершенно пустой. Такие частицы могут проходит друг сквозь друга. Из этого следует, например, что все частицы могут собраться в одной пространственной точке.
|
|
|
С другой стороны идеальный газ — это физический термин. А значит, нам надо понять, какая физика отвечает такой математической модели.
а) Итак, во-первых, чтобы атомы "не видели" друг друга, надо чтобы между ними не было потенциальных сил взаимодействия, то есть сил зависящих от расстояния между частицами. В терминах энергии это требование звучит так: " потенциальная энергия взаимодействия частиц равна нулю". Такое строгое равенство нулю, это все еще математика, в физике мы можем смягчить это условие, сказав "потенциальная энергия взаимодействия частиц много меньше ..". Чего? Энергию можно сравнивать только с энергией, а системе движущихся частиц наибольший вклад дает кинетическая энергия. И вот наше первое условие:
1) Потенциальная энергия взаимодействия частиц газа много меньше их кинетической энергии.
б) В математической модели молекулы представляются математическими точками, то есть без размера. В реальном мире такого требовать мы не можем. Как же нам сформулировать это условие физически? Зачем нам безразмерные молекулы? Для того чтобы они не сталкивались друг с другом. Мы не можем запретить соударение частиц ненулевого размера без ввода в систему сил отталкивания. Но силы отталкивания мы исключили первым пунктом. Тогда нам придется разрешить столкновения в системе, но с наложением 3 условий: редко, быстро и без потерь энергии. И вот еще 3 пункта:
2) Средняя длина свободного пробега частиц (то есть расстояние проходимое между двумя последовательными столкновениями) много больше их размера.
3) Время столкновения пренебрежимо мало.
4) Все столкновения происходят без потерь энергии.
5) Частицы в системе имеют случайные скорости
6) В системе действуют законы Ньютона.
Дата добавления: 2020-11-23; просмотров: 342; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
