Интенсивность фотосинтеза и методы его определения
Под интенсивностью фотосинтеза (ИФ) понимают количество СО2, усваиваемое единицей листовой поверхности за единицу времени. ИФ измеряется преимущественно в мг СО2/(дм2-ч) или в мкмоль СО2/(м2-с). Реже для характеристики активности фотосинтеза используют количество О2, выделяемое единицей листовой поверхности за единицу времени.
Наиболее распространенным методом определения ИФ как в лабораторных, так и в полевых условиях является газометрический. Это самый производительный и точный метод учета поглощения СО2, основанный на инфракрасном анализе содержания диоксида углерода в токе воздуха. Измерение поглощения СО2 имеет ряд важных преимуществ перед определением динамики накопления сухой массы. Прежде всего, данный метод применим в любое время, он не приводит к уничтожению растения, и позволяет оценить прибавку сухой массы за короткий интервал времени (за минуты, часы или дни). Кроме того, он дает возможность изучать каждый лист в отдельности и соответственно оценить вклад каждого яруса в фотосинтетическую деятельность растения, отделяя прибыль углерода за счет фотосинтеза от потерь за счет дыхания.
В большинстве исследований газообмена СО2 используется метод, основанный на помещении листа, растения или группы растений в прозрачную камеру. ИФ таких объектов определяют с помощью инфракрасных газоанализаторов по изменению концентрации СО2 в потоке воздуха, протекающем через камеру. Обмен СО2 больших участков, например, поля, можно измерить с помощью микрометеорологического метода. При этом ИФ посевов определяют с помощью параллельных измерений концентрации СО2 и движения воздуха над посевом. Поскольку растения поглощают СО2, то его концентрация в воздухе непосредственно над растениями и вокруг них будет снижаться. Изменения концентрации СО2 на различной высоте над полем будут вызваны соотношением между скоростью ассимиляции СО2 растениями и движением воздуха, благодаря чему восполняется необходимый уровень СО2.
|
|
|
Радиометрический метод определения ИФ предполагает введение метки по 14С в виде СО2. С этой целью лист (целое растение) экспонируется с 14СО2 в течение короткого (менее 60 с), но точно измеренного периода времени. Затем лист срезают, фиксируют в жидком азоте и определяют содержание в нем 14С, которое прямо пропорционально ИФ. Метод широко используется для полевого измерения. Однако появившиеся недавно портативные ИК-газоанализаторы на СО2 начали вытеснять радиометрический метод при работе в поле, поскольку последний имеет два существенных недостатка. Во-первых, он приводит к гибели растения, во-вторых, может систематически завышать ИФ, особенно у С3-растений, обладающих в сравнении с С4-растениями значительным фотодыханием.
|
|
|
ИФ, как правило, быстро возрастает в период интенсивного роста листовой пластинки, достигая наибольших значений у завершившего рост листа. Затем начинается постепенное снижение ИФ, которое обусловлено параллельным уменьшением проводимости устьиц и мезофилла для молекул СО2. ИФ целого растения или участка посева достигает максимума в фазе цветения-бутонизации и затем постепенно снижается, достигая наименьших значений перед созреванием репродуктивного органа. Подобный колоколообразный ход ИФ объясняется формированием определенного индекса листовой поверхности (ИЛП) в онтогенезе растения в посеве. При определенном значении ИЛП, специфичном для каждой культуры, относительное постоянство ИФ растения будет поддерживаться на постоянном уровне до тех пор, пока старение и отмирание старых листьев компенсируются вновь образующимся листовым аппаратом. Вслед за прекращением роста листьев начинается снижение ИФ посева в результате уменьшения площади листьев и увеличения вклада дыхания в суммарный СО2 обмен посева по мере формирования репродуктивного органа.
|
|
|
Зависимость фотосинтеза от факторов внешней среды
Интенсивность света. Непосредственно в ходе процесса фотосинтеза используется лишь 1-3 % поглощенной солнечной энергии. Ответная реакция фотосинтеза на поток фотонов выражается световой кривой, состоящей из двух фаз. Первая фаза представляет собой линейную зависимость интенсивности фотосинтеза от потока квантов. Угол наклона кривой характеризует скорость фотохимических реакций и содержание хлорофилла: чем он больше, тем активнее используется световая энергия. Угол наклона световой кривой обычно велик у теневыносливых растений и глубоководных водорослей. У этих растений, приспособленных к условиям слабого освещения, хорошо развитый пигментный аппарат позволяет активнее использовать свет низкой интенсивности. Вторая фаза кривой - постепенное уменьшение наклона кривой по мере возрастания потока квантов и ее выход на плато, когда ИФ максимальна при ее насыщении светом. У светолюбивых растений насыщение достигается при значительно большей освещенности, чем у теневыносливых.В области светового насыщения интенсивность фотосинтеза значительно выше интенсивности дыхания. При снижении освещенности до определенной величины интенсивности дыхания и фотосинтеза выравниваются. Уровень освещенности, при котором поглощение углекислоты в процессе фотосинтеза уравновешивается ее выделением в процессе дыхания, называется световым компенсационным пунктом (СКП). Значения СКП составляют 1% от полного солнечного света для теневыносливых растений и 3-5% для светолюбивых
|
|
|
Спектральный состав света . ИФ сильно зависит от качества света. Поскольку максимумы поглощения хлорофиллом квантов света находятся в синей и красной областях спектра, рассмотрим влияние именно этих лучей на фотосинтез и его составляющие. Согласно квантовой теории 1 Дж красных лучей содержит в 1,5 раза больше квантов, чем 1 Дж сине-фиолетовых лучей. При выравнивании синего и красного света по падающим квантам ИФ оказывается выше на красном свету (КС), чем на синем (СС) и белом (БС). Однако на насыщающем свету преимущество переходит к СС. У растений, выращенных на СС, насыщение фотосинтеза происходит при более высокой освещенности и они эффективнее используют более мощные лучистые потоки, чем растения, выращенные на КС.
Наиболее высока интенсивность фотосинтеза в красных лучах. Красный свет всегда присутствует в лучах прямой солнечной радиации. Если солнце находится под углом 90°, то красные лучи составляют примерно ¼ полного солнечного света. Если же солнце стоит низко, то красные лучи становятся преобладающими и под углом 5° составляют ⅔ полного солнечного света.
.Выращивание на СС стимулирует включение продуктов фотосинтеза в белки и липиды, а на КС - растворимые углеводы и крахмал. Эти различия отмечены у С3- и С4-растений, одно- и двудольных растений в широком диапазоне концентраций СО2 и интенсивностей света. Эффект добавления даже 20% синего света к красному подобен эффекту монохроматического СС. Это явление можно использовать в теплицах, где применяют искусственные источники освещения. Однако реакция растений, особенно закрытого грунта, на качество света видо- и даже сортоспецифична, что следует учитывать при подборе необходимых источников облучения в теплицах.
Концентрация СО2 и О2 . С середины XIX века по настоящее время концентрация СО2 в атмосфере возросла с 0,029 до 0,033 %, и при сохранении темпов прироста к 2025 г. она может удвоиться. Зависимость ИФ от концентрации СО2 в воздухе выражается логарифмической кривой. Углекислотное насыщение фотосинтеза у С4-растений, имеющих механизм концентрирования СО2, проводит при содержании двуокиси углерода, близком к естественному. Его дальнейшее повышение, как правило, не увеличивает ИФ в отличие от С3-видов, у которых ИФ значительно возрастает. В результате С3-виды, уступая С4-видам по ИФ при нормальных условиях, превосходят их при высокой концентрации CО2, например при 0,1 %. Наиболее однозначной реакцией растений на длительное выращивание при повышенной концентрации СО2 являются увеличение площади листьев, уменьшение листовой обеспеченности биомассы, возрастание чистой продуктивности фотосинтеза (ЧПФ). Это сопровождается существенной структурной и функциональной перестройкой фотосинтетического аппарата: увеличением толщины листовых пластинок за счет возрастания размеров клеток столбчатой и губчатой паренхимы, снижением содержания хлорофилла.
Температура . Влияние температуры на фотосинтез бывает обратимым и необратимым. В первом случае указанное влияние не выходит за пределы устойчивости отдельных звеньев фотосинтеза, определяемых генотипом и предысторией формирования листа. Для большинства растений обратимое влияние на фотосинтез наблюдается в диапазоне температур от 5 до 35°С, где скорость реакций световой фазы (поглощение и миграция энергии, возбужденные состояния) независима от температуры, При температурах за пределами устойчивости физиологических систем листа наблюдается необратимая потеря фотосинтетической активности. В этом случае скорость некоторых реакций в мембранах хлоропластов, снижается и становится лимитирующей.
Общая зависимость фотосинтеза от температуры выражается одновершинной кривой. Кривая имеет три основные температурные точки: минимум, при котором начинается фотосинтез, максимум и оптимум. Нижняя температурная граница фотосинтеза у растений северных широт находится в пределах от -15°С (сосна, ель) до –0.5°С. Для тропических растений температурный минимум фотосинтеза составляет +4-8°С. температурный максимум фотосинтеза составляет 40-45 (у пустынных видов до 58)°С. Оптимальная температура фотосинтеза растений умеренных широт составляет 20-25°С.
Температурная зависимость С3- и С4-цикла метаболизма углерода существенно различается. С4-растения, например кукуруза, способны поддерживать более высокую скорость фотосинтеза при повышенной температуре, чем пшеница (С3-растение). Вместе с тем С3- и С4-растения, произрастающие в теплом климате, имеют более высокий температурный оптимум, и их фотосинтез не очень сильно ингибируется при повышенных температурах по сравнению с фотосинтезом видов, адаптированных к холоду.
При низкой температуре виды, адаптированные к холоду, наоборот, имеют более высокую скорость поглощения СО2, чем те же виды, адаптированные к теплу. Это объясняется тем, что виды, адаптированные к холоду, содержат больше растворимых ферментов и компонентов мембран, катализирующих важные реакции метаболизма углерода.
В отличие от действия высокой температуры нарушения фотосинтетических процессов в листьях при низких температурах обычно происходят лишь после длительного воздействия. Понижение температуры в сочетании с ярким освещением оказывает более негативное действие, чем одно только понижение температуры. Это можно объяснить нарушением встраивания хлорофилла в мембрану хлоропласта, различием в действии этих температур на скорости реакций, ответственных за синтез компонентов мембран. Среди последних важное место занимает повышение вязкости мембран.
Водный режим . Несмотря на то, что при фотосинтезе используется лишь около 1% поглощенной воды, дефицит последней сильно влияет на фотосинтез. Закрытие устьиц в результате водного дефицита вызывает снижение транспирации и поглощения СО2 листьями. Последнее объясняется наряду с повышением устьичного сопротивления и снижением содержания хлорофилла тем, что водный дефицит может непосредственно изменять эффективность отдельных звеньев фотосинтеза. Фотодыхание, хотя и снижается по мере усиления водного дефицита, менее чувствительно к водному стрессу, чем ассимиляция СО2. В результате, как показал Дж. Бойер, на целом ряде культур отношение скорости фотодыхания к скорости истинной ассимиляции СО2 увеличивается по мере снижения водяного потенциала. Это обусловливает повышение межклеточной концентрации СО2 и углекислотного компенсационного пункта, что свидетельствует о снижении видимого фотосинтеза. В данном случае фотодыхание используется как клапан для сброса избыточной фотохимической энергии, не полностью используемой. В основе регуляторной системы, координирующей фотосинтетическую способность листа и устьичную проводимость при дефиците влаги, лежит принцип компромисса между ассимиляцией СО2 и испарением воды. Основная роль устьиц в этом процессе состоит в том, чтобы поддерживать такую межклеточную концентрацию СО2, которая обеспечила бы фотосинтез в зоне изгиба углекислотной кривой фотосинтеза. Именно в этой зоне достигается максимальная эффективность транспирируемой воды, т.е. на каждый грамм воды поглощается максимально возможное количество СО2. При этом устьица регулируют свою открытость таким образом, чтобы поддерживать соотношение межклеточной и атмосферной концентрации СО2 относительно постоянным (0,6-0,7 и 0,3-0,4 для С4- и С3-растений соответственно).
Реакция фотосинтеза на дефицит влаги зависит от множества сопутствующих факторов: возраста листа, донорно-акцепторных отношений, предыдущих условий и скорости наступления стресса. Фотосинтез листа наиболее чувствителен к дефициту влаги, как правило, в период роста. С завершением роста и по мере постепенного старения листа устойчивость ассимиляции СО2 возрастает. Последняя прямо коррелирует с напряженностью донорно-акцепторных отношений. Так, например, чем больше плодов на растении томата, тем устойчивее к дефициту влаги фотосинтез листьев, непосредственно обеспечивающих плоды ассимилятами. Устойчивость фотосинтеза к водному стрессу повышается с увеличением концентрации СО2 в воздухе и при повторном наступлении стресса. Это следует учитывать в современных технологиях в связи с постепенным повышением концентрации СО2 в атмосфере.
.Минеральное питание. Элементы минерального питания могут влиять на ИФ прямо или косвенно, через обмен веществ и рост. Прямое действие на фотосинтез связано с тем, что минеральные вещества входят в состав ферментов и пигментов или непосредственно участвуют в процессе фотосинтеза в качестве активаторов. Например, марганец служит активатором фотолиза, калий имеет отношение к переносу протонов через мембраны тилакоидов, железо, кобальт, медь содержатся в различных ферментах, фосфат - в нуклеотидах..При недостатке железа возникают хлорозы, приводящие к тому, что поглощение СО2, например у сахарной свеклы, снижается более чем втрое. Аналогичные последствия наблюдаются и при недостатке магния. При хлорозе растения ведут себя как типично теневые и не могут использовать интенсивный свет; сильно сокращается также продолжительность жизни листьев, они, как правило, бывают мелкими.Особое место среди элементов питания занимает азот. До 65 % белка находится в хлоропластах, в том числе около 50 % в РДФ-карбоксилазе. Азот влияет на размеры и ультраструктуру хлоропластов, усиливая их гранальность; повышает содержание белков - переносчиков ЭТЦ фотосинтеза, увеличивает ИФ и КПД ФАР. Однако роль азота не ограничивается его влиянием только на нормирование фотосинтетического аппарата и функционирование отдельных его звеньев. Активный метаболизм азота в листе - основа лабильности фотосинтетического аппарата, т.е. его успешной адаптации к быстрым изменениям освещенности и других факторов внешней среды. Именно это присуще современным высокопродуктивным сортам, что позволяет им при более активном по сравнению со старыми сортами росте достичь высокой продуктивности.
При недостатке фосфора сильно подавляется скорость световых реакций фотосинтеза, что значительно ингибирует фотоассимиляцию СО2. Дефицит фосфора особенно резко проявляется при высокой интенсивности света, при этом более чувствительными являются темновые реакции.
Важная роль калия в функционировании замыкающих клеток устьиц хорошо известна. При недостатке калия в хлоропластах разрушается структура гран, устьица слабо открываются на свету и недостаточно закрываются в темноте, ухудшается водный режим листа, нарушаются все процессы фотосинтеза.
Болезни растений. Грибные патогены, такие, как ржавчина и мучнистая роса, не приводят к быстрой гибели растения-хозяина, так как их развитие возможно только на живой ткани. ИФ больных растений значительно ниже по сравнению со здоровыми. Отрицательное влияние бактериальных инфекций на фотосинтез связано прежде всего с интенсивным разрушением структуры хлоропласта, что обусловлено активным выделением бактериями токсинов в ткань растения-хозяина.
Взаимодействие факторов при фотосинтезе. В естественных условиях факторы внешней среды действуют совместно. Поэтому газообмен растения отражает взаимодействие всех внутренних и внешних факторов. Согласно концепции лимитирующих факторов Г. Блэкмана, ИФ лимитируется тем фактором или процессом, который в данных условиях протекает с наименьшей скоростью, однако некоторое влияние оказывают и остальные факторы. Например, с повышением освещенности оптимальная и максимальная температуры видимого фотосинтеза повышаются на несколько градусов. Для растений это выгодно, так как сильное освещение всегда связано с нагревом листа. Если оно в конце концов приводит к перегреву (или к затруднению водоснабжения), то свет уже перестает быть фактором, определяющим фотосинтез, и ИФ снижается. Поэтому в естественных условиях в дневных ходах фотосинтеза получаются не кривые светового насыщения, как в лабораторных опытах, а кривые с оптимумом.
Аналогичным образом взаимодействуют свет и СО2. При повышении концентрации последнего радиация, при которой КПД фотосинтеза достигает максимума, также должна увеличиться, что следует иметь в виду при обогащении воздуха СО2 в теплицах в зимний период. Хотя концепция лимитирующих факторов полезна в качестве первого приближения к решению вопроса, в природе обычно наблюдается взаимодействие факторов среды, неучитываемое этой концепцией. Например, стрессовые факторы (засуха, жара или холод) в сочетании с варьирующей концентрацией СО2 и О2 могут влиять на скорость фотосинтеза при интенсивностях света, сильно лимитирующих фотосинтез. Это явно противоречит теории лимитирующих факторов, так как в данном случае фотосинтез уже сильно ограничен светом. Подобный тип взаимодействия можно понять, принимая во внимание, что ИФ при лимитирующей освещенности определяется не только пропускной способностью самого медленного этапа, но и его эффективностью.
Суточные и сезонные ритмы фотосинтеза. С восходом солнца интенсивность фотосинтеза возрастает вместе с освещенностью, достигая максимума в 9-12ч. Дальнейший характер процесса определяется степенью оводненности листьев, температурой воздуха и интенсивностью солнечного света. В полуденные часы интенсивность фотосинтеза не увеличивается: она может оставаться примерно на уровне максимума (в нежаркие, облачные дни) или несколько снижаться, но тогда к 16-17ч наблюдается повторное усиление процесса. Интенсивность фотосинтеза падает после 22ч с заходом солнца.
Дневная депрессия фотосинтеза (если она имеет место) связана с нарушениями деятельности фотосинтетического аппарата и оттока ассимилятов при перегреве, поскольку температура листьев в этот период может превосходить температуру воздуха на 5-10°С. если потери воды тканями велики и наблюдается усиление фотодыхания, то устьица в это время закрываются.
Сезонные изменения фотосинтеза зависят от условий произрастания. У эфемеров пустынь максимум фотосинтеза приходится на конец марта - середину апреля и совпадает с началом плодоношения. У арктических растений снижение фотосинтеза связано с периодами весенних и позднелетних заморозков. У всех растений интенсивность фотосинтеза снижается к концу периода вегетации.
Фотосинтез и урожай
Индекс листовой поверхности . Индекс листовой поверхности (ИЛП) – это площадь листьев (м2), приходящаяся на 1 м2 почвы. Различают критическое и оптимальное значения ИЛП. Первое характеризует минимальную величину ИЛП, при которой поглощается максимально возможное в данных условиях (90- 95 %) количество падающей радиации и достигается наибольшая скорость накопления биомассы. Однако после достижения критического значения ИЛП дальнейшее увеличение площади листьев не приводит к существенному увеличению скорости роста посева (СРП)
Критическое значение ИЛП, равное 4-7, характерно для посевов зерновых, зернобобовых культур, сахарной свеклы и других, причем более высокие значения отмечены для посевов с эректоидным расположением верхних листьев в благоприятных условиях выращивания. Оптимальный ИЛП достигается в посевах капусты кормовой, некоторых трав.
Основной причиной различной зависимости скорости накопления биомассы в посеве от ИЛП в указанных случаях являются особенности изменения дыхания посевов по мере увеличения площади листьев. В первом случае оно увеличивается только до определенного значения ИЛП, равного критическому, а затем, как и видимый фотосинтез посева, выходит на плато. Во втором случае дыхание возрастает по мере увеличения листового индекса линейно.
Для каждого комплекса условий у одного и того же сорта и вида растений может быть свой оптимальный график формирования площади листьев. С площадью листьев у ряда культур наиболее тесно коррелирует урожайность. Однако отмечены случаи отсутствия корреляций между указанными параметрами, особенно при сильном загущении посевов и избыточных дозах азотных удобрений. Это объясняется тем, что урожайность растет не всегда наравне с увеличением площади листьев и биомассы, а только при увеличении их до определенных величин, после чего рост ее прекращается.
Фотосинтетический потенциал . Продуктивность посевов определяется наряду с ИФ и ИЛП длительностью функционирования фотосинтетического аппарата, характеризуемого показателем фотосинтетический потенциал (ФП) посева. Фотосинтетический потенциал - это число «рабочих дней» листовой поверхности посева, рассчитываемое как произведение полусуммы площадей листьев за два последующих определения на длительность периода между этими определениями в днях. ФП посева тесно коррелирует как с биологической, так и с хозяйственной продуктивностью растений и составляет для средних широт в оптимальных условиях 2,5-3,0 для зерновых и 1,5-2,0 млн м2дней/га для картофеля. По данным И.С. Шатилова, каждые 1000 ед. фотосинтетического потенциала посевов формируют 2-3 кг зерна, 5-7 кг картофеля. На избыточном агрофоне эти величины уменьшаются, что свидетельствует об ухудшении баланса углерода в результате снижения показателей фотосинтеза.
По данным В.А. Кумакова, рост урожайности селекционных сортов яровой пшеницы обусловлен преимущественно увеличением ИЛП и ФП, главным образом верхних листьев, а также доли ФП, приходящейся на период колошение – спелость,а колебания зерновой продуктивности наполовину объясняются вариациями ФП. Наряду с листьями значительный вклад в ФП растения и соответственно ассимиляцию СО2 вносят стебли, листовые влагалища, плодоэлементы, причем у таких культур, как овес и ячмень, вклад метелки (колоса у ячменя) и листьев примерно одинаков и составляет 35-40%. Поэтому сохранение здоровых плодоэлементов у этих культур при защитных мероприятиях - непременное условие устойчивого урожая. У ржи, наоборот, ведущая роль принадлежит стеблю (50-55 %) и значительно уступают ему листья (20 %). Видимо, поэтому селекционерам до сих пор не удается вывести короткостебельные сорта ржи. У пшеницы основной вклад в ассимиляцию СО2 вносят листья (57 %), особенно флаговый, и лишь затем колос (12 %).
Указанные данные позволили польскому исследователю Е. Нальборчику условно отнести к листовому типу - пшеницу, стеблевому - рожь, листоколосовому - овес и ячмень. Принадлежность культуры к определенному типу необходимо учитывать при разработке агротехники, обработке посевов регуляторами роста и гербицидами.
Чистая продуктивность фотосинтеза . Накопление биомассы единицей площади листа за единицу времени называется чистой продуктивностью фотосинтеза (ЧПФ). Она, как правило, измеряется в граммах сухой массы на 1 м2 за сутки, варьируя в зависимости от условий в широком диапазоне (7-20 г/(м2-сут)). ЧПФ характеризует среднюю эффективность фотосинтеза листьев в посеве, но, как и ИФ, слабо коррелирует с конечным урожаем. Она максимальна при низких величинах ИЛП, когда большинство листьев хорошо освещены. С увеличением ИЛП и соответственно усилением взаимного затенения листьев в посеве, как и при избыточном азотном питании, значения ЧПФ снижаются. ЧПФ не включает фотосинтез нелистовых органов (стеблей, влагалищ листьев, колосковых чешуи и др.), который в определенных условиях, например при дефиците влаги, может вносить существенный вклад в формирование урожая. ЧПФ представляет собой комплексный параметр, определяемый интенсивностью не только фотосинтеза, но и дыхания. При одинаковой скорости этих процессов у двух сортов ЧПФ будет выше у того, у которого больше вклад надземных (фотосинтезирующих) органов в массу целого растения. Произведение ЧПФ на индекс листовой поверхности равно скорости роста посева (СРП). Максимальная СРП, по данным Б.И. Гуляева, составила 30-35 и 50-60 г/(м2-сут) соответственно для С3- и С4-видов.
По мере увеличения периода, в течение которого сохраняются максимальные величины СРП, возрастает также биологическая продуктивность посевов. Эффективность работы фотосинтетического аппарата в посеве, характеризуемая КПД ФАР, достигает в этот период 6-8 %. Однако у большинства важнейших сельскохозяйственных культур период высокоэффективной работы ценоза весьма непродолжительный. У зерновых культур велики потери углерода на темновое дыхание, а у таких культур, как сахарная свекла, картофель, - на отмирание ботвы. Поэтому потенциальный урожай и значения КПД ФАР за теплый период года у них значительно ниже оптимальных и составляют в пересчете на хозяйственный урожай для кукурузы при урожае 10 т/га 1,1 %, для пшеницы при урожае зерна 5 т/га около 0,5 %, для сахарной свеклы при урожае сухой массы корнеплодов 17,5 т/га 1,9 %. Средняя в мире урожайность пшеницы составляет 2 т/га, кукурузы - 3,5 т/га, что соответствует значениям КПД ФАР соответственно 0,2 и 0,4 %.
Посевы по их средним значениям КПД ФАР подразделяют на низкие - 0,5-1,5 %, средние - 1,5-3,0 и высокие - 3,0-5,0 %. Значения КПД ФАР являются основным показателем продуктивности и урожайности сельскохозяйственных культур. Поэтому повышение значения КПД ФАР в результате применения прогрессивных технологий и максимального использования продуктов фотосинтеза на формирование урожая представляет собой главную задачу растениеводства и селекции.
Радиационный режим и структура посева. Верхние листья в посеве поглощают как прямую, так и рассеянную радиацию, в то время как самые нижние получают лишь небольшую долю прямой радиации в виде солнечных бликов. Кроме того, нижние листья поглощают радиацию, отраженную от поверхности растения и почвы, а также пропущенную через верхние листья. От верхних к нижним листьям изменяется не только мощность солнечного потока, но и качество света в пользу главным образом инфракрасных лучей. Основными факторами, определяющими поглощение радиации посевом, служат ИЛП и характер листорасположения, главным образом угол отклонения от стебля.
Рассмотрим два типа архитектуры посева, наиболее распространенных среди сельскохозяйственных культур, в данном случае райграса однолетнего и клевера. Эректоидные листья верхнего яруса у райграса, занимающие лишь небольшую долю от общей площади листьев, способствуют проникновению ФАР к нижним ярусам листьев в посеве и их активному фотосинтезу. У клевера, наоборот, большая доля листьев находится в верхнем ярусе, и они практически горизонтальны, улавливая значительную часть радиации. В результате нижние листья в посеве не фотосинтезируют или даже используют на дыхание синтезированные верхними листьями ассимиляты. Для зернвых культур более предпочтителен первый тип архитектуры посева, когда верхние листья близки к эректоидным, а листья среднего яруса, вносящего наибольший вклад в фотосинтетический потенциал растения, расположены почти горизонтально.
Последнее присуще наряду с клевером также посевам подсолнечника, кормовых бобов, огурца и других культур.
Параметры оптимального посева . Оптимальным считается фотосинтез, адаптирующийся к использованию с максимальной эффективностью тех условий, которые складываются в посеве или создаются человеком с целью повышения продуктивности. Компонентами этой системы должны быть растения, формирующие фитоценоз с наивысшей для данных условий фотосинтетической продуктивностью, сохраняя и даже улучшая свои свойства (высокое качество урожая, устойчивость к болезням, полеганию).
Наилучшим можно считать фотосинтетический аппарат, способный быстро достигать оптимальных размеров (ИЛП = 5-8) и сохранять их, как и максимальные приросты, в течение возможно длительного периода времени, синхронизируя свою работу с генетически контролируемой программой онтогенеза.
Для получения реального урожая зерна 6 т/га, что равнозначно получению биологического урожая 15 т/га, необходимо усвоение посевом 30-33 т/га СО2. Это исключительно сложная задача, так как в период наиболее интенсивного роста максимальные суточные приросты достигают 400-600, а иногда 1000 кг/га биомассы. Такие приросты реальны в посевах с ИЛП = 5-8 и величинах ЧПФ = 4-8 г/(м2-сут) или средней ИФ = 8-16 мг СО2/(дм2ч).Для получения подобных приростов растения должны усваивать до 2000 кг/га СО2. В толще посева в это время находится всего 5-6 кг СО2, т.е. в 150-300 раз меньше требуемого количества. Растения справляются с этой задачей, поскольку за 16-часовой летний день в результате турбулентного перемешивания происходит около 1500-3000 смен воздуха в толще посева. Тем не менее концентрация СО2 в посеве (0,025-0,027 %) оказывается ниже, чем над посевом (0,030-0,032 %), и соответственно лимитирует, как и пониженная освещенность, фотосинтез .Преодоление этого лимитирования на физиологическом, агрохимическом и селекционно-генетическом уровнях является важной задачей повышения урожаев, поскольку оптимальное сочетание показателей для достижения указанных максимальных приростов биомассы наблюдается редко. Если, например, при некоторой обеспеченности водой и питанием в посевах развивается недостаточная площадь листьев (ИЛП = 2-3), урожай снижается даже при достаточно хороших показателях ЧПФ. При этом имеет значение выведение сортов с повышенной устойчивостью ростовой функции, определяющей рост листьев и плодоэлементов в неблагоприятных условиях.
Фотосинтетический аппарат таких сортов должен быстро и успешно адаптироваться к изменениям основных параметров фотосинтетической деятельности в широком диапазоне их проявлений. В процессе эволюции появились разнообразные биотипы и генотипы с фотосинтетическим аппаратом, приспособленным для эффективной работы в различных условиях. Так, в регионах с высокими температурами у растений, формирующих плотные посевы с неблагоприятным углекислотным режимом, преимущество могут иметь растения С4-типа (кукуруза, сорго, сахарный тростник) и другие теплолюбивые и жаростойкие формы с соответствующими температурными оптимумами фотосинтеза. В умеренных широтах с более низкими температурами и в условиях, формирующих хорошо вентилируемые посевы, не менее продуктивными могут быть и С3-растения (свекла, подсолнечник и др.)
Светокультура сельскохозяйственных растений . Светокультура растений изучает теоретические основы и методы выращивания растений с помощью искусственного облучения. В этом случае растения не создают новых запасов энергии на земле, как в природе, а лишь трансформируют лучистую энергию ламп в химическую энергию растений.
Искусственное облучение широко применяется в тепличных хозяйствах, особенно в северных регионах, для выращивания овощей, а также для ускорения выведения новых сортов, теоретических исследований по биологическим наукам и других целей. Источниками излучения в светокультуре растений служат электрические лампы различных типов. Они должны удовлетворять следующим требованиям.
1. Спектральный состав излучения ламп должен в наибольшей степени способствовать осуществлению основных физиологических процессов. Для этого необходимо, чтобы в спектре были все участки видимого излучения с преобладанием красных, синих и фиолетовых лучей, а также небольшая доля длинного ультрафиолетового (УФ) и короткого инфракрасного (ИК) излучения. Излучение с длиной волны менее 290 нм не должно попадать на растения.
2. Лампы не должны излучать большое количество теплоты, так как это нарушает нормальный обмен веществ в растениях, приводит к преждевременному цветению, плодоношению и, как правило, снижению урожая.
3. Лампы должны быть экономичными, т.е. создавать достаточную фотосинтетическую облученность при возможно меньшем потреблении электроэнергии и выдерживать продолжительную эксплуатацию.
В настоящее время наиболее широкое применение нашли газоразрядные лампы и в меньшей степени - лампы накаливания. Источник лучистой энергии в газоразрядных лампах - излучение газов или паров металлов, возникающее при газовом разряде. В лампах накаливания, отличающихся невысокой стоимостью, простотой в обращении и высокой мощностью лучистого потока, источником излучения служит раскаленная вольфрамовая нить.
Анатомическое строение листьев и стеблей служит важным биологическим показателем условий облучения, выращивания и физиологического состояния растений. Так, палисадная и губчатая паренхима наиболее развита у листьев под люминесцентными и ксеноновыми лампами, в результате чего удельная поверхностная плотность оказывается больше, чем под другими типами ламп. По анатомическим характеристикам листья под люминесцентными лампами можно отнести к группе световых, а под лампами накаливания, неоновыми, ртутными или не облучавшиеся дополнительно зимой в теплице - к группе теневых.
При длинноволновом излучении под лампами накаливания и ксеноновыми стебли обычно вытягиваются; при коротковолновом под люминесцентными лампами, наоборот, наблюдается сильное сокращение междоузлий. В последнем случае лучше дифференцируются проводящие пучки, хорошо развиваются механические ткани и образуется наибольшее количество камбиальных клеток.
Хорошо развитый пигментный аппарат листьев под этими лампами приводит к длительному сохранению фотосинтетической функции и соответственно к существенному увеличению урожая у овощных и других культур. При облучении растений неоновыми, ртутными и ртутно-вольфрамовыми лампами ИФ значительно ниже, а дыхание - выше, что снижает продуктивность растений в сравнении с люминесцентными лампами.
Помимо фотосинтеза и дыхания важное значение в продукционном процессе имеют процессы фотоморфогенеза, т.е. изменение форм, размеров растений, а также динамика прохождения отдельных этапов органогенеза под влиянием излучения разного качества и разной интенсивности. Например, ускорение развития растений томата при выращивании их под ксеноновыми лампами по сравнению с люминесцентными происходит за счет более быстрого прохождения ими этапа образования кисти.
Таким образом, анатомическая структура листьев, накопление пигментов, усвоение лучистой энергии, фотосинтез и фотоморфогенез - лабильные физиологические процессы. Основным фактором, вызывающим изменчивость указанных процессов при прочих равных условиях, является спектральный состав излучения ламп.
Тема 1.3 Растворы. Идеальные растворы. Закон Рауля. Осмос. Осмотическое давление. Температуры замерзания и кипения раствора. Теория электролитической диссоциации. Электропроводимость растворов электролитов.
Многие химические процессы протекают лишь при условии, что участвующие в них вещества находятся в растворенном состоянии. Растворами называют многокомпонентные гомогенные системы переменного состава. Растворителем называют вещество, которое не меняет своего агрегатного состояния и чаще всего находится в избытке.
Учение о растворах представляет особый интерес потому, что важнейшие биологические жидкости: кровь, клеточный сок, слюна, моча - являются растворами солей, белков, углеводов, липидов в воде. Усвоение пищи связано с переходом питательных веществ в растворенное состояние. Биохимические реакции в растениях и организмах животных протекают в растворах. Биожидкости участвуют в транспорте питательных веществ к органам и тканям, а также выведении из организма метаболитов.
Растворы веществ с молярной массой меньше 5000 г/моль называют растворами низкомолекулярных соединений (НМС), а растворы веществ с молярной массой более 5000 г/моль – растворами высокомолекулярных соединений (ВМС).
По наличию или отсутствию электролитической диссоциации растворы НМС подразделяют на два класса: растворы электролитов и неэлектролитов.
Растворы электролитов – растворы, проводящие электрический ток; это растворы диссоциирующих на ионы солей, кислот, оснований, амфолитов. Например, растворы КNO3, HCl, KOH, Al(OH)3.
Растворы неэлектролитов – растворы веществ, практически не диссоциирующих в воде. Например, растворы сахарозы, глюкозы, мочевины.
Растворы НМС – электролитов и неэлектролитов – называют истинными, размер их частиц составляет ≤10-9м.
Общими являются свойства растворов, которые зависят от концентрации и практически не зависят от природы растворенных веществ, их называют также коллигативными. Такие свойства могут проявляться в идеальных растворах. К идеальным растворам по своим свойствам приближаются лишь очень разбавленные растворы. К общим свойствам растворов относятся: понижение давления насыщенного пара растворителя над раствором и понижение температуры замерзания, повышение температуры кипения и осмотическое давление. Эти свойства проявляются в случае растворов нелетучих растворенных веществ, давлением паров которых можно пренебречь.
Опыт показывается, что давление насыщенного пара над растворами ниже, чем давление насыщенного пара над чистым растворителем.
Французский ученый Рауль открыл закон, согласно которому понижение давления насыщенного пара растворителя А над раствором ∆рА пропорционально молярной доле растворенного нелетучего вещества χB::
р°А – рА = ∆рА = р° χB,
где р°А, рА – давление насыщенного пара растворителя соответственно над чистым растворителем и над раствором;
∆рА – разность между давлением насыщенного пара над раствором (рА) и растворителем (р°А). Из приведенного уравнения следует, что с увеличением содержания нелетучего компонента давление пара над раствором уменьшается.

Рисунок 1.5 - Зависимость давления насыщенного пара растворителя от температуры над чистым растворителем (водой) (1) и над раствором нелетучего компонента (2)
Из закона Рауля вытекают два следствия.
Согласно одному из них температура кипения раствора выше температуры кипения растворителя. Разность температур кипения раствора t1 и чистого растворителя t0 (∆tкип = t1 − t0) называется повышением температуры кипения раствора. Повышение температуры кипения ∆tкип пропорционально моляльной концентрации раствора:
∆tкип = КЭСm,
где КЭ – эбуллиоскопическая постоянная растворителя, град × кг/моль;
t1 – температура кипения раствора;
t0 – температура кипения чистого растворителя;
Сm – моляльная концентрация, моль/кг

mв – масса вещества;
Mв – молярная масса вещества, г/моль;
mрастворителя – масса растворителя, кг.
Согласно второму следствию из закона Рауля, температура замерзания (кристаллизации) раствора ниже температуры замерзания чистого растворителя. Разность температур замерзания чистого растворителя t0 и начала замерзания раствора t1 (∆tзам = t0 - t1) называется понижением температуры замерзания раствора. Понижение температуры замерзания ∆Тзам пропорционально моляльной концентрации раствора:
∆tзам = ККСm,
Где Кк– криоскопическая постоянная;
t1 – температура замерзания раствора;
t0 – температура замерзания чистого растворителя.
Значения Кк и Кэ зависят от природы растворителя. Значения констант для некоторых растворителей приведены справочных таблицах. Используя вышеприведенные зависимости, можно определить молярные массы растворенных веществ. Методы, основанные на исследовании зависимости ∆tзам и ∆tкип от концентрации растворенных веществ, называют криоскопией и эбуллиоскопией.
Для определения молярной массы веществ экспериментально определяют повышение температуры кипения или понижение температуры замерзания растворов. Если известны массы растворенного вещества и растворителя, то молярную массу растворенного вещества МВ рассчитывают по уравнению:
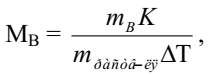
где mВ – масса растворенного вещества, г;
m раств-ля – масса растворителя, кг;
К – криоскопическая или эбуллиоскопическая константа.
Самопроизвольный переход растворителя через полупроницаемую мембрану, разделяющую раствор и растворитель или два раствора с различной концентрацией растворенного вещества, называется осмосом. Осмос обусловлен диффузией молекул растворителя через полупроницаемую перегородку, которая пропускает только молекулы растворителя. Молекулы растворителя диффундируют из растворителя в раствор или из менее концентрированного раствора в более концентрированный, поэтому концентрированный раствор разбавляется, при этом увеличивается и высота его столба.
Количественно осмос характеризуется осмотическим давлением, равным силе, приходящейся на единицу площади поверхности и заставляющей молекулы растворителя проникать через полупроницаемую перегородку.
Осмотическое давление возрастает с увеличением концентрации растворенного вещества и температуры. Вант-Гофф предположил, что для осмотического давления можно применить уравнение состояния идеального газа:
π∙V = nRT,
π = nRT/V,
π = СRT,
где π – осмотическое давление;
С – молярная концентрация раствора;
R – универсальная газовая постоянная;
T – абсолютная температура.

Рисунок 1.5 - Схема осмометра: 1 – вода; 2 – раствор; 3 – полупроницаемая мембрана
Осмотическое давление измеряется либо в кПа, тогда R=8,31Дж/моль∙К; либо в атмосферах, тогда
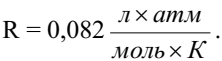
Осмос играет очень важную роль в биологических процессах, обеспечивая поступление воды в клетки и другие структуры. Растворы с одинаковым осмотическим давлением называют изотоническими. Если осмотическое давление выше внутриклеточного, то оно называется гипертоническим, если ниже – гипотоническим.
Гипертонические растворы сахара (сироп) и соли (рассол) широко применяются для консервирования продуктов, так как вызывают удаление воды из микроорганизмов.
Изучение разбавленных растворов неэлектролитов показало, что коллигативные свойства – понижение давления пара ∆р, изменение температур замерзания ∆tзам и кипения ∆tкип, осмотическое давление π изменяются пропорционально количеству растворенного неэлектролита. Экспериментально обнаружено, что для растворов электролитов осмотическое давление (π), ∆tкип, ∆tзам превышают значения, рассчитанные по законам Рауля и Вант-Гоффа.
Шведский ученый С. Аррениус пришел к выводу, что причиной отклонения растворов электролитов от идеальных растворов является распад молекул электролита на ионы. Процесс распада молекул электролита на ионы назвали диссоциацией.
Для применения законов идеальных растворов к растворам электролитов Вант-Гофф ввёл в соответствующее уравнение поправочный коэффициент i, называемый изотоническим, который показывает, во сколько раз возрастает число частиц в растворе в результате диссоциации:
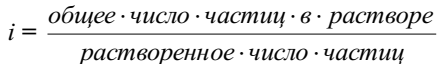
Изотонический коэффициент i для каждого раствора может быть определен экспериментально:
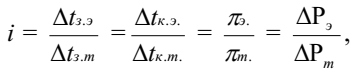
где индекс «э» обозначает экспериментально определенные величины; индекс «т» - теоретические.
Следовательно, для растворов электролитов формулы, выведенные ранее, принимают вид:
∆tзам = i ККСm
∆tкип = i КЭСm
π = iСВRT
Для растворов электролитов значение изотонического коэффициента i>1; для неэлектролитов i=1.
Диссоциация в растворе увеличивает число частиц, поэтому коэффициент Вант-Гоффа принимает значения больше единицы. Диссоциация зависит от природы растворителя: чем полярнее растворитель, тем сильнее диссоциация.
Для качественной характеристики полноты диссоциации введено понятие степени диссоциации (α). Степень диссоциации рассчитывается как отношение числа молекул, распавшихся на ионы, к общему числу его молекул в растворе:
α= Nд/Nр
где Nд – число диссоциированных молекул;
Nр – число растворенных молекул электролита.
По степени диссоциации электролиты условно под разделяют на сильные (α>30%) и слабые (α<3%). К сильным электролитам относят почти все соли, из наиболее важных кислот и оснований к ним принадлежат Н2SO4, НСl, HBr, HI, HNO3, NaOH, KOH, Ba(OH)2. К слабым электролитам принадлежит большинство органических кислот, а также некоторые неорганические соединения: Н2S, HCN, H2CO3, H2SO3, HClO, H2O, H3BO3, Hg2Cl2, Fe(CNS)3 и др.
Количественно электролитическую диссоциацию как равновесный процесс можно охарактеризовать константой диссоциации, определяемой законом действующих масс. Закон действующих масс применим к обратимым реакциям, т.е. к растворам слабых электролитов. Например, для диссоциации уксусной кислоты СН3СООН:
СН3СООН ↔ Н+ + СН3СОО–
Константа диссоциации

Константа диссоциации зависит от природы растворителя, электролита и температуры, но не зависит от концентрации раствора. Константа диссоциации и степень диссоциации являются количественными характеристиками диссоциации, они связаны между собой соотношением:
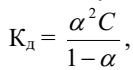
где С – молярная концентрация электролита. Это соотношение называют законом разведения Оствальда. Если электролит очень слабый, α<<1, его значением в знаменателе можно пренебречь и уравнение принимает вид:
Кд = α2С.
В водных растворах сильные электролиты практически полностью диссоциированы (α ~ 100%). Это подтверждено физическими и физико-химическими методами исследования. В отличие от растворов слабых электролитов их растворы содержат значительно большее число ионов. Это приводит к сильному межионному взаимодействию. Как следствие, возникает эффект уменьшения числа ионов, участвующих в химических процессах. Именно поэтому определяемая степень диссоциации сильных электролитов является кажущейся степенью диссоциации, т.к. она не соответствует реальной степени распада электролита на ионы. Степень диссоциации для сильных электролитов рассчитывается по формуле:
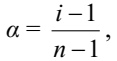
где α – степень диссоциации растворенного вещества;
i - изотонический коэффициент;
n - число ионов, на которые распадается электролит.
Например, для сульфата алюминия
Al2(SO4)3 = 2Al3 +3SO42- число ионов n=5.
Таким образом, можно считать, что во всех процессах в растворах электролитов участвуют лишь «активные ионы», т.е. ионы, не принимающие в данный момент участия в межионных взаимодействиях. Для оценки концентрационных эффектов в растворах сильных электролитов вводится величина, называемая активностью (a). Под активностью электролита понимают эффективную концентрацию, в соответствии с которой он участвует в различных процессах. Активность связана с истинной концентрацией растворенного вещества соотношением:
а = f·CB,
где а – активность электролита, моль/л;
f – коэффициент активности;
CB – молярная концентрация, моль/л.
В разбавленных растворах природа электролитов незначительно влияет на значения коэффициентов активности. Количественной характеристикой межионных электростатических взаимодействий является ионная сила раствора (I). Ионной силой раствора называют величину, измеряемую полусуммой произведений концентраций всех находящихся в растворе ионов на квадрат их заряда.
Например, для 0,1М раствора ZnSO4 ионная сила раствора будет равна:
I = ½ (0,1∙22 + 0,1∙22) = 0,4
В 1923 г. П.Дебай и Э. Хюккель показали, что для разбавленных водных растворов с ионной силой I≤0,01 коэффициент активности ионов можно рассчитать по формуле:
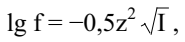
где z – заряд иона,
I – ионная сила раствора.
Тема 1.4 Поверхностные явления. Поверхностная энергия. Поверхностное натяжение растворов. Физическая и химическая адсорбция. Адсорберы. Уравнения Гиббса, Фрейндлиха, Ленгмюра. Функции и свойства биологических мембран живой клетки.
Вещество в конденсированном состоянии обладает поверхностной энергией, обусловленной нескомпенсированностью силовых полей частиц на поверхности раздела фаз. Термин «поверхностная энергия» обычно используется применительно к границе раздела фаз газ - твердое тело. Для границы раздела жидкость – жидкость, жидкость – твердое тело применяют термин «межфазная энергия». Для границы раздела фаз жидкость – газ (пар) обычно используют термин «удельная (на 1 м2) поверхностная энергия», называемая поверхностным натяжением, которое равно работе образования единицы площади раздела фаз (Дж/м2). Обычно под поверхностной энергией понимается энергия Гиббса образования поверхности ΔG. Она равна произведению удельной поверхностной энергии (σ) на площадь поверхности раздела фаз( S )-- ΔG = σ×S. Удельная поверхностная энергия определяется природой вещества. Чем выше энергия взаимодействия между частицами вещества, тем выше удельная поверхностная энергия.
Вследствие наличия поверхностной энергии на границе раздела фаз происходит накопление тех или иных частиц. Изменение концентрации вещества на границе раздела фаз называется адсорбцией. Адсорбция – это разновидность сорбции, т.е. поглощение одного вещества другими веществами. Если вещество поглощается всем объемом другого, то происходит абсорбция, если вещество концентрируется на поверхности раздела фаз, то имеет место адсорбция. Вещество, способное поглощать, адсорбировать другое, называется адсорбентом, вещество, которое может адсорбироваться – адсорбтивом, а адсорбированное вещество адсорбатом. Процесс, обратный адсорбции, называется десорбцией.
По природе сил взаимодействия адсорбента и адсорбтивом различают адсорбцию физическую и химическую. Физическая адсорбция вызывается силами межмолекулярного взаимодействия (силами Ван-дер-Ваальса). Теп лота физической адсорбции составляет 8,3−25,1 КДж/моль. Процесс физической адсорбции протекает быстро, так как не требует активации молекул.
Химическая адсорбция осуществляется за счет химических сил межмолекулярного взаимодействия и называется хемосорбцией. Хемосорбция сопровождается взаимодействием адсорбента и адсорбтива и является практически необратимым процессом. Тепловой эффект хемосорбции сопоставим с тепловым эффектом химических реакций и достигает 500 КДж/моль. Примером хемосорбции является адсорбция кислорода поверхностью активированного угля. При нагревании системы поверхности удаляется не О2 , а СО.
Величину адсорбции обозначают (Г) и выражают количеством вещества-адсорбата (n) на единицу поверхности адсорбента (S) или массы адсорбента (m). Вычисляют по формулам
Г = n/S или Г = n/m
Адсорбция может происходить на границе раздела: жидкость – газ; жидкость – жидкость; твердое тело - газ; твердое тело – раствор. Зависимость величины адсорбции от концентрации раствора устанавливает уравнение изотермы Гиббса, которое универсально с точки зрения термодинамики и применимо к границам раздела любых фаз:
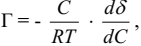
где Г –- величина адсорбции, моль/кг или моль/м2;
С – концентрация раствора, моль/л;
R – газовая постоянная;
Т – абсолютная температура;
dδ/dC – мера поверхностной активности адсорбтива, (Дж*л)/(м*моль). Знак производной dδ/dC указывает на характер зависимости.
Адсорбция на границе твердое тело – раствор имеет сложный характер из-за физической неоднородности поверхности твердых тел. В процессе адсорбции участвует не только внешняя, но и внутренняя поверхность адсорбента. Кроме того, адсорбция из растворов на твердом адсорбенте осложняется наличием третьего компонента – среды, молекулы которой могут также адсорбироваться на его поверхности.
Адсорбцию растворов средних концентраций и газов средних давлений на твердой поверхности описывает эмпирическое уравнение Фрейндлиха. Применительно к адсорбции растворов на твердом адсорбенте уравнение Фрейндлиха имеет вид
Г = К*С1/a,
где К – константа, при С = 1 моль/л,К = Г;
1/a – константа (адсорбционный показатель), зависит от природы адсорбента и температуры. 1/a = 0,1−1.
Более универсальной является теория межмолекулярной адсорбции Ленгмюра. Уравнение изотермы адсорбции Ленгмюра выведено на основании теоретических предпосылок и справедливо для широкого интервала концентрации и разных границ раздела фаз (жидкость – газ; жидкость – жидкость; твёрдое – газ; твёрдое – жидкость). Изотерма адсорбции Ленгмюра выражается уравнением
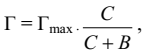
где Г – величина адсорбции, моль/кг;
Гmax – величина предельной адсорбции, моль/кг;
С – концентрация раствора, моль/кг;
В – константа равновесия адсорбции.
Величина константы В зависит от природы адсорбента и адсорбтива. При низких концентрациях адсорбция растёт линейно с увеличением концентрации. При высоких концентрациях (С>>В) значением В в знаменателе можно пренебречь, тогда Г = Гmax. Это означает, что с увеличением концентрации адсорбция достигает предельного значения (Гmax).
Адсорбционные явления широко распространены в природе. Горные породы и почвы являются адсорбентами, по которым перемещаются водные и газовые растворы. Легочная ткань подобна адсорбенту носителю, на котором удерживается гемоглобин крови, обеспечивающий перенос кислорода в организме. Многие функции биологических мембран живой клетки связаны со свойствами их поверхности. Общая площадь биологических мембран в организме человека достигает тысяч квадратных метров.
Раздел 2. Коллоидная химия
Тема 2.1 Общая характеристика дисперсных систем. Классификация коллоидных систем. Методы получения. Молекулярно-кинетические свойства. Агрегатная устойчивость и коагуляция.
Классификацию дисперсных систем проводят на основании различных признаков: размера частиц, агрегатного состояния дисперсной фазы и дисперсионной среды, характеристик взаимодействия частиц.
По степени дисперсности системы подразделяют на три типа ( табл.2.1.):
1. Молекулярные или ионные растворы: а < 10 -9 м.
Частицы этих систем представляют собой молекулы или ионы, а сами системы являются истинными растворами, обладающими и кинетической и термодинамической устойчивостью.
2. Коллоидные системы: а =10 -7 - 10 -9 м.
Это системы с хорошо развитой поверхностью раздела между фазами. Их частицы не оседают под действием силы тяжести, проходят через бумажные фильтры, но задерживаются растительными и животными мембранами. Благодаря малому размеру частиц и их непрерывному движению, эти системы кинетически устойчивы. Важной особенностью коллоидных систем является их высокая агрегативная устойчивость, которая проявляется в способности системы сохранять постоянной во времени степень дисперсности. Этот тип устойчивости связан с наличием на поверхности частиц двойного ионного и адсорбционно- сольватного слоев. Первый из них обусловливает электростатическое отталкивание одноименно заряженных частиц, а второй препятствует соприкосновению частиц и их слипанию.
Однако, являясь высокодисперсными гетерогенными системами с высокоразвитой поверхностью раздела фаз, они обладают избытком поверхностной энергии, что объясняет их термодинамическую неустойчивость. Коллоидные системы прозрачны, рассеивают свет (опалесцируют).
3. Грубодисперсные системы: а >10 -7 м.
Эти системы кинетически неустойчивы, под действием силы тяжести расслаиваются на две фазы. К таким системам относят: а) суспензии - взвеси глины, крахмала, муки, дрожжей в воде, холодное молоко; б) эмульсии - масло в воде, вода в нефти; в) пены – пивная, мыльная, противопожарная; г) дымы; д) пыли – сахарная, мучная, цементная и др.
Таким образом, коллоидные системы, называемые иначе золями, занимают промежуточное положение между истинными растворами и грубыми дисперсиями.
По агрегатному состоянию дисперсной фазы и дисперсионной среды можно выделить следующие типы дисперсных систем (табл. 2.2).
Таблица 2.1 - Классификация дисперсных систем по размеру частиц дисперсной фазы
| Группы | а, м | D =1/a, (м-1) | Характеристика |
| Молекулярно- дисперсные, истинные растворы | 10 -9 | 10 9 | Проходят через все бумажные фильтры. Не видны даже в самый сильный микроскоп |
| Коллоидные системы (туман, молоко, растворы серы, серебра) | 10 -7 - 10 -9 | 10 7 - 10 9 | Частицы проходят только через самые тонкие фильтры, задерживаются микрофильтрами. Видны в ультрамикроскоп |
| Грубодисперсные системы суспензии (глина в воде) Эмульсии (масло в воде) | >10 -7 | 10 7 | Не проходят через бумажный фильтр. Быстро оседают. Видимы в микроскоп |
Таблица 2.2 - Классификация дисперсных систем по агрегатному состоянию дисперсной фазы и дисперсионной среды
| Агрегатное состояние дисперсной фазы | Агрегатное состояние дисперсионной среды | Условное обозначение | Примеры дисперсных систем |
| Твердая | Газообразная | Т/Г аэрозоли | Сахарная и мучная пыль, табачный дым, цементная пыль |
| Жидкая | Т/Ж эмульсии | Холодное молоко, коллоидные растворы металлов | |
| Твердая | Т/Т твердые растворы | Сплавы металлов, искусственные драгоценные камни, цветные стекла | |
| Жидкая | Газообразная | Ж/Г аэрозоли | Аэрозоли: туман, облака, бытовая химия |
| Жидкая | Ж/Ж эмульсии | Горячее молоко, крема, мази | |
| Твердая | Ж/Т | Опал, жемчуг и другие минералы | |
| Газ | Жидкая | Г/Ж пены | Муссы для волос, пиво |
| Твердая | Г/Т | Пенопласт, пемза, активированный уголь |
По кинетическим свойствам дисперсной фазы дисперсные системы подразделяют на два класса:
1) свободнодисперсные – системы, в которых частицы дисперсной фазы не связаны между собой и могут свободно перемещаться (лиозоли, суспензии, эмульсии);
2) связанодисперсные – системы, в которых одна из фаз закреплена и не может перемещаться свободно (гели, студни, пены).
По характеру взаимодействия частиц дисперсной фазы и дисперсионной среды коллоидные системы делят на две группы: лиофильные и лиофобные. Лиофобными называют коллоидные системы, у которых дисперсная фаза слабо взаимодействует с дисперсионной средой. К ним относятся золи сульфидов мышьяка, сурьмы, кадмия, золи благородных металлов. Лиофильными называют коллоидные системы, в которых дисперсная фаза активно взаимодействует с дисперсионной средой. Лиофильные коллоиды образуются при самопроизвольном растворении веществ в соответствующих растворителях. К ним относятся водные растворы белков, целлюлозы, крахмала, растворы каучуков в жидких углеводородах.
Тема 2.2 Строение лиофобных золей. Строение мицеллы золя. Способы очистки коллоидных растворов. Строение двойного электротехнического слоя. Потенциалы. Значение коллоидных систем.
Коллоидные системы, в которых дисперсной фазой является нерастворимое вещество, а дисперсионной средой жидкость называют золями. Структурной единицей дисперсной фазы является мицелла, частица, состав которой зависит от условий получения золя.
В качестве примера рассмотрим строение коллоидных частиц (мицелл) сульфата бария, полученного в реакции обмена между сульфатом калия и хлоридом бария:
Na2SO4 + BaCl2 = BaSO4 + 2NaCl
Для получения устойчивого золя необходимо, чтобы один из электролитов Na2SO4 или BaCl2 присутствовал в избытке в качестве стабилизатора. В этих условиях нерастворимое вещество не выпадает в осадок, а переходит в коллоидное состояние – образуется золь. Нерастворимое вещество, образовавшееся в результате реакции, называют зародышем или агрегатом и обозначают m BaSO4. Коэффициент m указывает число частиц вещества.
Написав уравнение диссоциации вещества, взятого и избытке, определяют природу потенциалопределяющих ионов (ПОИ), которые адсорбируются непосредственно на зародыше согласно правилу Пескова – Фаянса: на твердой поверхности преимущественно адсорбируются ионы, имеющие общую с данной поверхностью атомную группировку. Другой ион электролита называют противоионом (ПИ).
Например,
Na2SO4 = 2 Na+ + SO 2-
ПИ ПОИ
Потенциалопределяющие ионы, которые адсорбируются на зародыше, обозначаются n SO42-. Зародыш с потенциал определяющими ионами образуют ядро мицеллы. Часть противоионов адсорбируется непосредственно на ядре и составляет адсорбционный слой противоионов, его обозначают 2 (n-х) Na+.
Ядро с адсорбционным слоем противоионов составляет гранулу мицеллы или коллоидную частицу. Гранула имеет заряд, знак которого определяется знаком заряда потенциалопределяющих ионов, в данном случае его обозначают 2х−.
Заряд гранулы нейтрализуется противоионами диффузного слоя, число которых составит 2хNa+. Гранула вместе с диффузным слоем составляет мицеллу золя, которая не имеет заряда. Таким образом, схема строения мицеллы золя BaSO4, полученного в избытке Na2SO4, имеет вид:

Как следует из строения мицеллы BaSO4, на поверхности кристалла BaSO4 образовался двойной электрический слой (ДЭС). Потенциалопределяющие ионы адсорбционного слоя (nSO42-) образуют первый слой двойного электрического слоя, а все противоионы – его второй слой, ионы которого делятся на плотный адсорбционный слой 2 (n-х) Na+ и подвижный диффузный слой (2х Na+).
Рассуждая подобным образом, можно записать формулу мицеллы в избытке BaCl2.
Диссоциация BaCl2 = Ba2+ + 2Cl-
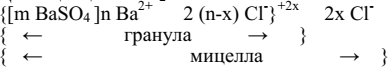
Мицеллы золей электронейтральны. Числа m, n, x изменяются в широких пределах в зависимости от условий получения золя. Ядро вместе с противоионами адсорбционного слоя образуют коллоидную частицу или гранулу. В отличие от электронейтральной мицеллы коллоидная частица имеет заряд.
Основными способами получения дисперсных систем являются диспергирование и конденсация.
Метод диспергирования заключается в тонком измельчении твердых материалов или жидкостей и распределении их частиц в жидкой или газообразной среде, в результате чего образуются коллоидно-дисперсные системы.
Механическое диспергирование включает дробление веществ до частиц колоидных размеров.
Физико-химическое диспергирование (пептизация) это процесс превращения в коллоидную систему свежеприготовленного осадка с частицами коллоидной степени дисперсности. В этом случае не изменяется степень дисперсности частиц, а происходит только их разъединение. Метод основан на действии электролитов – пептизаторов, способных хорошо адсорбироваться на поверхности частиц и сообщать им заряд. Вследствие приобретенного заряда частицы отталкиваются друг от друга, и коллоидный частицы равномерно распределяется по объему раствора.
Метод конденсации состоит в укрупнении частиц или агрегации молекул и ионов. Конденсация может быть физической и химической. В том и в другом случае метод конденсации основан на образовании в гомогенной среде новой фазы, имеющей коллоидную степень дисперсности частиц.
К методам физической конденсации относят метод конденсации испаряющегося вещества при понижении температуры и метод замены растворителя. Последний метод основан на том, что растворитель в истинном растворе заменяется на другой, в котором это вещество не растворяется.
К методам химической конденсации относятся процессы получения золей в ходе химических реакций различных типов: окисления- восстановления, гидролиза, обмена, разложения.
Например, образование золя йодида серебра:
AgNO3 +KI = KNO3+ AgI
или золя серы:
3Na2S2O3 + H2SO4 = Na2SO4 + H2O + 4S
В результате протекания подобных реакций в условиях малой концентрации реагирующих веществ вместо ожидаемого осадка образуется золь труднорастворимого вещества.
Коллоидные системы, полученные методом химической конденсации, содержат примеси молекул и ионов электролитов. Для их очистки используют способность мелкопористых пленок (мембран) задерживать частицы дисперсной фазы. Метод основан на разнице размеров частиц и скорости диффузии истинно и коллоидно растворенных веществ через полупроницаемые перегородки и называется диализом. Прибор для очистки золей называется диализатором. В качестве полупроницаемых мембран используют пергамент, пленки из нитро- и ацетилцеллюлозы, коллодия и целлофана. Скорость диализа мала, но ее можно значительно увеличивать действием электрического тока на ионы растворенной примеси. Такой метод очистки называют электродиализом.
Используя мелкопористые материалы, коллоидные системы можно концентрировать, «продавливая» их через ультрафильтры (полимерные пленки с размером пор 10-6 -10-5 см). Этот метод называется ультрафильтрацией.
Независимо от механизма образования ДЭС непременным условием его возникновения является достаточно высокая плотность расположения зарядов в слое потенциалобразующих ионов. Электростатические силы притяжения такого слоя способствуют возникновению второго слоя из ионов противоположного знака. Образование двойного слоя ионов приводит к появлению электрических потенциалов на границе раздела твердой и жидкой фаз. Ионы первого слоя, фиксированные на твердой поверхности, придают этой поверхности свой знак заряда и создают на ней поверхностный или φ- потенциал. Знак φ- потенциала совпадает со знаком заряда ПОИ. Величина φ- потенциала пропорциональна числу зарядов этих ионов на поверхности частиц. Прямых методов его измерения не имеется.
Второй потенциал, характеризующий двойной слой ионов, называют электрокинетическим или ζ - потенциалом (дзета – потенциалом). Он представляет собой электрический потенциал в двойном слое на границе между частицей, способной к движению в электрическом поле (гранулой) и окружающей жидкостью. Дзета – потенциал близок по величине потенциалу на границе адсорбционноо и диффузного слоя противоионов.
Благодаря наличию дзета – потенциала на границах скольжения частиц дисперсной фазы возникают одноименные заряды и электростатические силы отталкивания препятствуют процессам агрегации. Таким образом, ζ – потенциал является одним из основных факторов агрегативной устойчивости гидрофобных золей.
К молекулярно-кинетическим свойствам дисперсных систем относятся броуновское движение, диффузия, осмос.
Броуновское движение – это непрерывное хаотическое движение частиц дисперсной фазы под действием ударов частиц дисперсионной среды.
Диффузия – это самопроизвольный процесс выравнивания концентрации частиц дисперсной фазы по всему объему системы под влиянием броуновского движения.
Электрокинетические явления основаны на взаимосвязи между электрическими и кинетическими свойствами дисперсных систем. Если к коллоидной системе приложит разность потенциалов, то дисперсная фаза и дисперсионная среда двигаются в разных направлениях. Перемещение частиц дисперсной фазы в электрическом поле называют электрофорезом. При электрофорезе происходит направленное перемещение частиц дисперсной фазы в электрическом поле постоянного тока к электроду, знак которого противоположен знаку заряда коллоидных частиц. Противоионы диффузного слоя перемещаются при этом к противоположному электроду. Скорость движения частиц дисперсной фазы пропорциональна величине ζ – потенциала.
Величина ζ - потенциала связана со скоростью электрофореза заряженных частиц уравнением Гельмгольца – Смолуховского:
ζ =К π η V/ ε X,
где К – коэффициент, зависящий от формы частиц; η – вязкость среды;
V - линейная скорость перемещения частиц;
ε - относительная диэлектрическая проницаемость среды;
X - напряженность поля.
Наблюдая электрофоретическое движение частиц, можно определить знак и величину ζ - потенциала.
Перемещение дисперсной фазы через неподвижную мембрану под действием приложенного напряжения называют электроосмосом.
Оптические свойства дисперсных систем обусловлены их гетерогенностью и дисперсностью. На оптические свойства влияют структура, размер и форма частиц дисперсной системы. Прохождение света через дисперсную систему сопровождается следующими явлениями: преломлением, поглощением, отражением и рассеянием. Преобладание какого-либо из этих явлений зависит в основном от соотношения длины волны света и размера частиц дисперсной фазы.
В грубодисперсных системах размер частиц больше длины волны видимого света, поэтому световые лучи, проходящие через грубодисперсную систему, отражаются и преломляются на границе частиц со средой, обусловливая их мутность.
В истинных растворах светорассеяние ничтожно мало, так как размер частиц дисперсной фазы очень мал и нет препятствий для прохождения лучей.
Наиболее характерным оптическим свойством коллоидных систем является опалесценция (светорассеяние). Коллоидные частицы меньше длины волны света, поэтому рассеяние света обусловлено не отражением от поверхности частиц, а дифракцией. Рассеяние света было исследовано Тиндалем, который обнаружил, что при освещении коллоидного раствора световым пучком его путь при наблюдении сбоку имеет форму светящегося конуса – конуса Тиндаля.
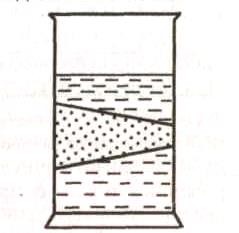
| 
|
Рисунок 2.1 - Конус Тиндаля
Для интенсивности рассеянного света Релеем была выведена зависимость:
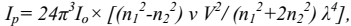
где Ip – интенсивность рассеянного света;
Iо – интенсивность падающего света;
n1 и n2 – показатели преломления дисперсной фазы и дисперсионной среды;
ν – концентрация;
V – объем одной частицы;
λ – длина световой волны.
Из уравнения видно, что интенсивность рассеянного света обратно пропорциональна четвертой степени длины волны. Если падающий свет полихроматичен, то при боковом освещении золи имеют синеватую окраску, а в проходящем – красную.
На интенсивности рассеяния лучей коротковолновой части спектра основано применение ламп синего цвета для светомаскировки и красного для сигналов опасности. Красный свет виден на большом расстоянии из-за малого
светорассеяния. По этой причине противотуманные фары имеют оранжевую окраску.
Под устойчивостью дисперсной системы понимают постоянство во времени ее состояния и основных свойств: дисперсности, равномерного распределения частиц дисперсной фазы в объеме дисперсионной среды и характера взаимодействия между частицами. Н.П. Песков ввел понятие о двух видах устойчивости дисперсных систем: седиментационной (кинетической) и агрегативной. Седиментационная устойчивость позволяет сохранять равномерное распределение частиц в объеме. Основными условиями этой устойчивости являются высокая дисперсность и участие частиц дисперсной фазы в броуновском движении. Агрегативная устойчивость дисперсных систем – это способность сохранять во времени степень дисперсности. Причиной этого типа устойчивости является наличие одинакового заряда коллоидных частиц.
Вопросы устойчивости дисперсных систем занимают важное место в коллоидной химии. Обладая большой суммарной площадью поверхности раздела фаз, дисперсные системы имеют избыток свободной поверхностной энергии
G= σ S,
где σ – поверхностное натяжение;
S – суммарная площадь поверхности раздела фаз.
Вследствие этого коллоидные системы термодинамически неустойчивы и стремятся перейти в более устойчивое состояние с меньшим значением G. Это возможно либо за счет уменьшения σ, либо уменьшения S (укрупнения частиц). Процесс объединения частиц дисперсной фазы в более крупные агрегаты, сопровождающиеся выпадением осадка труднорастворимого вещества, называют коагуляцией.
Коагуляция протекает самопроизвольно, т.к. ведет к уменьшению суммарной поверхности и, следовательно, снижению поверхностной энергии. Факторами, вызывающими коагуляцию, могут быть: изменение температуры, действие света, различных излучений, механическое воздействие. Однако наиболее важным фактором является действие электролитов. Электролиты, добавленные к золям, быстро и резко влияют на величину φ и ζ – потенциалов, вызывая сжатие ДЭС.
Закономерности влияния электролитов на процессы коагуляции установлены Шульце и Гарди и известны как правило Шульце – Гарди: коагулирующим действием обладает тот ион электролита, который имеет заряд, противоположный заряду гранулы; коагулирующее действие тем сильнее, чем выше заряд иона- коагулятора.
Минимальная концентрация электролита, при которой данный электролит вызывает коагуляцию, называется порогом коагуляции.
Его рассчитывают:
Ск = (Сэк × V) электролита / (Vзоля + Vэлектролита) (моль/л),
где Сэк – молярная концентрация эквивалентов электро- лита;
V золя - объем золя (л);
V электролита – объем электролита (л).
Величина, обратная порогу коагуляции, называется коагулирующей способностью:
Vк = 1/ Ск (л/моль)
Коагулирующая способность равна объему золя в литрах, скоагулированного одним молем электролита.
Отношение порогов коагуляции для ионов разных зарядов было найдено теоретически Б.В. Дерягиным и Л.Д. Ландау, и названо законом шестой степени. Согласно закону Дерягина-Ландау соотношение порогов коагуляции одно-, двух - и трехзарядных ионов имеет вид:
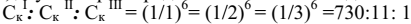
Правило Шульце – Гарди на основании опытных данных дает для тех же ионов соотношение 500: 25: 1.
Таким образом, с увеличением зарядов ионов – коагуляторов порог коагуляции уменьшается, а коагулирующая способность возрастает.
Коллоидные системы широко распространены в природе. Пыль, туман, табачный дым, золи металлов, их сульфидов и солей являются важнейшей составной частью животных и растительных организмов, например, белки, кровь, лимфа, углеводы находятся в коллоидном состоянии. Коллоидные системы занимают важное место в различных областях промышленности. Пищевая, текстильная, резиновая, кожевенная, лакокрасочная, мыловаренная, производство пластических масс, строительных материалов – все это связано с коллоидными системами. Из продуктов питания – это соки, мороженое, майонез, маргарин, бульоны, сливки и др.
Основной составной частью почвы, влияющей на ее плодородие, являются почвенные коллоиды минеральные, органические и органоминеральные. Для борьбы с вредителями культурных растений широко используются суспензии и эмульсии различных веществ и аэрозоли – коллоидные системы с газообразной дисперсной средой.
Тема 2.3 Грубодисперсные коллоидные системы. Общая характеристика эмульсий, пены, суспензий. Аэрозоли: дымы, пыли. Системы с твердой дисперсионной средой.
Аэрозоли - это дисперсные системы с газовой дисперсионной средой. По агрегатному состоянию различают такие аэрозоли: системы с жидкой дисперсной фазой - туманы; системы з твердой фазой - дымы (размер частиц от 10-9 до 10-5 м) и пыли (размер частиц больше 10-5 м). Дымы, которые образуются при сгорании топлива и адсорбируют влагу из атмосферы, являются одновременно дымами и туманами. Такие системы существуют над большими промышленными городами и именуются смогом. Они опасны для здоровья.
По происхождению аэрозоли делят на диспергационные и конденсационные. Диспергационные аэрозоли получают при дроблении твердых тел или распылении жидкости. Высокодисперсные аэрозоли можно получить конденсационным методом или с помощью химических реакций. Молекулярно-кинетические свойства. Поскольку газовая среда имеет более низкую вязкость, то броуновское движение в аэрозолях более интенсивнее, чем в золях. Кинетические особенности аэрозолей проявляются и другими явлениями. Явление термофорезапроявляется в движении частиц аэрозоля по направлению к снижению температуры. Причиной этого является то, что на более нагретую сторону частицы молекулы газа ударяют с большей скоростью, чем на менее нагретую, потому и частица движется по направлению снижения температуры. Фотофорез - это движение частиц аэрозоля по направлению к световому потоку. Термопреципитация - это осаждение частиц на холодных поверхностях в следствие термофореза. Примером термопреципитации служит оседание пыли на стенах возле радиаторов, ламп, печей и др.
Оптические свойства. Аэрозоли отличаются ярко выраженной способностью к светорассеиванию, что повязано с большой разницей показателей преломления дисперсной фазы и газовой среды. Поэтому аэрозоли применяют для образования дымовых завес.
Электрические свойства. Аэрозольные частицы не имеют парных электрических слоев. Электрический заряд возникает при столкновении частиц между собой, или при адсорбции ионов, которые образуются при ионизации газов под действием космических, ультрафиолетовых и радиоактивных излучений. То есть, заряд частиц аэрозоля случаен. При осаждении заряженных частиц аэрозоля возникает потенциал седиментации. Скорость седиментации усиливается конвекцией, в этих условиях достигается большое напряжение поля, которое соответствует молнии.
Стойкость аэрозолей. Аэрозоли агрегативно очень нестойки, вследствие отсутствия электростатического и адсорбционно-сольватного барьеров. Скорость коагуляции увеличивается с повышением концентрации аэрозоля, механического перемешивания, ультразвуковых колебаний. На стойкость туманов особенно влияет температура.
Разрушение аэрозолей. Поскольку аэрозоли засоряют атмосферу, то возникает необходимость в их обезвреживании. Для обезвреживания аэрозолей используют циклоны, электрофильтры, бумажные, асбестовые, пористые керамические фильтры и т.п. В циклонах частицы аэрозолей осаждаются под действием центрифужной силы. В электрофильтрах частицы заряжаются и осаждаются на одном из электродов. Аэрозоли обезвреживают также введением веществ, которые могут быть центрами кристаллизации или конденсации. Так, при распылении твердого СО2 или АgI образуется конденсат пара воды, который выпадают в виде дождя.
Применение аэрозолей. Аэрозоли применяют для покраски поверхностей, распыления топлива перед горением, распыления удобрений и ядохимикатов. В фармации широко используют аэрозольную лекарственную форму, которая объединяет в себе несколько лекарственных веществ и является простой в использовании. Обязательным компонентом аэрозольных смесей являются пропеленты (фреоны, непосредственно фторхлоруглеводороды) или такие газы, как пропан, бутан.
Порошки - это системы с газовой средой и твердой фазой, которая состоит из частиц размером от 10-8 до 10-4 м. Порошки получают дроблением твердых тел с помощью мельниц: жерновых, шаровых, вибрационных, молотковых и др. В аптеках для этого пользуются ступкой з пестиком. Каждый порошок неоднороден за размерами частиц. Для определения размера частиц порошков используют специальные сита.
Насыпной плотностью называют массу единицы объема порошка. Для ее определения в цилиндр маленькими порциями, постукивая, насыпают порошок и взвешивают. У грубых порошков насыпная плотность почти не зависит от размера частиц, но из увеличением дисперсности порошка начинают действовать междумолекулярные силы, которые увеличивают трение между частицами и способствуют образованию более рыхлой структуры, поэтому насыпная масса уменьшается.
Распыление порошков (перевод в состояние, подобное жидкому). Если через слой порошка продуть снизу газ, то порошок начнет расширятся и напоминать кипящую жидкость, поэтому и называется «кипящим слоем». В таком состоянии порошок имеет большую текучесть и напоминает жидкость.
Гранулирование порошков - это процесс перевода порошков в гранулы - агрегаты сферической или цилиндрической формы. Гранулы более стойки при сохранении, их удобнее дозировать. Механизм гранулирования состоит в том, что частицы порошка соединяются между собой, образуя агрегаты. Гранулы являются одной из лекарственных форм, из них методом прессования готовят таблетки. Порошки, гранулы, таблетки составляют до 80% современных лекарственных форм.
Суспензии - это гетерогенные системы с жидкой дисперсионной средой и твердой дисперсной фазой. От коллоидов они отличаются большим размером частиц .Наиболее часто суспензии получают диспергированием твердых веществ в жидкой среде. По молекулярно-кинетическим и оптическим свойствам суспензии очень отличаются от коллоидных систем. Из-за большого размера частиц броуновское движение в них проявляется очень слабо, а явления диффузии и осмоса им не свойственны. Свет, проходя сквозь суспензии, не рассеивается, а отражается, поэтому они мутные, эффект Тиндаля им не свойственен.
Седиментационная стойкость суспензий очень мала вследствие большого размера частиц и твердая фаза полностью выпадает в осадок за короткий промежуток времени. Стабилизируют суспензии с помощью высокомолекулярных веществ. Защитный слой этих веществ обеспечивает гидратацию частиц, кроме этого, длинные цепочки макромолекул охватывают частицы, образуя структурные решетки.
При повышении концентрации дисперсной фазы образуются высококонцентрированные суспензии - пасты. Почти все дисперсные среды в пастах связаны в сольватных пленках, которые разделяют частицы. В связи с отсутствием свободной жидкости пасты имеют большую вязкость, в них могут образовываться объемные структуры Суспензии и пасты имеют большое значение в природе и технике. К ним относятся влажный грунт, строительные вещества, масляные краски и лаки. Суспензии применяют как катализаторы в промышленности. В суспензии лекарственная форма имеет более высокую степень дисперсности, чем в порошке и поэтому быстрее и полнее проявляет свое лечебное действие. Для стабилизации лекарственных суспензий к ним добавляют желатозу, камеди, метилцеллюлозу и др. вещества. Пасты и суспензии наиболее широко используются в дерматологии, стоматологии, косметологии.
Эмульсиями являются системы, в которых дисперсионная среда и дисперсная фаза жидкие. Условием образования эмульсии есть взаимная нерастворимость жидкостей. Наибольшее значение имеют эмульсии, в которых одна из фаз - вода. Другую фазу образует неполярная жидкость, которую, независимо от природы, называют маслом. Дисперсность эмульсий изменяется в больших пределах - от капель размером 10-7 м до таких, которые можно увидеть невооруженным глазом. Эмульсии получают путем механического диспергирования (встряхиванием, перемешиванием, действием ультразвука), выдавливанием жидкости сквозь тонкие отверстия под большим давлением, методом замены растворителя.
По полярности фаз различают прямые эмульсии (первого рода), которые состоят из полярной дисперсионной среды (вода) и неполярной дисперсной фазы (масло); их обозначают м/в.; и обратные эмульсии (второго рода), в которых дисперсная среда неполярная (масло), а дисперсная фаза полярная (вода), их обозначают - в/м. Эмульсии делят на разбавленные - с долей дисперсной фазы не более 0,1% и концентрированные - с долей более 0,1%.
Эмульсии - агрегативно нестойки, что проявляется в самопроизвольном слипании капель - коалесценции, которая ведет к расслаиванию эмульсии. Для эмульсий характерно также явление седиментации - всплывание или осаждение капель дисперсной фазы. Для получения эмульсий необходимо применение эмульгаторов - веществ, снижающих поверхностное натяжение жидкости. Существует оптимальное соотношение между гидрофильными и липофильными свойствами молекул ПАВ. Вспомним, что гидрофильные свойства определяются полярной частицей молекулы ПАВ, а липофильные длинной гидрофобного хвоста. Если в эмульгаторе преобладают гидрофильные свойства, тогда молекулы ПАВ втягиваются в воду, а если преобладают липофильные свойства - то молекулы ПАВ втягиваются в масло. Соотношение гидрофильных и липофильных свойств молекул ПАВ называют гидрофильно-липофильным балансом. Размещение молекул эмульгатора в системе масло/вода в зависимости от его гидрофильных или гидрофобных свойств показано на рис. 2.2.

Рисунок 2.2 - Размещение молекул эмульгатора в системе масло/вода
Стабилизирующее действие эмульгатора состоит не столько в снижении поверхностного напряжения, сколько в образовании структурно-механического барьера. Эффективными эмульгаторами являются высокомолекулярные ПАВ (желатин, сапонины, поливиниловые спирты и др.). Эти вещества образуют на границе раздела фаз трехмерные сетки.
Для получения лекарственных эмульсий применяются неионогенные ПАВ - твины и плюроники. Вещества типа плюроник применяются для получения дисперсий лекарственных препаратов, вводящихся в систему кровообращения. Такими являются эмульсии перфторуглеводов, которые переносят кислород в «исскуственной крови». Твины применяются чаще в эмульсиях для внешнего использования. Для применения через рот лучше пользоваться прямыми эмульсиями, а при введении через кожу - эмульсии обратного типа, потому, что кожа малопроницаема для воды и разведенных в ней веществ. Процесс эмульгации под действием желчных кислот пищевых жиров (молоко, яичный желток, сметана, масло и т.д) является необходимой стадией их переваривания в кишечнике.
Пены - гетерогенные системы, в которых дисперсная фаза состоит из пузырей газа, а дисперсионная среда (жидкая или твердая) образует тонкие пленки между пузырями газа. Для образования пены применяют интенсивное перемешивание и др. методы. Для образования стойкой пены необходимо добавление стабилизаторов - пенообразователей. Процесс пенообразования состоит в том, что пузыри газа окружаются адсорбционным слоем пенообразователя, всплывают к поверхности (рис. 2.3).
Рисунок 2.3 - Процесс пенообразования
Стойкость пены можно охарактеризовать за временем жизни отдельного газового пузыря. Пена может существовать от нескольких секунд до нескольких часов. Низкомолекулярные ПАВ - спирты и жирные кислоты образуют малостойкие пены, мыла дают более стойкие пены, но наиболее стойкие пены дают глюкозиды (сапонины), таниды, красители и высокомолекулярные соединения (белки).
Разрушение пены. В ряде случаев пенообразование может быть нежелательным. Покрывая поверхность воды, пена предупреждает прохождение кислорода в воду, что губительно действует на фауну и флору. Пены разрушают механическим воздействием или добавлением ПАВ, которые имеют высокую поверхностную активность, но сами не образуют стойкой пены. Такие вещества выталкивают пенообразующее вещество из адсорбционного слоя и разрушают пленку. В производстве антибиотиков, витаминов, дрожжей, сахара для гашения пены используют масла, животные жиры.
Значение пены и пенообразования. Пенообразование используют в производстве строительных и теплоизоляционных материалов (пенобетон, пеностекло), пластичных масс (пенопласты), при обогащении полезных ископаемых (пенная флотация). Исключительное значение имеет пена в противопожарном деле. Экстракорпоральное насыщение крови кислородом осуществляется в пенных аппаратах («искусственные легкие»). Пенные аэрозоли применяют для остановки кровотечений.
Тема 2.4 Высокомолекулярные соединения и их растворы. Строение ВМС. Сходство и различия растворов ВМС с коллоидными системами. Набухание и растворение. Вязкость растворов ВМС. Механизмы старения, осмотического давления, высаливания биополимеров.
Наряду с дисперсными системами в курсе коллоидной химии изучают свойства растворов высокомолекулярных соединений (ВМС). Эти системы принципиально отличаются от коллоидных систем. Растворы ВМС – гомогенные термодинамически устойчивые обратимые системы, которые образуются самопроизвольно и по своей природе являются истинными молекулярными растворами. Однако при всех различиях их объединяет с коллоидными системами такой важные признак, как размер частиц. Молекулы ВМС – макромолекулы; как и коллоидные частицы, состоят из тысяч атомов. С этим связаны схожести оптических свойств, малая скорость диффузии, низкое осмотическое давления.
К высокомолекулярным соединениям относят вещества с молекулярной массой порядка 104-106 и выше. Они могут быть природного происхождения (белки, пектины, натуральный каучук, высшие полисахариды) или получаться синтетически в процессах полимеризации и поликонденсации (пластмассы, синтетические волокна).Природные ВМС (биополимеры) характеризуются постоянным значением молекулярной массы (М). В отличие от них синтетические полимеры являются полидисперсными системами, так как состоят из смеси макромолекул, различных по длине и массе. Поэтому молекулярная масса таких полимеров представляет собой среднее значение М.
ВМС могут образовывать как истинные, так и коллоидные растворы. Характер раствора зависит от сродства ВМС к растворителю. В растворителях, полярность которых соответствует полярности ВМС, происходит истинное растворение, с образованием молекулярных растворов (например, агар-агар и желатин в воде или каучук в неполярном растворителе). При несоответствии полярности растворителя и ВМС образуются коллоидные системы.Истинному растворению полимеров предшествует процесс набухания. Он заключается в увеличении объема и массы полимера за счет поглощения им растворителя.
Растворы ВМС в хорошо растворяющих их веществах агрегативно устойчивы. Нарушить устойчивость этих растворов можно путем ухудшения растворимости – введением электролитов, плохо растворяющих данный полимер. Например, для белков и полисахаридов такими жидкостями являются этанол и ацетон. Под влиянием вышеназванных растворов происходит процесс выделения ВМС в виде новой фазы, называемый высаливанием. В основе механизма высаливания лежит процесс дегидратации.Высаливание ВМС имеет большое практическое значение. Его применяют для фракционирования белков, полисахаридов и других веществ.
Одним из характерных свойств растворов ВМС является их старение, которое проявляется в постепенном самопроизвольном изменении вязкости растворов при стоянии. Старение вызывается действием на цепи полимеров кислорода и примесей. В результате происходит разрушение макромолекул или их агрегация.
В концентрированных растворах ВМС могут возникать ассоциаты, которые затем становятся зарождением новой фазы. Выделение новообразовавшейся фазы в виде мельчайших частиц называют коацервацией, а образующуюся двухфазную систему – коацерватом. Коацерват – термодинамически устойчивая неравновесная система, по свойствам сходная с эмульсиями. Процессу коацервации способствует не только высокая концентрация, но и низкая температура, изменение рН среды, введение низкомолекулярных электролитов.
Осмотическое давление растворов ВМС существенно и может быть измерено с достаточной точностью. Такие измерения используются для определения молекулярной массы ВМС.
Уравнение Вант – Гоффа
π = СRT/M
при высоких концентрациях для определения осмотического давления используют с поправкой Галлера:
π = СRT/M+вС2,
где в – константа, характеризующая отклонение от закона Вант – Гоффа. Она зависит от природы растворителя и растворенного вещества.
Характерной особенностью растворов ВМС является их высокая вязкость по сравнению с чистым растворителем даже при малых концентрациях. Особенно сильно это свойство проявляется у полимеров с длинными линейными макромолекулами, например у каучука. Растворы ВМС с той же молекулярной массой, но сферической формой молекул, имеют меньшую вязкость. Отсюда следует, что вязкость ВМС возрастает пропорционально асимметрии их молекул. При одинаковой химической структуре молекул вязкость возрастает с увеличением молекулярной массы. Вязкость зависит также от концентрации полимера и межмолекулярных сил взаимодействия.
Список литературы
Основная:
1. Белик, В.В. Физическая и коллоидная химия: учеб. /В.В. Белик, К.И. Киенская. -М.: Издательский центр «Академия», 2015. –288 с.
2. Физическая и коллоидная химия: учебник / А. П. Беляев, В. И. Кучук ; под ред. А. П. Беляева. - 2-е изд., перераб. и доп. - Москва : ГЭОТАР-Медиа, 2014. - 751 с.
3. Кругляков, П.М. Физическая и коллоидная химия. Практикум: Учебное пособие / П.М. Кругляков. - СПб.: Лань, 2013. - 208 c.
Дополнительная:
1. Кудряшева, Н. С. Физическая химия : учебник для бакалавров / Н. С. Кудряшева, Л. Г. Бондарева ; Сиб. федеральный ун-т. - М. : Юрайт, 2012. - 340 с.
2. Попова, А. А. Физическая химия : учеб. пособие для студ. вузов / А. А. Попова, Т. Б. Попова. - СПб. ; М. ; Краснодар : Лань, 2015. - 496 с.
3. Нигматуллин, Н.Г. Физическая и коллоидная химия: Учебное пособие / Н.Г. Нигматуллин. - СПб.: Лань, 2015. - 288 c.
Периодические издания:
1. Политематический сетевой электронный научный журнал Кубанского государственного аграрного университета (2008-2018) - https://elibrary.ru/contents.asp?id=33276704. - Дата обращения 21.06.2018.
2. Вестник Воронежского государственного аграрного университета. Аграрные науки (2008-2018) - https://elibrary. ru/contents. asp?issueid=1234170. - Дата обращения 21.06.2018.
3. Аграрный Вестник Урала (2008-2018) - https://elibrary. ru/contents. asp?issueid=447186. - Дата обращения 21.06.2018.
Internet-ресурсы:
1. Ельцов С. В., Водолазкая Н. А. Физическая и коллоидная химия: учебное пособие: Харьков, 2005. - 239 с. [Электронный ресурс]. - Режим доступа: http://dspace.univer.kharkov.ua/bitstream/123456789/119/1/physical_chem.pdf - Дата обращения 21.06.2018.
2. Левченков С.И. Лекции по курсу "Физическая и коллоидная химия" для студентов биолого-почвенного факультета ЮФУ (РГУ) - Режим доступа: http://www.physchem.chimfak.rsu.ru/Source/PCC/index.html- Дата обращения 21.06.2018.
3. Александрова С.Я., Цыро JI.B. Физическая и коллоидная химия для студентов биологических специальностей вузов в примерах и задачах: Учебно-методическое пособие. - Томск: Томский государственный ун-т, 2010. - 136 с. - Режим доступа: http://vital.lib.tsu.ru/vital/access/manager/Repository/vtls:
000398896- Дата обращения 21.06.2018.
4. Сельскохозяйственная электронная библиотека знаний (СЭБиЗ)-http://www. cnshb. ru/AKDiL. - Дата обращения 21.06.2018.
5. AGRICOLA – БД международная база данных на сайте Центральной научной сельскохозяйственной библиотеки РАСХН - http://www. cnshb. ru/f_t_jour. shtm. - Дата обращения 21.06.2018.
6. Физическая и коллоидная химия. Электронный учебник [Электронный ресурс]. - Режим доступа: http://tkptis.tula.su/docs/materials/
himiya/index.htm - Дата обращения 21.06.2018.
Дата добавления: 2020-11-23; просмотров: 1259; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
