Кристаллическая структура льда
Тема: Металлическая, водородная связь
Дата: 07.11.2020 (1 час)
Цель: изучить металлическую и водородную химические связи, принципы и механизмы связи, свойства веществ с металлической и водородной связью.
Студенты должны знать: механизм образования металлической и водородной химических связей.
Студенты должны уметь: объяснять механизмы образования металлической и водородной химических связей, характеризовать физические свойства веществ с данными видами химической связи.
План.
1. Особенности атомов металлов.
2. Особенность металлической связи.
3. Сходство металлической связи с ковалентной.
4. Особенности водородной связи.
5. Внутримолекулярная водородная связь.
6. Межмолекулярное взаимодействие.
Опорный конспект
Атомы металлов имеют ряд особенностей:
· На внешнем слое у них от одного до трёх электронов;
· У них сравнительно большие радиусы атомов;
· Атомы металлов имеют достаточное количество свободных орбиталей.
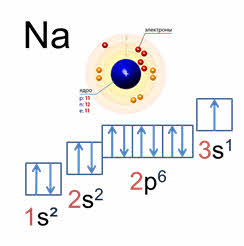
Например, у атома натрия один электрон на третьем энергетическом уровне. А на третьем энергетическом уровне всего девять орбиталей (одна эс, три пэ и пять дэ орбиталей).
Когда атомы металлов сближаются, то их свободные орбитали перекрываются и валентные электроны одного атома могут перемещаться на свободные орбитали другого атома. При этом, в кристалле металла постоянно идут два противоположных процесса: атом, который отдал электроны превращается в катион, а свободные электроны при этом, притягиваясь к положительным ионам металлов вновь превращают их в нейтральные атомы.
|
|
|
Поэтому в металлах постоянно идёт превращение атомов в ионы и наоборот, а частицы, из которых состоят кристаллы металла, называют атом-ионами.
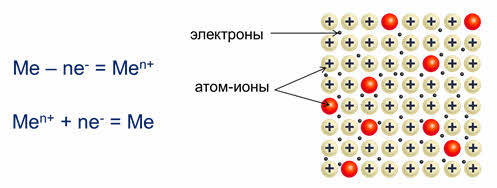
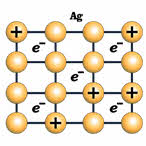
Поэтому в узлах кристаллической решётки металлов находятся как нейтральные атомы, так и катионы металла. Образовавшиеся при этом электроны перемещаются внутри кристалла металла и являются общими для всех атомов и ионов металла, связывая их между собой.
Таким образом, металлическая связь – это химическая связь, между атомами в металлическом кристалле посредством обобществления валентных электронов.
Металлическая связь характерная для металлов и сплавов и объясняет ряд физических свойств металлов: ковкость, пластичность, тепло- и электропроводность металлов, металлический блеск.

Особенностью этой химической связи является то, что она не имеет направленности в пространстве, она является коллективной, как и ионная, потому что в ней принимают участие все атомы металла.
Сходство металлической связи с ковалентной заключается в том, что при её образовании электроны обобществляются, но в металлической связи эти электроны связывают все атомы металла в кристалле, а в ковалентной связи связываются только находящиеся рядом атомы.
|
|
|
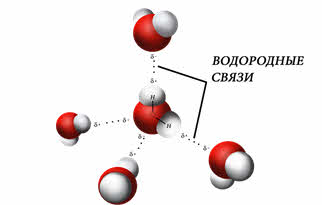
Водородная связь осуществляется между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы. Причем, чаще всего отрицательно заряженным атомом являются наиболее электроотрицательные элементы: фтор, кислород, азот, реже хлор и сера.
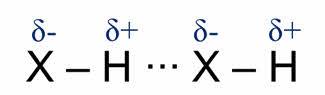
Схематично водородную связь показывают тремя точками. Образование водородной связи объясняется электростатическим взаимодействием между молекулами. При этом возникает донорно-акцепторное взаимодействие свободной орбитали атома водорода и орбитали с неподелённой парой электронов электроотрицательного атома. Из-за этого, водородная связь обладает направленностью.
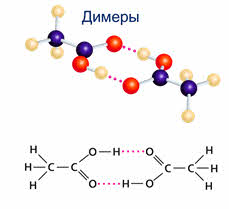
Благодаря водородной связи молекулы объединяются в ассоциаты, как, например, димеры уксусной кислоты.
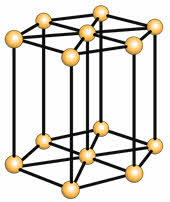
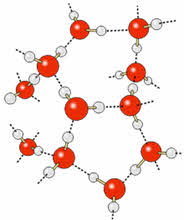
Водородные связи также определяют кристаллическую структуру льда, в которой каждый атом кислорода связан с четырьмя атомами водорода – двумя ковалентными и двумя водородными связями.
Кристаллическая структура льда
|
|
|

Водородная связь объясняет такое алхимическое правило, как «подобное растворяется в подобном», когда возникают связи между молекулами растворителя и молекулами растворённого вещества. Вещества метиловый спирт, этанол, уксусная кислота, этиленгликоль, глицерин неограниченно растворимы в воде.
Водородная связь в молекуле аммиака обуславливает его возможность легко сжижаться и вновь переходить в газообразное состояние с поглощением теплоты. Поэтому аммиак используют как хладагент в холодильных установках.

Водородная связь слабее ковалентной, поэтому она характерна для веществ в твёрдом и жидком состояниях.
Некоторые аномальные свойства веществ объясняются наличием водородной связи. Например, высокие температуры кипения воды, фтороводорода и аммиака по сравнению с аналогичными веществами, образованными элементами этих же групп других периодов, объясняются образованием ассоциатов за счёт водородных связей.
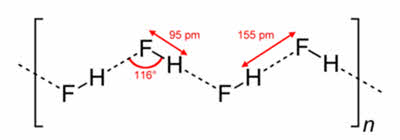
Водородная связь наиболее распространена в природе. Эта связь объясняет аномальные свойства воды, такие как высокие температуры кипения и плавления, высокую теплоёмкость и диэлектрическую проницаемость. Благодаря своей структуре лёд имеет меньшую плотность, чем жидкая вода, поэтому лёд находится на поверхности воды и глубокие водоёмы не промерзают до дна.
|
|
|
Светло-голубой цвет чистой воды и толстого льда также обусловлен водородными связями. Ещё водородная связь объясняет образование кристаллов в виде изморози и снежинок.
Водородная связь возникает и между атомами одной молекулы. Это так называемая внутримолекулярная водородная связь. Она возникает в молекулах органических веществ, которые имеют группы атомов: о-аш, эн-аш, эн-аш-два и другие.
Дата добавления: 2020-11-23; просмотров: 111; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
