При гибридизации ЧИСЛО ГИБРИДНЫХ ОРБИТАЛЕЙ всегда РАВНО ЧИСЛУ ИСХОДНЫХ АТОМНЫХ ОРБИТАЛЕЙ.
Группа№21, химия,урок№96.
Тема программы: Стоение вещества.
Тема урока: sp 2 гибридизация – молекулы этилена, хлорида бора; sp - гибридизация молекулы ацетилена, оксида углерода. Валентный угол. Длина связи.
Цель урока: Рассмотреть sp 2 гибридизацию – молекулы этилена, хлорида бора; sp - гибридизацию молекулы ацетилена, оксида углерода. Валентный угол. Длину связи.
План.
Пространственная форма молекул.
Содержание темы.
1.Углеродные атомы в молекуле этилена находятся в состоянии sp2- гибридизации, т.е. в гибридизации участвуют одна s- и две p -орбитали.
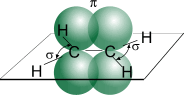
Схематическое изображение строения молекулы этилена
В результате каждый атом углерода обладает тремя гибридными sp2 -орбиталями, оси которых находятся в одной плоскости под углом 120º друг к другу, и одной негибридной гантелеобразной p-орбиталью, ось которой расположена под прямым углом к плоскости осей трех sp2 -орбиталей. Одна из трех гибридных орбиталей
Пространственная форма молекул.
Формулы Льюиса многое говорят об электронном строении и устойчивости молекул, но пока ничего не могут сказать об их пространственном строении. В теории химической связи существуют два хороших подхода к объяснению и предсказанию геометрии молекул. Они хорошо согласуются между собой.
Первый подход называется теорией отталкивания валентных электронных пар (ОВЭП). Несмотря на “страшное” название, суть этого подхода очень проста и понятна:
|
|
|
Химические связи и неподеленные электронные пары в молекулах стремятся расположиться как можно дальше друг от друга.
Поясним на конкретных примерах. В молекуле BeCl2 есть две связи Be—Cl. Форма этой молекулы должна быть такой, чтобы обе эти связи и атомы хлора на их концах располагались как можно дальше друг от друга:
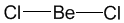
Это возможно только при линейной форме молекулы, когда угол между связями (угол ClBeCl) равен 180о.
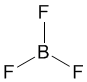
Другой пример: в молекуле BF3 имеется 3 связи B—F. Они располагаются как можно дальше друг от друга и молекула имеет форму плоского треугольника, где все углы между связями (углы FBF) равны 120о :
Еще один пример: в молекуле CH4 имеется 4 связи C—H. Все эти 4 связи расположатся максимально далеко друг от друга только тогда, когда молекула примет форму тетраэдра, у которого в центре находится атом C, а в вершинах - атомы H. Кстати, в "квадратной" молекуле расстояние между атомами водорода было бы меньше, поэтому реальная молекула CH4 имеет форму тетраэдра:
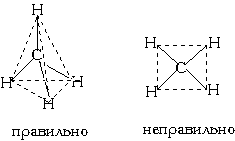
В молекуле CH4 угол НСН такой же, как в математическом тетраэдре: 109о28’.
Последний пример: молекула H2O в своем составе имеет две связи O—H и две неподеленные пары электронов. Вывод: эта молекула также должна иметь форму, похожую на тетраэдр.
|
|
|
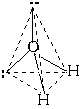
Реально этот тетраэдр слегка искажен, потому что неподеленные пары отталкиваются между собой несколько сильнее, чем от поделенных пар, и чем поделенные пары отталкиваются друг от друга. Поэтому реальный угол HOH составляет не 109о, а немногим менее 105о. Однако по центрам атомов, как можно видеть, молекула воды имеетугловую форму.
Если ввести обозначения: н.п - неподеленная пара, п.п - поделенная пара, то относительное отталкивание между ними дает такой ряд:
(н.п/н.п) > (н.п/п.п) > (п.п/п.п).
Теория отталкивания валентных электронных пар (ОВЭП) проста и наглядна. Она опирается на классическую геометрию и позволяет правильно предсказывать форму молекул.
Однако образование одинаковых связей из атомных орбиталей разного вида потребовало введения такого понятия, как ГИБРИДИЗАЦИЯ (то есть “смешивание”) атомных орбиталей. Почему это понятие стало необходимо?
Вернемся к уже знакомой нам молекуле BeCl2. Ее образование вполне понятно из электронного строения атомов бериллия и хлора, которое изображается формулами Льюиса:
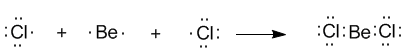
Электронная конфигурация валентной оболочки бериллия 2s2. Для реакции с двумя атомами хлора необходим переход электронов бериллия в возбужденное состояние:
|
|
|
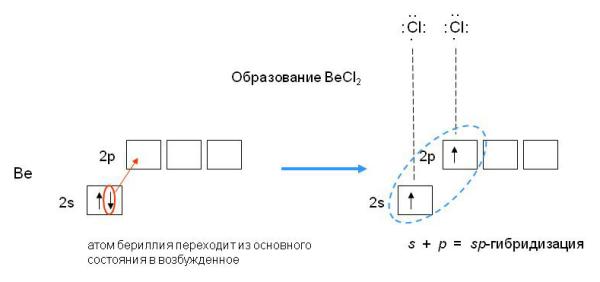
Если бы один атом хлора связывался с бериллием за счет 2s-электрона бериллия, а другой - за счет 2p-электрона бериллия, то связи Be—Cl не были бы равноценными. Однако на самом деле обе связи имеют одинаковую длину, прочность и расположены под углом 180о.
Чтобы объяснить равноценность связей Be—Cl, говорят о sp-гибридизации валентных атомных орбиталей бериллия, при которой одна s-орбиталь и одна p-орбиталь (они обведены овалом на орбитальной диаграмме) как бы смешиваются и выравниваются по форме и энергии, давая две одинаковые sp-гибридные орбитали (рис. 3-7).
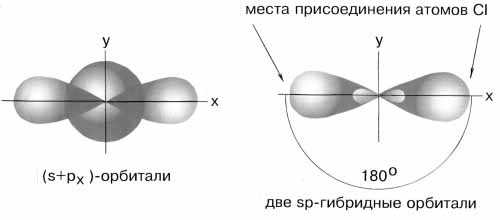
Рис. 3-7. sp-гибридизация валентных орбиталей бериллия в соединении BeCl2. Каждая гибридная орбиталь несимметрична (вытянута в сторону от ядра). Обе гибридные орбитали бериллия лежат на одной прямой.
Считается, что благодаря sp-гибридизации молекула BeCl2 имеет линейную форму и все три ее атома находятся на одной прямой, а обе связи Be—Cl совершенно одинаковы. Такова геометрия и у всех других sp-гибридизованных молекул - независимо от элементов, которые входят в эти молекулы.
Если валентная оболочка атома включает электроны на одной s-орбитали и двух p-орбиталях, то имеет место sp2-гибридизация орбиталей. Примером может служить sp2-гибридизация бора при образовании молекулы BF3. На орбитальной диаграмме обведены одна s- и две p-орбитали, которые “смешиваются”, то есть гибридизуются. Из ОВЭП мы уже знаем, что sp2-гибридные фрагменты молекул имеют форму плоского треугольника (рис. 3-8).
|
|
|
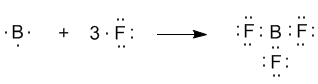
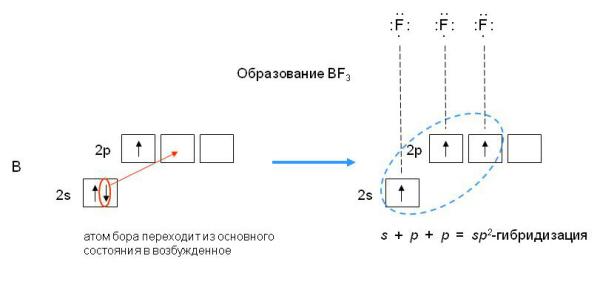
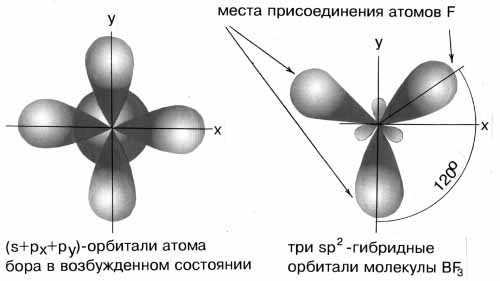
Рис.3-8. sp2-гибридизация валентных орбиталей бора в соединении BF3. Три sp2-гибридные орбитали бора лежат в одной плоскости под углом 120o.
Наконец, когда смешиваются одна s- и три p-орбитали, возникают sp3-гибридизованные молекулы, имеющие геометрию тетраэдра (рис. 3-9). Примером может служить молекула метана СН4.
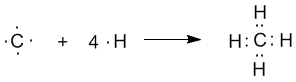
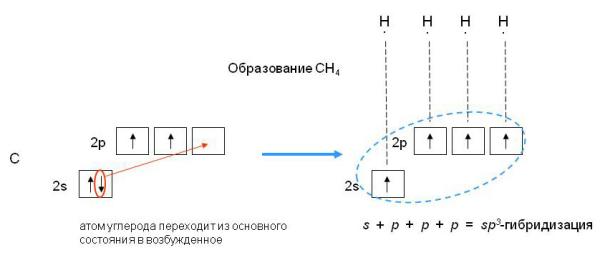

Рис. 3-9. sp3-гибридизация валентных орбиталей углерода. Четыре sp3-гибридные орбитали углерода направлены в вершины правильного тетраэдра. Атом углерода находится в центре тетраэдра. Углы между всеми связями равны и составляют 109°28'.
Существует важное правило:
При гибридизации ЧИСЛО ГИБРИДНЫХ ОРБИТАЛЕЙ всегда РАВНО ЧИСЛУ ИСХОДНЫХ АТОМНЫХ ОРБИТАЛЕЙ.
Если все гибридные орбитали связаны с одинаковыми атомами, то связи ничем не отличаются друг от друга. В других случаях встречаются небольшие отклонения от стандартных валентных углов. Например, в молекуле воды H2O кислород - sp3-гибридный, находится в центре неправильного тетраэдра, в вершины которого "смотрят" два атома водорода и две неподеленные пары электронов (рис. 3-10а). Форма молекулы угловая, если смотреть по центрам атомов. Валентный угол HОН составляет 105о, что довольно близко к теоретическому значению 109о.
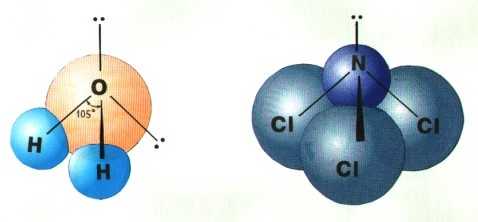
Рис. 3-10. sp3-гибридизация атомов кислорода и азота в молекулах а) H2O и б) NCl3.
Если бы не происходило гибридизации (“выравнивания” связей O-H), валентный угол HOH был бы равен 90°, потому что атомы водорода были бы присоединены к двум взаимно перпендикулярным р-орбиталям. В этом случае наш мир выглядел бы, вероятно, совершенно по-другому.
Список литературы
1. Габриелян О.С. Химия. Методическое пособие. 10-11 классы. М.: «Дрофа», 2005г.
2. Еремин В.В., Кузьменко Н.Е., Тренин В.И., химия. 10 класс: учебник для общеобразовательных учреждений(базовый уровень). – М.: Дрофа, 2009г.
3. Еремин В.В., Кузьменко Н.Е.,Дроздов А.А., химия. 11 класс: учебник для общеобразовательных учреждений базовый уровень). – М.: Дрофа, 2009г.
4. Рудзитис Г.Е., Фельдман Ф.Г, химия. 10 класс: учебник для общеобразовательных учреждений (базовый уровень). – М.: Просвещение, 2005
5. Рудзитис Г.Е., Фельдман Ф.Г, химия. 11 класс: учебник для общеобразовательных учреждений (базовый уровень). – М.: Просвещение, 2005
Дата добавления: 2020-11-23; просмотров: 69; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
