Преподаватель: Острик Марина Григорьевна
Тема: Строение молекул
Дата: 03.11.2020 (1 час)
Цель: сформировать представление о строении органических молекул.
Студенты должны знать: типы гибридизации атомных орбиталей в органических соединениях
Студенты должны уметь: тип гибридизации и геометрию молекул.
План.
1. Первое валентное состояние углерода.
2. Второе валентное состояние углерода.
3. Третье валентное состояние углерода.
4. Строение молекулы бензола.
Опорный конспект
Первое валентное состояние
Атомы в большинстве молекул прочно удерживаются вместе благодаря действию так называемых ковалентных связей, и имеющих очень важное значение; для этого типа связи характерно то, что пара электронов, осуществляющая связь, одновременно принадлежит связываемым атомам.
Такая связь имеет настолько большое значение, так широко представлена в различных веществах, что профессор Калифорнийского университета Джильберт Ньютон Льюис(1875-19460), открывший её электронную природу, назвал её чисто химической связью.
Самое простое органическое соединение метан (CH4). Его молекула состоит из пяти атомов – одного атома углерода и четырёх атомов водорода.
Так, как атом углерода имеет большую электроотрицательность (2,5), чем водород(2,1), в молекуле метана происходит незначительное смещение общих электронных пар в сторону атома углерода (по Поллингу)
|
|


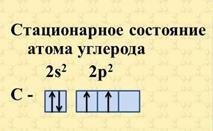
Строение атома углерода изображают следующей схемой
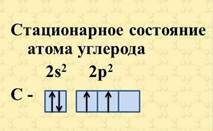
По Бору, каждой из круговых орбит соответствует конкретное энергетическое состояние электрона (энергетический уровень).
Так как на втором энергетическом уровне Р-подуровне имеется свободная орбиталь, то на неё может перейти один из 2s2-электронов. Если электрон, поглотив энергию, переходит на более удалённую от ядра орбиту, то это означает переход атома из основного (стационарного) состояния в возбужденное (нестационарное).
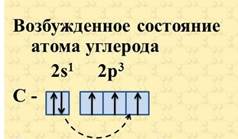
В результате все четыре наружных электрона второго энергетического уровня в атоме углерода окажутся неспаренными, и атом углерода в возбужденном состоянии становится четырёхвалентным.
Облака S-электронов имеют форму сферы, облака Р-электронов выглядят симметричными восьмёрками, причём эти восьмёрки могут быть расположены в пространстве вдоль осей Х, Y, Z. Однако такое положение энергетически не выгодно. Возникает противоречие, что неравноценные по исходному состоянию электроны образуют равноценные связи. Для объяснения этих фактов Лайнус Поллинг ввёл понятие гибридизация орбиталей, согласно которому происходит смешивание, усреднение имеющихся орбиталей. В молекуле метана в гибридизации участвуют один S-электрон и три Р-электрона, то такой её вид называется SP3-гибридизацией. Это первое валентное состояние атома углерода. При гибридизации взаимно изменяются первоначальная форма и энергия орбиталей, поэтому образовавшиеся гибридные орбитали отличаются от исходных. Связь, осуществляемая электронами гибридных орбиталей, намного прочнее, т.к. перекрывание происходит в значительно большей степени, чем при участии негибридных орбиталей.

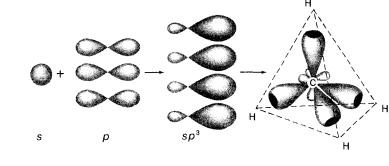
К каждой из четырёх орбиталей атома углерода направленных к вершинам тетраэдра, подходят атомы водорода ориентированные друг к другу под углом 109°28' SP3-гибридные облака углерода и S-электронные облака водорода перекрываются, а это означает образование химической сигма связи.
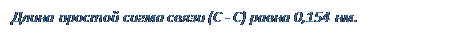
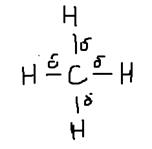
Итак, SP3-гибридные облака образуют простую, сигма связь. Метан – один из основных «кирпичиков», из которых можно строить органические соединения, сравнительно инертное вещество, имеет объёмное строение.
Второе валентное состояние
Этилен для органической химии – это уже не кирпичик, а целый блок.
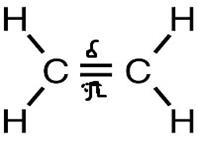
Молекула этилена состоит из двух атомов углерода и четырёх атомов водорода. Ведь во всех органических соединениях углерод должен быть четырёхвалентным, а в С2Н4 каждый углеродный атом связан с другим углеродом и двумя водородами, т.е. как бы трёхвалентен.
Никакого нарушения четырёх валентности не наблюдается: два атома углерода связаны между собой не простой, а двойной связью. Каждая валентность обозначается чертой, и если соединить два атома углерода двумя черточками, то мы сохраним четырёхвалентность углерода.
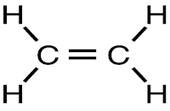
Атомы в большинстве молекул прочно удерживаются вместе благодаря действию так называемых ковалентных связей, и имеющих очень важное значение; для этого типа связи характерно то, что пара электронов, осуществляющая связь, одновременно принадлежит связываемым атомам.
Такая связь имеет настолько большое значение, так широко представлена в различных веществах, что профессор Калифорнийского университета Джильберт Ньютон Льюис (1875-1946), открывший её электронную природу, назвал её чисто химической связью.

Строение атома углерода изображают следующей схемой
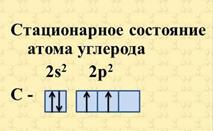
По Бору, каждой из круговых орбит соответствует конкретное энергетическое состояние электрона (энергетический уровень).
Так как на втором энергетическом уровне Р-подуровне имеется свободная орбиталь, то на неё может перейти один из 2s2-электронов. Если электрон, поглотив энергию, переходит на более удалённую от ядра орбиту, то это означает переход атома из основного (стационарного) состояния в возбужденное (нестационарное).
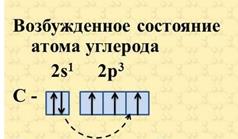
В результате все четыре наружных электрона второго энергетического уровня в атоме углерода окажутся неспаренными, и атом углерода в возбужденном состоянии становится четырёхвалентным.
Облака S-электронов имеют форму сферы, облака Р-электронов выглядят симметричными восьмёрками, причём эти восьмёрки могут быть расположены в пространстве вдоль осей Х, Y, Z. Однако такое положение энергетически не выгодно. Возникает противоречие, что неравноценные по исходному состоянию электроны образуют равноценные связи. Для объяснения этих фактов Лайнус Поллинг ввёл понятие гибридизация орбиталей, согласно которому происходит смешивание, усреднение имеющихся орбиталей.
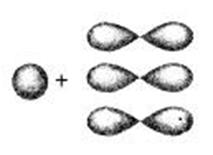
В молекуле этилена подвергаются гибридизации одно -s и два из трёх
Р-электронных облака атомов углерода, то такой её вид называется SP2-гибридизацией. Это второе валентное состояние углерода.
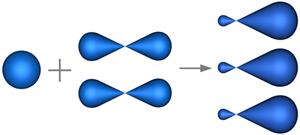
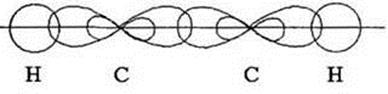
Два из шести гибридных электронных облаков атомов углерода взаимно перекрываются и образуют между атомами углерода сигма связь. Остальные четыре гибридных электронных облака атомов углерода перекрываются в той же плоскости с четырьмя S-электронными облаками атомов водорода и также образуют четыре сигма связи.
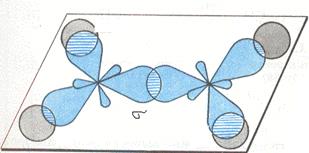
Вспомним, у нас остался ещё Р-электрон. Он образует облако в виде симметричной восьмёрки, которая направлена перпендикулярно плоскости трёх SP2-орбиталей. Эти-то электронные облака (по одной восьмёрке от каждого углерода) тоже могут перекрываться между собой, только не «лоб в лоб», как перекрываются две SP2-орбитали, а «боками». Такое перекрывание и обозначает вторая черточка. Связь первого типа (лбами) обозначает сигма связь, при которой электронные облака перекрываются «боками» называются Пи связью. Всё вместе это и есть двойная связь. Двойная связь короче простой, её длина 0,134 нм.

Итак, разобрано устройство ещё одной детали. Из которых можно строить «здания» органических соединений.
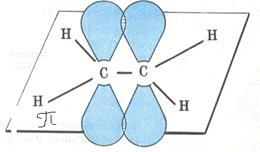
Третье валентное состояние
Молекула ацетилена состоит из двух атомов углерода и двух атомов водорода.
Связь между двумя углеродами обозначается тремя черточками
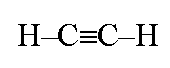

Строение атома углерода изображают следующей схемой
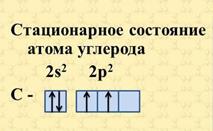
По Бору, каждой из круговых орбит соответствует конкретное энергетическое состояние электрона (энергетический уровень).
Так как на втором энергетическом уровне Р-подуровне имеется свободная орбиталь, то на неё может перейти один из 2s2-электронов. Если электрон, поглотив энергию, переходит на более удалённую от ядра орбиту, то это означает переход атома из основного (стационарного) состояния в возбужденное (нестационарное).
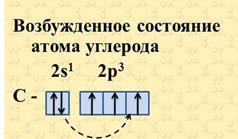
В результате все четыре наружных электрона второго энергетического уровня в атоме углерода окажутся неспаренными, и атом углерода в возбужденном состоянии становится четырёхвалентным.
Облака S-электронов имеют форму сферы, облака Р-электронов выглядят симметричными восьмёрками, причём эти восьмёрки могут быть расположены в пространстве вдоль осей Х, Y, Z. Однако такое положение энергетически не выгодно. Возникает противоречие, что неравноценные по исходному состоянию электроны образуют равноценные связи. Для объяснения этих фактов Лайнус Поллинг ввёл понятие гибридизация орбиталей, согласно которому происходит смешивание, усреднение имеющихся орбиталей.
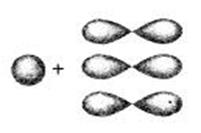
При образовании молекулы ацетилена у каждого атома углерода гибридизуется по одному S и одному Р- электронному облаку, то такой её вид называется SP-гибридизация. Это третье валентное состояние углерода.

Образовавшиеся две гибридные SP-орбитали связывают два атома углерода между собой (одна из черточек сигма связь) и атом углерода с атомами водорода (лоб в лоб).
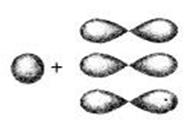
При этом у каждого углеродного атома остается два Р-электронных облака, в виде симметричных восьмёрок, направленных перпендикулярно SP-орбиталям и друг к другу. Перекрываясь «боками», эти восьмёрки дают две Пи связи (две другие черточки).

Длина связи НС=СН в молекуле ацетилена меньше длины простой и двойной связей, она равна 0,12 нм.
Молекула ацетилена имеет линейное строение, как и этилен является тоже «блоком» из которых можно строить «здания» органических соединений.
Ещё одна «стройдеталь» - бензол
Молекулы метана – подобны отдельным кирпичикам, молекулы этилена и ацетилена – блоками. Имея в запасе этот набор, можно сконструировать довольно сложные сооружения. Однако возможности значительно расширяются, когда познакомиться с четвёртой «строительной деталью» – бензолом.
Продолжаю архитектурную аналогию, можно сказать, что бензол – это целая панель, пригодная для типового строительства. Бензол – это тоже углеводород (его молекула построена из шести атомов углерода столько же атомов водорода), но углеводород, принципиально отличающийся от тех, о которых шла речь. С6Н6. Как же построена молекула бензола? Август Кекуле рассказывал об этом сне: «Я сидел и писал учебник, но работа не двигалась, мои мысли витали где-то далеко. Я задремал. Атомы запрыгали перед моими глазами. Мой умственный взгляд мог теперь различить длинные ряды, извивающиеся, подобно змеям. Одна из змей схватила свой собственный хвост и в таком виде завертелась перед моими глазами. Как будто вспышка молнии разбудила меня. Я провел остаток ночи, разрабатывая теорию. Фридрих Август Кекуле в 1865 году пришёл к выводу, что бензол – это шестиугольник с чередующимися двойными и простыми связями.

Поллинг представляет бензол в виде двух формул Кекуле (А и В). Кекуле предположил, что двойные связи всё время перемещаются (гибрид, усредненное).
Согласно древней мифологии.
Кентавр – гибрид человека и лошади; сфинкс – гибрид человека и льва.
1)  Кентавр: человек лошадь
Кентавр: человек лошадь
2)  Сфинкс: человек лев
Сфинкс: человек лев
3) Мул – это гибрид лошади с ослом.
Итак, 1); 2) родители реально существуют, гибрид – плод воображения (кентавр, сфинкс). 3) И гибрид, и его родители существуют, а родители – плод воображения, абстракции (бензол и формулы Кекуле).
Современные представления строения бензола
Строение атома углерода изображают так
Так как на втором энергетическом уровне Р-подуровне имеется свободная орбиталь, то на неё может перейти один из 2s2-электронов:

В результате все четыре наружных электрона второго энергетического уровня в атоме углерода окажутся неспаренными , и атом углерода в возбуждённом состоянии – четырёхвалентен.
Так как в молекуле бензола в гибридизации участвуют один S-электрон и два P-электрона, то такой её вид называется sp2-гибридизацией. А одно р-электронное облако негибридное.

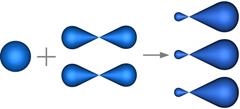
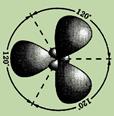
Все три гибридных электронных облака, перекрываясь, образуют сигма связи, которые лежат в одной плоскости под углами 120 ° друг к другу.


Два из них перекрываются друг с другом, а третье с s-электронным облаком атома водорода. В результате образуются три сигма связи

Негибридные р-электронные облака атомов углерода перекрываются попарно «боками», расположены перпендикулярно плоскости направления сигма связей.
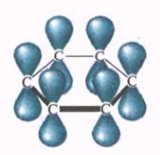 Схема образования П-связей в молекуле бензола.
Схема образования П-связей в молекуле бензола.
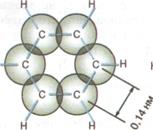
Если формула Кекуле верна, то расстояние в молекуле бензола между двумя соседними углеродами должны быть разными: 0,154нм между атомами, у которых р-облака не перекрываются, и 0,133нм между углеродами, связанными П-связью. Но исследования бензола физическими методами показало, что все расстояния в молекуле строго одинаковы и длина связи
С-С равна 0,140 нм, то есть среднее значение между длинами простой и двойной связи.
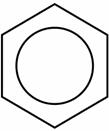
Так как электронная плотность в молекуле бензола распределена равномерно, то правильнее структурную формулу бензола изображать в виде шестиугольника с окружностью внутри.
Вопросы для самоконтроля:
1. Что такое гибридизация?
2. Какую форму могут иметь молекулы, образованные атомами с sp, sp2 и sp3 гибридизацией орбиталей?
3. Какие формы орбиталей известны?
4. Сколько видов гибридизации возможно для s- и p- орбиталей? Приведите примеры.
5.Какой вид химической связи является определяющим для геометрии молекул (сигма или пи)?
Практическое задание.
Выполните тестовое задание.
1. Выберите формулы соединений, имеющих сходную направленность, обусловленную sp2-гибридизацией электронных орбиталей:
1. C2H4, CH4, C3H6;
2. C2H4, BCl3, C6H6;
3. BH3, CH4, BeCl2;
4. NH3, SiH4, H2O.
2. Электронные орбитали под углом 109°28’ располагаются в молекуле
1. С (карбин);
2. C2H2;
3. С (алмаз);
4. C2H4.
3. Длина одинарной С-С связи в молекуле бензола равна
1. 0,134 нм;
2. 0,154 нм;
3. 0,120 нм;
4. 0,140 нм.
4. Выберите формулы соединений, имеющих сходную направленность, обусловленную sp3-гибридизацией электронных орбиталей:
1. C2H4, CH4, C3H6;
2. C2H4, BCl3, C6H6;
3. BH3, CH4, BeCl2;
4. NH3, SiH4, H2O.
5. Установите соответствие между формулами веществ и типами гибридизации их центрального атома.
| 1. CCl4 | а) sp2 |
| 2. NH3 | б) sp |
| 3. BH3 | в) sp3 |
Уважаемые студенты! Практическое задание необходимо выполнить в рабочей тетради (сфотографировать) или в формате Документа Word. Отправлять для проверки в личные сообщения на страницу ВКонтакте: https://vk.com/id343837166
Преподаватель: Острик Марина Григорьевна
Дата добавления: 2020-11-23; просмотров: 78; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
