В растворе молекул больше, чем ионов
Конспект «Оновные положения теории электролитической диссоциации».
Электролитическая диссоциация (ЭД) – процесс распада электролита на ионы при растворении в воде или плавлении.
| I . Классификация веществ с позиции ТЭД. С позиции представлений об ЭД вещества можно разделить на две группы: электролиты и неэлектролиты. II . ЭД. Ионы. 1. Кислоты, соли, основания, растворимые в воде, подвергаются в водном растворе ЭД, т.е. распадаются на ионы. НСl → Н+ + Сl- NaOH → Na+ + OH- KNO3 → K+ + NO3- 2. Ионы хаотически движутся в растворе электролита. Под действием электрического тока положительно заряженные ионы (катионы) движутся к катоду – отрицательно заряженному электроду. Отрицательно заряженные ионы (анионы) движутся к аноду – положительно заряженному электроду. 3. Свойства ионов и атомов различны, поскольку различны их состав и строение. III . 1. Количественная характеристика диссоциации – степень ЭД α (альфа), которая показывает, какая часть растворенных частиц находится в растворе в виде ионов. Электролиты можно классифицировать на сильные (полностью переходят в раствор в виде ионов) и слабые (в водном растворе содержится значительное число ионов). 2. В растворах слабых электролитов (α < 3%) молекул значительно больше, чем ионов. При разбавлении таких растворов число ионов увеличивается. Сильные электролиты в водных растворах практически полностью диссоциированы, поэтому ионов в их растворах больше, чем в растворах слабых электролитов той же концентрации (α ~ 100%). IV . Между растворами электролитов возможны реакции ионного обмена, которые протекают до конца, если изменяется ионный состав раствора, т.е. если образуется осадок или слабый электролит. Уравнения реакций ионного обмена записывают в молекулярном и ионном виде. Пример: Составьте ионное уравнение взаимодействия хлорида алюминия с гидроксидом калия. V . 1. Гидратация ионов на поверхности кристалла (соли, щелочи) → разрыв химической связи в кристалле → переход гидратированных ионов в раствор; 2. Гидратация полярных молекул соединений (кислот) → переход ковалентной полярной связи в ионную → разрыв химической связи → переход гидратированных ионов в раствор. |   I . Вещества
Растворы проводят Растворы не проводят I . Вещества
Растворы проводят Растворы не проводят
  электрический ток электрический ток электрический ток электрический ток
  Электролиты Неэлектролиты Электролиты Неэлектролиты
 Имеют ИС и КПС Имеют КНС или
малополярные связи Имеют ИС и КПС Имеют КНС или
малополярные связи
Щелочи, растворимые Многие органические
Нерастворимые кис- Лоты, соли, основа-
В растворе – ионы В растворе ионов практически нет
II. 1
← Na+ OH- → ← K+ NO-3 →
Катионы Анионы
2 Слабый электролит.
В растворе молекул больше, чем ионов 2 CH3COOH + Zn = H2↑ Слабое выделение H 2 ↑ Сильный электролит HCl → H+ + Cl-
 Мы поможем в написании ваших работ! |

 кислоты и соли вещества,
кислоты и соли вещества, ния, простые в-ва
ния, простые в-ва
 3. Катод (-) ← H+ Cl- → Анод(+)
3. Катод (-) ← H+ Cl- → Анод(+)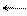
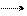 CH3COOH H+ + CH3COO-;
CH3COOH H+ + CH3COO-;