В изолированной системе самопроизвольно могут протекать только такие процессы, которые сопровождаются увеличением энтропии (возрастанием неупорядоченности).
Энтропия вещества резко возрастает при переходе из твердого состояния в жидкое и далее – в газообразное. Поэтому об изменении энтропии в химической реакции можно судить по количеству газообразного вещества до и после реакции.
Энтропия, так же как внутренняя энергия и энтальпия, является свойством вещества, пропорциональным его количеству. Энтропия является функцией состояния системы, т.е. ее изменение зависит только от конечного и начального состояния системы и не зависит от пути протекания процесса. Изменение энтропии при протекании химической реакции можно точно рассчитать по следствию из закона Гесса, используя стандартные энтропии веществ, приведенные в справочниках:
ΔSх.р. = ∑S°прод. – ∑S°исх. (7)
При этом, в отличие от энтальпии образования, энтропия простого вещества не равна нулю.
Критерием направленности процессов в неизолированной системе является изменение энергии Гиббса (ΔG, кДж/моль), которая учитывает как энтальпийный (тепловой), так и энтропийный (вероятностный) фактор.
Энергия Гиббса (изобарно-изотермический потенциал) связана с энтальпией и энтропией соотношением:
ΔG = ΔH – TΔS, (8)
где T – абсолютная температура.
Энергия Гиббса является функцией состояния системы, поэтому:
ΔGх.р. = ∑Gпрод. – ∑Gисх. (9)
|
|
|
Самопроизвольно возможно протекание только таких процессов, в которых энергия Гиббса уменьшается (ΔG < 0).
Протекание экзотермических химических реакций (ΔH < 0), сопровождающихся возрастанием энтропии (ΔS > 0), возможно, так как в этом случае ΔG < 0.
Эндотермические реакции (ΔH > 0), сопровождающиеся уменьшением энтропии (ΔS < 0), самопроизвольно в прямом направлении протекать не могут, так как в этом случае ΔG > 0. Реакция может протекать только в обратном направлении.
Если же ΔH < 0 и ΔS < 0, а также если ΔH > 0 и ΔS > 0, термодинамическая возможность протекания реакции определяется конкуренцией энтальпийного и энтропийного факторов, в которую вмешивается температура.
Например, если ΔH < 0 и ΔS < 0, то при низкой температуре преобладает энтальпийный фактор (ΔH), ΔG < 0 и реакция протекает в прямом направлении. Повышение температуры усиливает влияние энтропийного фактора. ΔG становится больше нуля. Поэтому при высокой температуре та же реакция может протекать только в обратном направлении.
То есть при повышении температуры происходит изменение знака G и направления протекания реакции. Значит, при какой-то температуре ΔG = 0 и система находится в равновесии.
В этом случае температуру равновесия можно рассчитать:
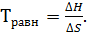 (10)
(10)
Дата добавления: 2020-11-15; просмотров: 681; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
