Константа и степень гидролиза
Лекция 4. Гидролиз солей
Виды гидролиза солей
Гидролизом соли называется взаимодействие ионов соли с водой, приводящее к образованию слабого электролита.
Таким образом, обменное взаимодействие соли с водой (гидролиз) происходит лишь в тех случаях, когда ионы, которые образованы в результате электролитической диссоциации соли, способны связывать ионы воды Н+ и ОН- в слабую кислоту или слабое основание.
Гидролизу могут подвергаться только те соли, в состав которых входит катион слабого основания или анион слабой кислоты.
Существует четыре типа поведения солей в воде.
1 тип. Гидролиз соли, образованной слабым основанием и сильной кислотой – гидролиз катиона.
Уравнение образования соли
NH4OH + HCl ↔ NH4Cl + H2O
слабое сильная
основание кислота
Гидролизу подвергается катион соли
NH4Cl + HOH ↔ NH4OH + HCl
Ионно-молекулярное уравнение
NH4+ + Cl- + HOH ↔ NH4OH- + H+ + Cl -
NH4+ + HOH ↔ NH4OH + H+
В растворе увеличивается концентрация ионов водорода.
Следовательно, при гидролизе катиона слабого основания образуется кислая среда с рН < 7.
Гидролиз солей, образованных слабым основанием многовалентных металлов, протекает ступенчато:
1 ступень FeCl3 + HOH ↔ FeOHCl2 + HCl
Fe3+ + 3Сl- + HOH ↔ FeOH2+ + 2Сl- + H+ + Сl-
Fe3+ + HOH ↔ FeOH2+ + H+
2 ступень FeOHCl2 + HOH ↔ Fe(OH)2Cl + HCl
FeOH2+ + 2Сl- + HOH ↔ Fe(OH)2+ + Сl- + H+ + Сl-
FeOH2+ + HOH ↔ Fe(OH)2+ + H+
3 ступень Fe(OH)2Cl + HOH ↔ Fe(OH)3 + HCl,
Fe(OH)2+ + Сl- + HOH ↔ Fe(OH)3 + H+ + Сl-
Fe(OH)2+ + HOH ↔ Fe(OH)3 + H+
Необходимо иметь в виду, что если не создавать специальных условий, то гидролиз такого типа практически идет только по первой ступени. Гидролиз по второй и третьей ступеням возможен при сильном разбавлении или нагревании раствора.
2 тип. Гидролиз соли, образованной слабой кислотой и сильным основанием – гидролиз аниона.
Уравнение образования соли
СН3СООН + NaOH ↔ CH3COONa + H2O
слабая сильное
кислота основание
Уравнение гидролиза соли
CH3COONa + HOH ↔ CH3COOH + NaOH
Ионно-молекулярное уравнение
CH3COO- + Na+ + HOH ↔ CH3COOH + Na+ + OH-
CH3COO- + HOH ↔ CH3COOH + OH-
В растворе увеличивается концентрация гидроксид-ионов.
При гидролизе аниона слабой кислоты образуется щелочная среда с рН > 7.
Гидролиз солей, образованных слабыми многоосновными кислотами, протекает ступенчато.
1 ступень Na2CO3 + HOH ↔ NaHCO3 + NaOH
2Na+ + CO32- + HOH ↔ Na+ + HCO3- + Na+ + OH-
CO32- + HOH ↔ HCO3- + OH-
2 ступень NaHCO3 + НОН ↔ H2CO3 + NaOH
Na+ + HCO3- + НОН ↔ H2CO3 + Na+ + OH-
HCO3- + НОН ↔ H2CO3 + OH-
Гидролиз преимущественно идет по первой ступени.
3 тип. Гидролиз соли, образованной слабой кислотой и слабым основанием.
Уравнение образования соли
СН3СООН + NH4OH ↔ CH3COONН4 + H2O
слабая слабое
кислота основание
Уравнение гидролиза соли
CH3COONН4 + НОН ↔ CH3COOH + NН4OH
Ионно-молекулярное уравнение одновременного гидролиза катиона и аниона
NН4+ + CH3COO- + НОН ↔ CH3COOH + NН4OH
Одновременный гидролиз аниона слабой кислоты и катиона слабого основания приводит к образованию двух слабых электролитов равной силы. Если их константы диссоциации достаточно близки, раствор сохраняет нейтральную реакцию с рН ≈ 7 (КNН4OH = 1,77·10-5, КСН3СООН = 1,74·10-5).
4 тип. Гидролиз соли, образованной сильным основанием и сильной кислотой.
Уравнение образования соли
NaOH + HCl ↔ NaCl + H2O
сильное сильная
основание кислота
Катион сильного основания и анион сильной кислоты не гидролизуются, поскольку в этом случае не могут образоваться малодиссоциированные соединения. При растворении такой соли в воде рН = 7 и практически не меняется.
NaCl + НОН ↔ NaOH + HCl
Na+ + Cl- + HOH ↔ Na+ + OH- + H+ + Cl-
HOH ↔ H+ + OH-
Смещение равновесия гидролиза
В определенных условиях равновесие процесса гидролиза может резко сдвинуться вправо, в сторону усиления гидролиза.
Это может происходить за счет увеличения температуры, уменьшения концентрации раствора, в результате связывания Н+ или ОН-, образующихся при гидролизе.
1. При смешивании растворов MgCl2 (соль слабого основания) и Na2CO3 (соль слабой кислоты) происходит взаимное усиление гидролиза обеих солей.
1 ступень Mg2+ + HOH ↔ Mg(OH)+ + H+
CO32- + HOH ↔ HCO3- + OH-
Ионы Н+ и ОН- взаимно нейтрализуют друг друга, соединяясь в малодиссоциированное соединение H2O. В результате оба процесса смещаются вправо и гидролиз идет до конца.
2 ступень Mg(OH)+ + HOH ↔ Mg(OH)2 + H+
HCO3- + HOH ↔ H2CO3 + OH-
Суммарное уравнение гидролиза
Mg2+ + CO32- + HOH ↔ Mg(OH)2↓+ СО2↑
2. В зависимости от растворимости продукта гидролиза, до конца может гидролизоваться только одна соль. Если смешать растворы CuSO4 и Na2CO3, то уравнение реакции будет иметь следующий вид
2CuSO4 + 2Na2CO3 + HOH ↔ (CuOH)2CO3↓+ СО2 + 2Na2SO4
2Cu2+ + 2CO32- + HOH ↔ (CuOH)2CO3↓+ СО2
В этом случае гидролиз Na2CO3 проходит до конца. А что касается второй соли, то образуется не Cu(OH)2, а (CuOH)2CO3, поскольку растворимость (CuOH)2CO3 меньше растворимости Cu(OH)2.
3. Конечное уравнение гидролиза (который идет до конца) соли (NH4)2CO3 имеет необычный вид
(NH4)2CO3 + HOH ↔ 2NH3↑ + CO2↑ + HOH
2NH4+ + CO32- + HOH ↔ 2NH3↑ + CO2↑ + HOH
Это объясняется тем, что при гидролизе аниона и катиона образуются ионы ОН- и Н+, которые взаимодействуют друг с другом:
Н+ + ОН- ↔ НОН
Константа и степень гидролиза
Количественной характеристикой гидролиза соли является константа гидролиза Кгидр. Как и константа диссоциации, она выводится из закона действия масс.
1) Гидролизу соли, образованной слабой кислотой и сильным основанием (NaNO2), соответствует обратимый процесс:
NO2- + HOH ↔ HNO2 + OH-
Константа равновесия имеет вид:
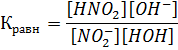
| (1) |
При умножении Кравн на [Н2О], которую можно считать постоянной величиной, получается
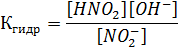
| (2) |
Ионное произведение воды 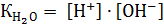 . Следовательно,
. Следовательно, 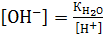 . Выражение
. Выражение 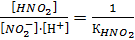 . Подставим эти выражения в формулу (2):
. Подставим эти выражения в формулу (2):
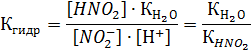
| (3) |
В общем виде
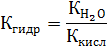
| (4) |
Из этого выражения следует, что чем слабее кислота (чем меньше Ккисл), тем сильнее гидролиз соли, которую она образует.
2) Для соли слабого основания и сильной кислоты (NH4NO3)
NH4+ + HOH ↔ NH4OH + H+
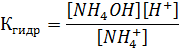
| (5) |
Поскольку 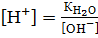 и
и 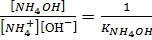 выражение (5) примет вид:
выражение (5) примет вид:
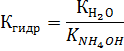
| (6) |
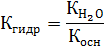
| (7) |
Следовательно, чем слабее основание (чем меньше Косн), тем сильнее гидролиз образованной им соли.
3) Константа гидролиза соли, образованной слабым основанием и слабой кислотой (CH3COONН4), имеет вид
NН4+ + CH3COO- + НОН ↔ CH3COOH + NН4OH
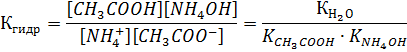
| (8) |
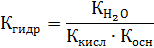
| (9) |
Характер среды в результате гидролиза подобных солей можно определить, сравнивая константы диссоциации кислоты и основания.
Константа гидролиза позволяет рассчитывать концентрацию образующихся ионов, рН раствора, а также степень гидролиза β.
Степень гидролиза соли β – это отношение числа молекул, подвергшихся гидролизу, к общему числу молекул соли в растворе.
Имеется зависимость между степенью и константой гидролиза:
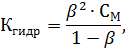
| (10) |
где: СМ – молярная концентрация раствора соли (моль/л).
Как правило, β << 1, поэтому в расчете можно допустить 1 – β ≈ 1. Тогда связь между β и Кгидр выражается соотношением
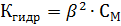 или или 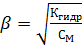
| (11) |
Отсюда следует, что при разбавлении раствора гидролиз усиливается.
Дата добавления: 2020-11-15; просмотров: 917; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
