Периодическая система химических элементов»
ХИМИЯ
28.10.2020
Тема 4-5. Закон сохранения массы веществ. Закон постоянства состава веществ. Периодическая система химических элементов.
В 1748 г. М. В. Ломоносов (Россия) и в 1789 г. А. Лавуазье (Франция) независимо друг от друга открыли закон сохранения массы веществ в химических реакциях. Этот закон формулируется так:
Масса всех веществ, которые вступают в химическую реакцию, равна массе всех продуктов реакции.
Запишем схему реакции горения метана СН4 в кислороде О2. В результате этой реакции образуются углекислый газ СО2 и вода Н2О:
СН4 + О2 = СО2 + Н2О
По закону сохранения массы:
m(СН4) + m(О2) = m(СО2) + m(Н2О),
где m(СН4) и m(О2) — массы метана и кислорода, которые вступили в реакцию; m(СО2) и m(Н2О) — массы углекислого газа и воды, образовавшиеся в результате реакции.
Сохранение массы веществ в химических реакциях объясняется тем, что число атомов каждого элемента до и после реакции не изменяется. В ходе химической реакции происходит только перегруппировка атомов. В реакции, например, в молекулах исходных веществ — СН4 и О2 — атом углерода соединяется с атомами водорода, а атомы кислорода— друг с другом; в молекулах продуктов реакции — СО2 и Н2О — и атом углерода, и атомы водорода соединяются с атомами кислорода. Легко посчитать, что для сохранения числа атомов каждого элемента в данную реакцию должны вступать 1 молекула СН4 и 2 молекулы О2, а в результате реакции должны образоваться 1 молекула СО2 и 2 молекулы Н2О:
|
|
|
СН4 + 2О2 = СО2 + 2Н2О
Данное выражение является уравнением химической реакции, или химическим уравнением.
Числа перед формулами веществ в уравнении реакции называются коэффициентами. В уравнении коэффициенты перед формулами О2 и Н2О равны 2; коэффициенты перед формулами СН4 и СО2 равны 1 (их обычно не записывают).
Химическое уравнение — это выражение химической реакции, в котором записаны формулы исходных веществ (реагентов) и продуктов реакции, а также коэффициенты, показывающие число молекул каждого вещества.
Если известна схема реакции, то для составления химического уравнения нужно найти коэффициенты.
Составим, например, уравнение реакции, которая выражается следующей схемой:
Al + НСl = AlCl3 + H2
В левой части схемы атомы водорода и хлора входят в состав молекулы HCl в соотношении 1 : 1; в правой части схемы содержатся 3 атома хлора в составе молекулы AlC13 и 2 атома водорода в составе молекулы Н2. Наименьшее общее кратное чисел 3 и 2 равно 6.
|
|
|
Напишем коэффициент «6» перед формулой HCl, коэффициент «2» — перед формулой AlC13 и коэффициент «3» — перед формулой Н;
Аl+ 6HCl = 2AlCl3 + 3Н2
Так как теперь в правой части содержится 2 атома алюминия, напишем коэффициент «2» перед формулой Al в левой части схемы:
2Al + 6НС1 = 2AlC13 + 3H2
В результате мы получили уравнение данной реакции. Коэффициенты в химическом уравнении показывают не только число молекул, но и число молей исходных веществ и продуктов реакции. Например, это уравнение показывает, что в реакцию вступают 2 моля алюминия Аl и 6 молей хлороводорода HCl, а в результате реакции образуются 2 моля хлорида алюминия AlC13 и 3 моля водорода Н2).
Закон постоянства состава веществ
В молекуле воды на 2 атома водорода приходится 1 атом кислорода. Учитывая это и значения относительных атомных масс, можно легко вычислить соотношение масс водорода и кислорода в молекуле воды:
2Аr(Н) : Аr(O) = (2 • 1) : (1 • 16) = 1 : 8
То есть для получения воды нужно смешать водород и кислород в массовом соотношении 1 : 8. Если же их смешать в другом соотношении масс, например, 3 г водорода смешать с 8 г кислорода, то химическая реакция произойдёт, но 2 г водорода в реакцию не вступят. Нетрудно понять, что таким же должно быть соотношение масс водорода и кислорода в любом количестве воды, т. е. состав воды всегда постоянен. Постоянным составом обладает большое число химических соединений.
|
|
|

Закон постоянства состава веществ был открыт французским учёным Ж. Прустом в 1799—1806 гг. Закон был сформулирован так: Каждое химически чистое вещество независимо от места нахождения и способа получения имеет один и тот же постоянный состав.
- Тем не менее Закон постоянства состава веществ не является всеобщим. Он справедлив только для веществ, имеющих молекулярное строение. Состав веществ немолекулярного строения часто зависит от способа их получения.
На основе закона постоянства состава можно производить различные расчёты.
Задача. Определите массу серы, реагирующей без остатка с 5 г медных опилок, если медь и сера в данном случае соединяются в соотношении масс 2 : 1.
Решение.
- 2 г меди соединяются с 1 г серы
- 5 г меди соединяются с х г серы
2 г : 5 г = 1 г : х г
х = (5 • 1) : 2 = 2,5 г серы
5
Периодическая система химических элементов»
|
|
|
Ключевые слова конспекта: Периодическая система химических элементов Д.И. Менделеева, группы и периоды Периодической системы, физический смысл порядкового номера химического элемента.
Периодическая система химических элементов — это таблица, в которой все химические элементы расположены в порядке возрастания атомных номеров. Таблица включает в себя периоды и группы, т.е. горизонтальные строчки и вертикальные столбцы.
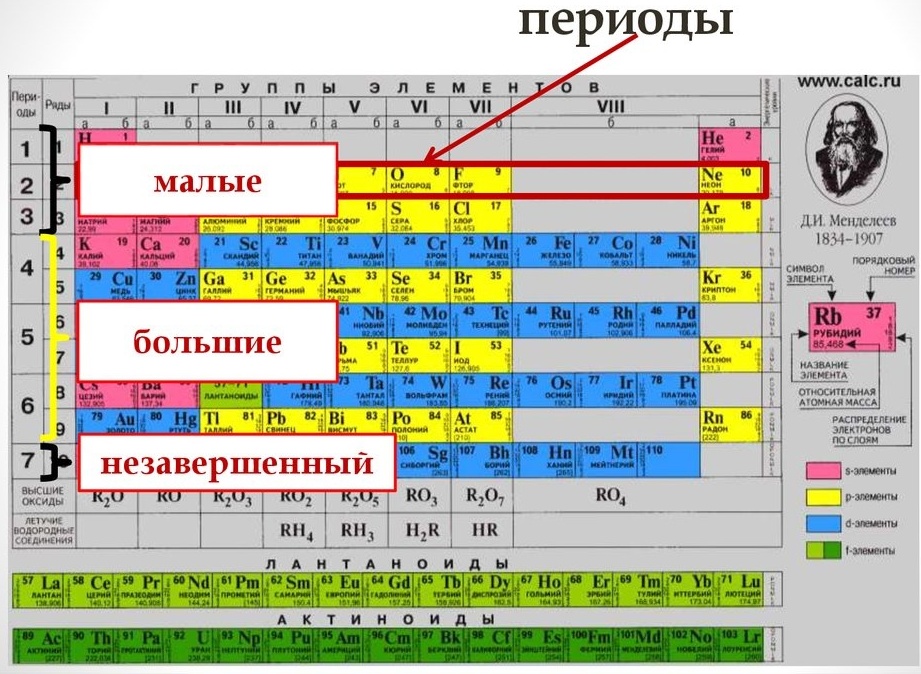
Период — это последовательность (горизонтальный ряд в таблице) элементов с возрастающими атомными номерами, начинающаяся щелочным металлом (или водородом) и заканчивающаяся благородным газом.
Число электронных слоев в атомах данного периода равно номеру периода.
В периодах с возрастанием атомного номера Z металлические свойства ослабевают, а неметаллические усиливаются.
Группа — это вертикальная колонка элементов в таблице, включающая элементы с одинаковой максимальной степенью окисления, равной номеру группы, и одинаковой отрицательной степенью окисления, для атомов неметаллов равной номеру группы минус 8.
В группах с возрастанием атомного номера Z металлические свойства усиливаются, а неметаллические ослабевают. Число валентных электронов атома обычно равно номеру группы.
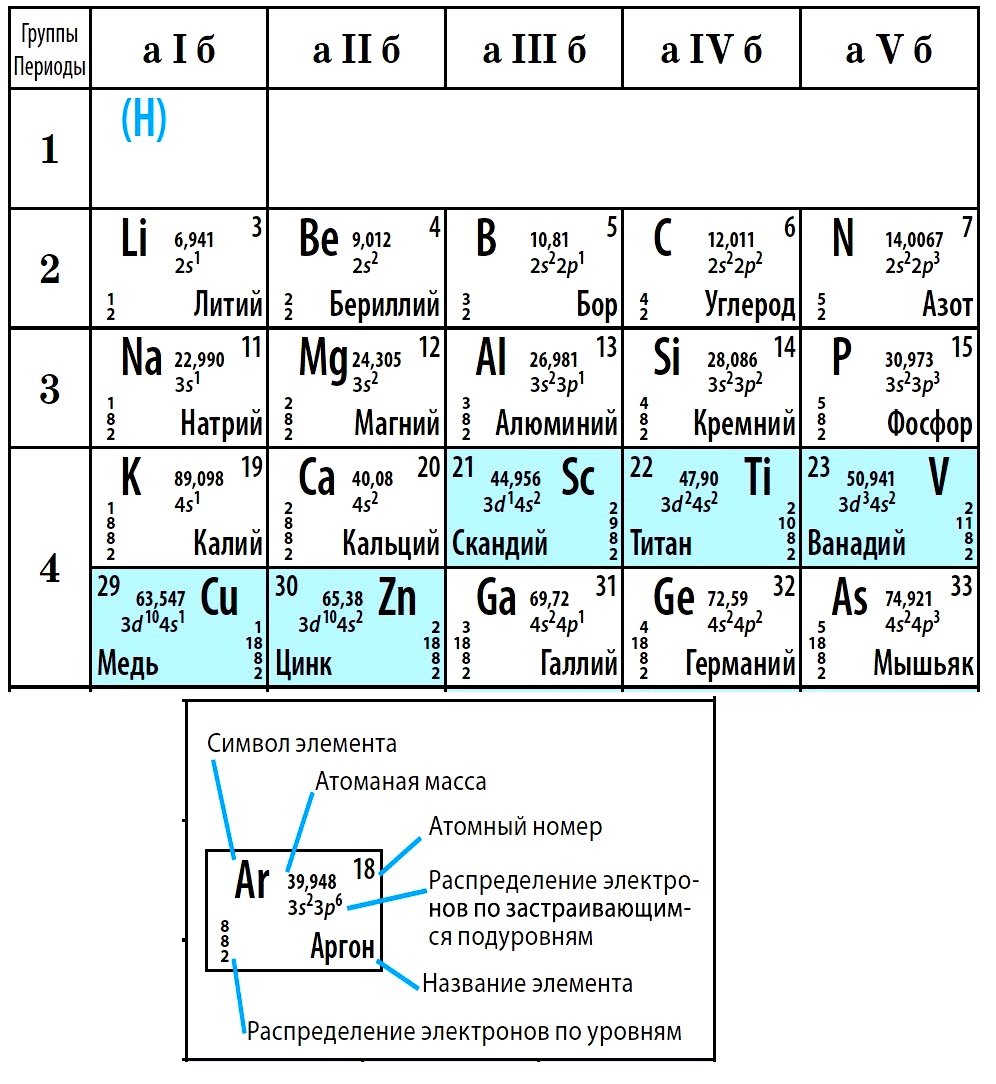
В коротком варианте таблицы Менделеева различают малые периоды — 1-й, 2-й и 3-й, содержащие 2, 8 и 8 элементов соответственно, а также большие периоды — 4-й, 5-й, 6-й и незавершенный 7-й. Каждый большой период таблицы включает две строчки (два ряда). Например, в 4-м периоде, начинающемся калием 19K, последний элемент в верхней строчке — никель 28Ni, он в числе элементов триады (Fe, Со, Ni) попадает в VIII группу. Следующий элемент — медь 29Cu записан строчкой ниже и находится в I-й группе.
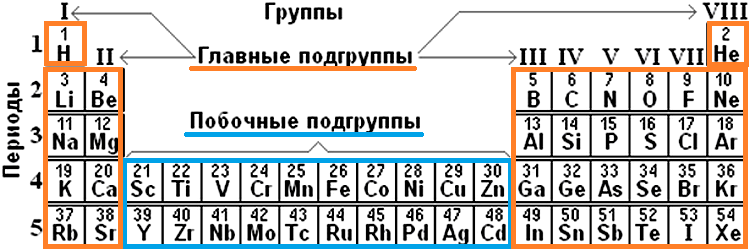
Каждая группа с номерами от I до VIII включает две группы — А и Б.
АA-группы включают элементы малых периодов, а также элементы больших периодов, которые по свойствам наиболее близки к соответствующим элементам малых периодов.
Б-группы включают элементы больших периодов, в атомах которых электроны, появляющиеся в них с увеличением заряда ядра, попадают в слой, предшествующий внешнему.
Физический смысл порядкового номера химического элемента:
1. это число нейтронов в атоме;
2. это относительная атомная масса;
3. это число энергетических уровней в атоме;
4. это число протонов в ядре.

Дата добавления: 2020-11-15; просмотров: 171; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
