Канамицина сульфат – kanamycini monosulfas
Задание:
Составьте конспект лекции по теме « Антибиотики ароматического ряда: левомицетин. Антибиотики аминогликозиды: гентамицина сульфат, канамицина сульфат »
Выполненные задания присылать в личном сообщении ВК в виде фото или скринов (не перевернутые). Под своим именем.
Срок сдачи: до 15.10.2020г.
Нитрофенилалкиламины.
Из большого числа антибиотиков, являющихся ароматическими соединениями, в медицинской практике применяют хлорамфеникол, или левомицетин, обнаруженный впервые в 1947 г. в культуральной жидкости актиномицета Streptomyces venezudae. В 1949 г. установлена его химическая структура и осуществлен синтез. Левомицетин был первым антибиотиком, химический синтез которого внедрен в промышленном масштабе, в то время как большинство других антибиотиков получают биосинтезом. Этому в значительной степени способствовала сравнительно простая химическая структура левомицетина. Он относится к числу производных пара-нитробензола:
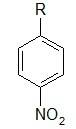
Природный антибиотик левомицетин (хлорамфеникол) также содержит 2-амидопропильную боковую группу в бензольном кольце. Он относится к редко встречающимся в природе соединениям, содержащим в своей молекуле нитрогруппу и атом галогена. Этот антибиотик эффективен в отношении многих грамположительных и грамотрицательных бактерий (активен только D-(-)-трео-изомер]. Его применяют для лечения брюшного тифа, дизентерии, коклюша, пневмонии и других заболеваний. Для увеличения водорастворимости левомицетин используют в виде сукцината натрия, а для пролонгирования его действия получают левомицетина стеарат. Его антимикробное действие связано с ингибированием синтеза белка у патогенных организмов.
|
|
|
Левомицетин-Хлорамфеникол-Laevomycetinum
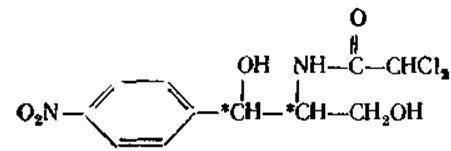
п-нитрофенил-2-дихлорацетиламинопропандиол-1,3
Свойства. Белый или белый со слабым желтовато-зеленоватым оттенком кристаллический порошок без запаха, горького вкуса. Т.пл. 149-153°C. Удельное вращение от +18 до +21 градуса (5% раствор в спирте).
Качественные реакции:
Официально:
1. Гидролиз в щелочной среде.
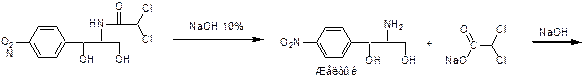
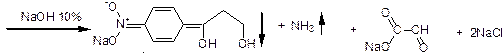
Осадок отфильтровывают, затем:
NaCl + AgNO3 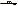 AgCl¯ + NaNO3
AgCl¯ + NaNO3
2. Раствор левомицетина в спирте вращает плоскость поляризации света влево
Не ГФ:
1. Образование медного комплекса.
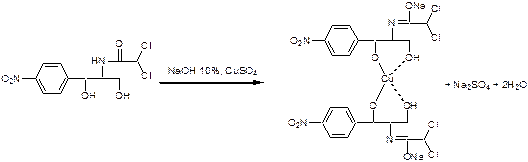
2. Образование азокрасителя с бета-нафтолом после восстановления аминогруппы цинков в кислой среде
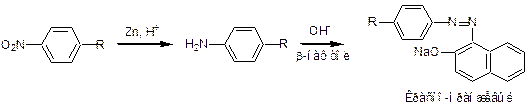
Количественное определение:
По ГФ:
а. Нитритометрия (после восстановления NH2 группы).
Навеску + HCl + Zn – охлаждают, титруют NaNO2 с KBr. Индикатор – йод-крахмальная бумага.
2 KI + 2NaNO2 + 4HCl à I2 + 2NO + 2NaCl + 2KCl + 2H2O f=1
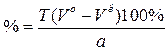
б. УФ СФМ в водном растворе.
|
|
|
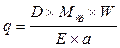
Не ГФ:
1. Куприметрия прямая. Мурексидная индикаторная смесь. Титрант: CuSO4. Титруют до перехода окраски от фиолетово к коричнево-красной. f=2.
2 Левомицетина + CuSO4 à (Левомицетин)2Cu + H2SO4
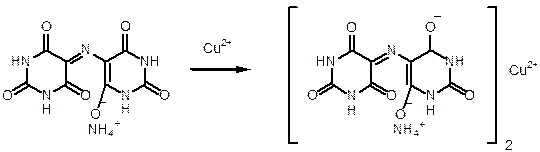
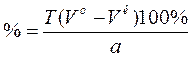
Формы выпуска. Таблетки 0,25 и 0,5 г. Мази «Левомеколь»; 0,25% глазные капли;0,25%; 1%; 3%; 5% спиртовый раствор; таблетки 0,25 г покрытые оболочкой; таблетки пролонгированного действия 0,65 г.; линимент Синтомицина.
Применение. Левомицетин применяют для лечения брюшного тифа, паратифов, дизентерии, бруцеллеза, коклюша, пневмонии, различных инфекционных заболеваний. Левомицетин легко всасывается из желудочно-кишечного тракта, сохраняя при этом свою активность. Это позволяет использовать его для назначения внутрь
Хранение. Список Б. В защищенном от света месте.
Антибиотики аминогликозиды.
Группа аминогликозидов объединяет родственные по химическому строению и антимикробному спектру антибиотики олигосахаридной природы – стрептомицины, гентамицины, неомицины, канамицины, мономицины, тобрамицин и др., а также полусинтетический аминогликозид – амикацин.
Антибиотики аминогликозиды получили свое название в связи с наличием в молекуле аминосахаридов, соединенных гликозидной связью с агликоновым фрагментом. По механизму действия аминогликозиды являются ингибиторами синтеза белка. Аминогликозиды характеризуются широким спектром антимикробного действия.
|
|
|
Первый антибиотик этой группы – стрептомицин – был открыт С.Ваксманом (США) в 1942 г.; применяется в медицинской практике с 1946 г.
В 1955 г. японскими учеными был выделен канамицин. Мономицин выделен в нашей стране Г.Ф.Гаузе в 1962 г. Гентамицин выделен и описан в США в 1962 г.; в нашей стране в медицинской практике применяется с 1976 г.
Аминогликозиды получают методом микробиологического синтеза. Продуцентом стрептомицина является Streptomyces globisporus streptomycini; канамицина — Streptomyces kanamyceticus; гентамицина — Microspora purpurea. Амикацин получают полусинтетическим способом.
Многие аминогликозиды обладают ото- и нефротоксичностью.
По химическому строению антибиотики-аминогликозиды являются гликозидами, состоящими из агликона и сахаров, боль-шинство из которых является аминосахарами.
Агликон аминогликозидов представляет собой циклогексановое кольцо с основными группами при С1 и С3 и гидроксильными группами при С4, С5 и С6
По характеру агликона аминогликозиды делят на 2 группы: стрептидинсодержащие и дезоксистрептаминосодержащие. К 1-й группе относятся стрептомицин, дигидрострептомицин, агликоном у которых является стрептидин; ко 2-й группе — канамицины, гентамицины, неомицины, мономицины, амикацин; агликоном у них является 2-дезоксистрептамин, который отличается от стрептиди-на наличием аминогрупп вместо остатков гуанидина и отсутствием оксигруппы при С2.
|
|
|
Аминогликозиды применяются в медицинской практике в виде солей — сульфатов.
Несколько особняком в этой группе стоит стрептомицин, так как по сути он является антибиотиком-гликозидом т.к. сахарные фрагменты не содержат аминогрупп.
Стрептомицина сульфат-Streptomycinisulfas
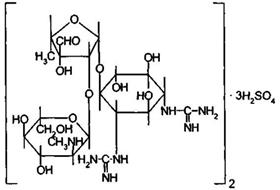
Химическоензвание. Streptomycin sulphate – bis[N,N ‘-bis (aminoiminomethyl) -4-O-[5-deoxy-2-O-[2-deoxy-2-(methylamino)-α-L-glucopyranosyl]-3-C-formyl-α-L-lyxofuranosyl]-D-streptamine] trisulphate.
Агликон стрептомицина- стрептидин представляет собой 1.3-дигуанидино-2,4,5,6-тетраоксициклогексан или спирт инозит, в котором две оксигруппы заменены остатками гуанидина:
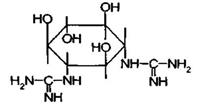
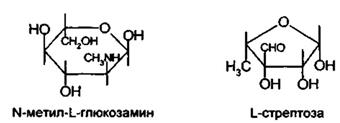
Сахарная часть стрептомицина представляет дисахарид стрептобиозамин, построенный из связанных между собой остатков N-метил-L-глюкозамина и L-стрептозы:
Свойства. Порошок белого или почти белого цвета, без запаха. Легко растворим в воде, практически нерастворим в этиловом или метиловом спирте. Гигроскопичен. Оптическое вращение от –78 до -83° (35 водный раствор).
Получение. Промышленными продуцентами стрептомицина служат штаммы актиномицетов Actinomyces streptomycini, Streptomyces griseus и др. Процессы ферментации осуществляют из наиболее активных штаммов, оптимизированных сред и других условий, обеспечивающих максимальный выход антибиотика. Затем из культуральной жидкости сорбируют стрептомицин, многократно пропуская через катиониты и затем очищают оксидом алюминия.
Химические свойства. Стрептомицин проявляет основные свойства ввиду наличия в молекуле азотсодержащих (двух гуаниди-новых и одной N-метильной) групп. Поэтому он легко образует со-ли (сульфат, гидрохлорид) и комплексы с ионами некоторых двухзарядных металлов. Применяют в медицине стрептоми-цина сульфат.
В слабокислой среде растворы стрептомицина устойчивы. Подобно другим гликозидам, он легко гидролизуется под действием сильных кислот с образованием стрептидина и стреп-тобиозамина. Стрептобиозамин затем распадается на N-метил-L-глюкозамин и L-стрептозу. Еще быстрее инактивируется стрепто-мицин в щелочной среде (на 50% в течение 3 ч под действием 0,1 М раствора гидроксида натрия). Однако при этом потеря активности обусловлена дегидратацией и изомеризацией L-стрептозы, которая превращается в мальтол (α-метил-β-окси-γ-пирон):
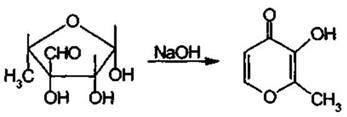
Подлинность. 1.ТСХ на силикагеле, содержащем поли-мер карбомер в сравнении с ГСО стрептомицина. Для сравне-ния используют растворы ГСО канамицина, ГСО неомицина.
2.Взаимодействие с хлоридом железа после щелочного гидролиза. В этом случае мальтол образуется значительно быстрее (в течение 4 мин), если стрептомицин нагревать с 0,5 М раствором гидроксида натрия на кипящей водяной бане. При взаимодействии с ионами железа (II!) в кислой среде мальтол превращается в соединение, имеющее фиолетовую окраску. Эту цветную реакцию используют для испытания подлинности стрептомицина. Она может быть применена и для его фотометрического определения. Мальтольная проба обусловлена наличием альдегидной группы в молекуле стрептомицина. Тест используется в Британской фармакопее (В).

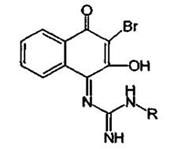
3.Гуанидиновый фрагмент идентифицируется по реакции с альфа-нафтолом в присутствии гипобромида (или гипохлорита) натрия. В этом случае происходит окислительное бромирование (или хлорирование) и образуется соединение хиноидного типа, окрашенное в красно-фиолетовый цвет:
4. При кислотном гидролизе стрептомицина образуются агликон стрептидин и сахарная часть в виде биозы – стрептобиозамина:

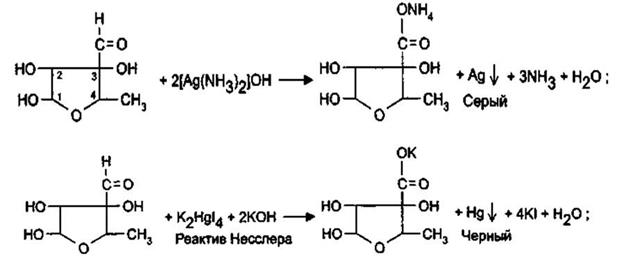
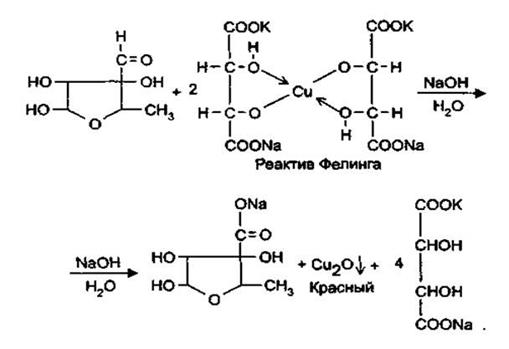
Альдегидная группа проявляет восстановительные свойства, обуславливая тем самым взаимодействие с реактивом Несслера с образованием металлической ртути (бурый осадок) и реактивом Фелинга, с образованием красного осадка оксида меди (1).
5.При конденсации альдегидной группы с фенолами, после нагревания стрептомицина с минеральной кислотой с резорцином образуется вишнево-красное окрашивание, с альфа-нафтолом (Британская фармакопея) – желтое окрашивание.

6.Гуанидиновый фрагмент может быть обнаружен также при щелочном гидролизе. Стрептидин представляет собой двухосновное соединение; при действии щелочью он превращается сначала в производное мочевины, а затем — в стрептамин:
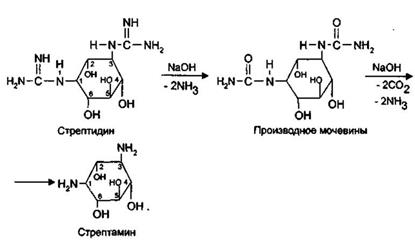
При нагревании со щелочью выделяется аммиак.
7.Реакция по сульфат-иону.
8.По реакции образования пикрата стрептидина с т.пл. 283-284°C.
9.Для установления подлинности стандартного образца стрептомицина, используемого для биологического теста и ТСХ используют ЯМР спектроскопию.
Количественное определение. 1.Фотоколориметрический метод с хлорным железом по мальтолу. Сравнивают оптическую плотность стандартного образца и высушенной субстанции.
2.Биологический метод определение активности методом диффузии в агар. Он должен быть не менее 730 МЕ/мг в пересчете на сухое вещество. 1 мкг химически чистого стрептомицина дол-жен соответствовать 1МЕ.
3.Трилонометрическим методом определяют количество сульфатов по связанному объему бария хлорида. Индикатор металлофталеин.
Применение. Антибиотик широкого спектра действия. Применяют, главным образом для лечения туберкулеза, редко бруцеллеза, чумы, сапа, мелиоидоза и др. Ототоксичен и нефротоксичен.
Форма выпуска. Стерильная рассыпка во флаконах по 250000, 500000, 1000000 МЕ для приготовления раствора для парентерального введения.
Хранение. В сухом помещении при температуре не выше 25°C.
Дигидрострептомицин, который вместо альдегидной группы в остатке L-стрептозы содержит оксиметильную группу, не образует мальтола, что отличает его от стрептомицина.
Антибиотики-аминогликозиды.
Канамицина сульфат – kanamycini monosulfas
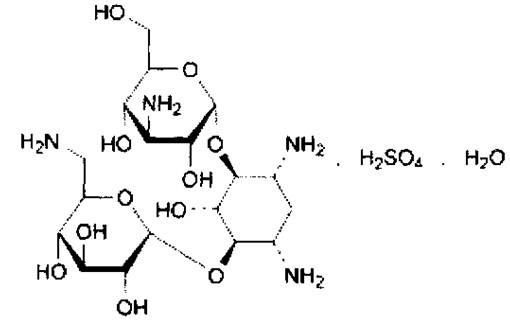
Группа антибиотиков – канамицинов, продуцируемых лучистым грибом – Streptomyces kanamiceticus, включает три близких по структуре препарата: Канамицин А, канамицин В, канамицин С. Наименьшую токсичность проявляет канамицин А, его содержание составляет 94%. В его структуру входит агликон мезо-1.3-диамино-4.5.6 триоксициклогексан и два остатка сахаров: 6-амино-6-дезокси-D-глюкоза и 3-амино-3-дезокси- D-глюкоза.
Название. Kanamycin monosulphate это 6-O-(3-amino-3-deoxy-α-D-glucopyranosyl) -4-O-(6-amino-6-deoxy-α-D-glucopyranosyl)-2-deoxy-D-streptamine sulphate.
Свойства. Белый кристаллический порошок без запаха и вкуса. Устойчив к воздействию воздуха. Легко растворим в воде. Показатель оптического вращения плоскости поляризованного света от +112 до +123 (1% раствор в воде, не содержащей СО2).
Получение. Биосинтез. Химочистка включает выделение антибиотика из культуральной жидкости с помощью ионообмен-ных смол, десорбцию, очистку углем и переосаждение метанолом из водного раствора.
Подлинность.
1.ТСХ в сравнении со стандартным образцом канамицина А.
2.рН раствора от 6.5 до 8,5.
3. Канамицина моносульфат как гликозид способен гидролизо-ваться в кислой среде; при кипячении с кислотами он подвергается гидролитическому расщеплению с полной потерей активности. В отличие от стрептомицина, канамицин устойчив в растворах щелочей. После кислотного гидролиза канамицин дает реакции на сахара (с реактивами Фелинга, Несслера, аммиачным раствором серебра нитрата).
4. При взаимодействии сахарных компонентов канамицина (например, 6-глюкозамина) с концентрированной соляной кислотой образуется 5-аминофурфурол, который можно обнаружить с орцином в присутствии железа (III) хлорида. Предполагают, что реакция протекает следующим образом:
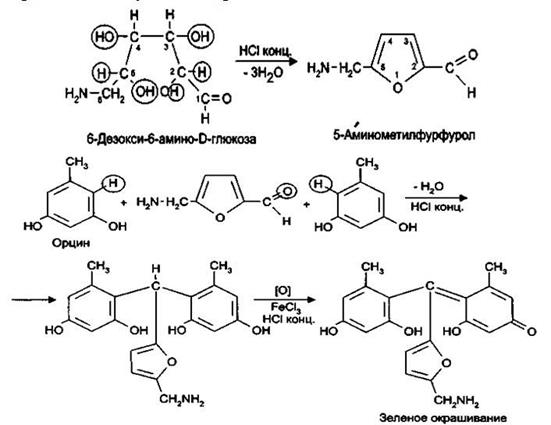
5.Испытания на токсичность. Данное испытание обусловлено высокой токсичностью примеси – канамицина В.
Примеси. Регламентируемыми примесями являются изомеры канамицина: канамицин В (не выше 5%) и канамицин С. Определяют ТСХ в сравнении со стандартными образцами. Количественно определяют примеси по интенсивности пятна в сравнении со стандартом.
Количественное определение. 1.Микробиологический метод диффузии в агар.
2.Поляриметрический метод. Метод находит применение в процессе получения антибиотика, в том числе и в культуральной жидкости.
3.Фотоколориметрический по образованию окрашенного продукта с орцином или нафтолом.
Применение. Антибиотик широкого спектра действия. Применяется главным образом для лечения туберкулеза. Ототоксичен, действует на глазной нерв.
Форма выпуска. В форме моносульфата канамицин выпускается в виде таблеток 0,25 г. канамицин дисульфат порошок 0,5 и 1,0 г для приготовления раствора для парентерального введения или внутривенного капельного введения.
Хранение. Список Б.
Дата добавления: 2020-11-15; просмотров: 148; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
