Запишите уравнение реакции получения в промышленности уксусной кислоты
ПКД-11 Тема. Химические свойства и способы получения карбоновых кислот.
https://interneturok.ru/lesson/chemistry/10-klass/karbonilnye-soedineniya-karbonovye-kisloty/himicheskie-svoystva-predelnyh-odnoosnovnyh-karbonovyh-kislot
Урок поможет вам получить представление о теме «Химические свойства предельных одноосновных карбоновых кислот» (школьная программа по химии 10 класса). В ходе занятия вы узнаете про химические свойства предельных карбоновых кислот, которые обусловлены наличием в их молекуле карбоксиловой группы.
Тема: Карбонильные соединения. Карбоновые кислоты
Урок: Химические свойства предельных одноосновных карбоновых кислот
Проявление кислотных свойств
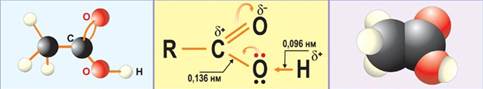
Из названия этих соединений можно предположить, что им характерны кислотные свойства.
Кислотные свойства
Кислотные свойства – способность к отщеплению иона водорода.
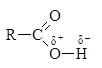 ⇆
⇆  +H+
+H+
В чем проявляются кислотные свойства карбоновых кислот?
1. Наличие свободного иона водорода в растворах кислот обуславливает их кислый вкус и взаимодействие с индикаторами.

2. Кислоты взаимодействуют с активными металлами, выделяя водород:
2СН3СOOH + Mg →(СН3СOO)2Mg + H2.
этанат магния
(ацетат магния)
3. Реакции c основаниями:
СН3СOOH + NaOH → СН3СOONa + H2O.
4. Реакции с основными оксидами:
2СН3СOOH + ZnO → (СН3СOO)2Zn + H2O.
|
|
|
5. Реакции с солями более слабых кислот:
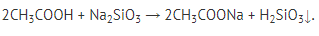
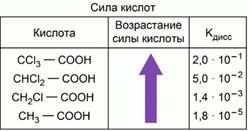
Сила карбоновых кислот
Электролит – вещество, диссоциирующее на ионы в растворе или расплаве.
Сильный электролит – электролит, диссоциирующий на ионы полностью.
Слабый электролит – электролит, диссоциирующий на ионы частично.
Карбоновые кислоты → слабые электролиты:
СН3СООН  СН3СОО- + Н+
СН3СОО- + Н+
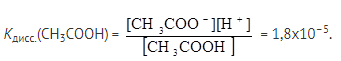
От чего зависит сила карбоновой кислоты?
1. От строения
Чем больше положительный заряд на атоме водорода в молекуле кислоты, тем более сильным электролитом она будет. Наличие электронодонорных углеводородных радикалов рядом с карбоксильной группой уменьшает способность кислоты диссоциировать.
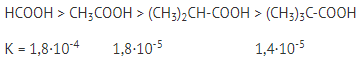
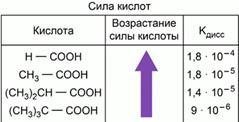
2. От наличия других групп в молекуле
Введение электроноакцепторных заместителей увеличивает положительный заряд на атоме водорода и силу кислоты.
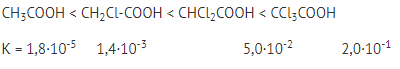
| Пропионовая | СН3-СН2-СООН | К = 1,3·10-5 |
| Молочная | СН3-СНОН-СООН | К = 1,5·10-4 |
| Муравьиная | НСООН | К = 1,8·10-4 |
| Щавелевая | НООС-СООН | К1 = 5,6·10-2 |
Нуклеофильное замещение (реакция этерификации)
Карбоновые кислоты взаимодействуют со спиртами в присутствии катализатора – серной кислоты, образуя сложные эфиры.
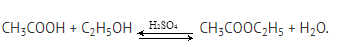
|
|
|
Подведение итога урока
При помощи данного урока вы смогли самостоятельно изучить тему «Химические свойства предельных одноосновных карбоновых кислот» (школьная программа по химии 10 класса). В ходе занятия вы узнали химические свойства предельных карбоновых (органических) кислот, которые обусловлены наличием в их молекуле карбоксильной группы.
Получение карбоновых кислот
Общим способом получения в промышленности карбоновых кислот служит окисление соответствующего альдегида кислородом воздуха в присутствии катализатора
Домашнее задание
Запишите уравнение реакции получения в промышленности уксусной кислоты
2. Какие две кислоты имеют общую молекулярную формулу С4Н8О2. Назовите их.
3. Какая из кислот монохлоруксусная или уксусная должна быть сильнее? Почему?
1-«3»+2 – «4» + 3 – «5»
Дата добавления: 2020-11-15; просмотров: 190; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
