Изучить текст лекции, записать краткий конспект – тип реакции и примеры.
Дата по расписанию:6.10.20 г.
Группа: 2-ТОРАТ-20
Дисциплина ОДБ.11 «Химия»
Тема по рабочей программе: Реакции, идущие с изменением состава вещества. Реакции соединения, разложения и обмена в неорганической и органической химии. Реакции экзо- и эндотермические. Тепловой эффект химической реакции и термохимические уравнения. Реакция горения как частный случай химической реакции.
Цель занятия:
· Методическая:
- усовершенствовать методику актуализации опорных знаний
· Дидактическая:
- систематизировать и расширить знания об химических реакциях;
- научить выделять существенные признаки, которые могут быть положены в основу классификации химических реакций;
- совершенствовать умения анализировать, делать выводы.
· Воспитательная:
- достичь понимания важности изучения дисциплины;
- развивать аккуратность, внимательность, настойчивость при выполнении заданий;
- прививать интерес к предмету.
Вид занятия: комбинированное занятие.
Тип занятия: приобретение новых знаний.
Ход занятия
Организационный момент
- проверка присутствия студентов;
- записи в журнале;
- проверка подготовки к занятию студентов.
Сообщение темы, цели и основных задач занятия.
Мотивация к изучению материала
Одна из задач химии использовать эти процессы для получения соединений с новыми полезными свойствами, а так же для получения разных видов энергии. В организме человека и в окружающем нас мире протекает огромное число реакций, без них невозможна жизнь. Чтобы ориентироваться в огромном царстве реакций, необходимо знать их типы. Сегодня мы и рассмотрим классификацию химических реакций.
|
|
|
Актуализация опорных знаний
1) Что называется явлением?
2) Чем сопровождается любое явление?
3) Какие виды энергий вы знаете?
4) В чём разница между физическими и химическими явлениями?
5) Какие уровни организации вещества затрагиваются при химических реакциях?
6) По каким признакам можно судить о протекании именно химических реакций?
Изучение нового материала
Химические реакции, или химические явления, — это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и (или) строению.
При химических реакциях обязательно происходит изменение веществ, при котором рвутся старые и образуются новые связи между атомами.
Химические реакции следует отличать от ядерных реакций. В результате химических реакций общее число атомов каждого химического элемента и его изотопный состав не меняются.
Можно выделить четыре типа таких реакций: соединения, разложения, замещения и обмена.
|
|
|
· Реакции соединения — это такие реакции, при которых из двух и более веществ образуется одно сложное вещество.
В неорганической химии все многообразие реакций соединения можно рассмотреть, например, на примере реакций получения серной кислоты из серы:
- Получение оксида серы(IV): S + O2 = SO2 — из двух простых веществ образуется одно сложное.
- Получение оксида серы (VI): SO2 + O2 = 2SO3 — из простого и сложного веществ образуется одно сложное.
- Получение серной кислоты: SO3 + Н2O = Н2SO4 — из двух сложных веществ образуется одно сложное.
Примером реакции соединения, при которой одно сложное вещество образуется из более чем двух исходных, может служить заключительная стадия получения азотной кислоты: 4NО2 + O2 + 2Н2O = 4НNO3
В органической химии реакции соединения принято называть «реакциями присоединения». Все многообразие таких реакций можно рассмотреть на примере блока реакций, характеризующих свойства непредельных веществ, например этилена:
- Реакция гидрирования — присоединения водорода:
CH2=CH2 + Н2 = CН3—СН3
· Реакции разложения — это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ.
|
|
|
В неорганической химии все многообразие таких реакций можно рассмотреть на блоке реакций получения кислорода лабораторными способами:
- Разложение оксида ртути(II) — из одного сложного вещества образуются два простых.
- Разложение нитрата калия — из одного сложного вещества образуются одно простое и одно сложное.
- Разложение перманганата калия — из одного сложного вещества образуются два сложных и одно простое, то есть три новых вещества.
В органической химии реакции разложения можно рассмотреть на блоке реакций получения этилена в лаборатории и в промышленности:
- Реакция дегидратации (отщепления воды) этанола:
С2H5OH → CH2=CH2 + H2O
- Реакция дегидрирования (отщепление водорода) этана:
CH3-CH3→ CH2=CH2 + H2
· Реакции замещения — это такие реакции, в результате которых атомы простого вещества замещают атомы какого-нибудь элемента в сложном веществе.
В неорганической химии примером таких процессов может служить блок реакций, характеризующих свойства, например, металлов:
- Взаимодействие щелочных или щелочноземельных металлов с водой: 2Na + 2Н2O = 2NаОН + Н2
- Взаимодействие металлов с кислотами в растворе:
Zn + 2НСl = ZnСl2 + Н2
- Взаимодействие металлов с солями в растворе:
|
|
|
Fе + СuSO4 = FеSO4 + Сu
Предметом изучения органической химии являются не простые вещества, а только соединения. Поэтому как пример реакции замещения приведем наиболее характерное свойство предельных соединений, в частности метана, — способность его атомов водорода замещаться на атомы галогена. Другой пример — бромирование ароматического соединения (бензола, толуола).
FеВr3
С6Н6 + Вr2 —> С6Н5Вr + НВr
Обратим внимание на особенность реакции замещения у органических веществ: в результате таких реакций образуются не простое и сложное вещество, как в неорганической химии, а два сложных вещества.
В органической химии к реакциям замещения относят и некоторые реакции между двумя сложными веществами, например нитрование бензола. Она формально является реакцией обмена. То, что это реакция замещения, становится понятным только при рассмотрении ее механизма.
· Реакции обмена — это такие реакции, при которых два сложных вещества обмениваются своими составными частями.
Эти реакции характеризуют свойства электролитов и в растворах протекают по правилу Бертолле, то есть только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество (например, Н2O).
В неорганической химии это может быть блок реакций, характеризующих, например, свойства щелочей:
- Реакция нейтрализации, идущая с образованием соли и воды.
- Реакция между щелочью и солью, идущая с образованием газа.
- Реакция между щелочью и солью, идущая с образованием осадка:
СuSO4 + 2КОН = Сu(ОН)2 + К2SO4
В органической химии можно рассмотреть блок реакций, характеризующих, например, свойства уксусной кислоты:
- Реакция, идущая с образованием слабого электролита — Н2O:
СН3СООН + NаОН = Nа(СН3СОО) + Н2O
- Реакция, идущая с образованием газа:
2СН3СООН + СаСO3 → 2СН3СОО + Са2+ + СO2 + Н2O
Система – это некоторая часть материального мира, ограниченная реальной или воображаемой поверхностью. Система, у которой отсутствует обмен веществом с окружающей средой, называется закрытой, а если отсутствует также и обмен энергией – изолированной системой.
Химические процессы - это превращение одних веществ в другие. На разрыв связей в молекулах исходных веществ энергия затрачивается, а при образовании связей в молекулах продуктов реакции энергия выделяется. Если общее количество затраченной энергии больше выделенной, то процесс идет с поглощением энергии и является эндотермическим (ΔН>0). Если же количество выделенной энергии больше затраченной, то процесс осуществляется с выделением энергии и является экзотермическим (ΔН<0).
Уравнения химических реакций, в которых указываются агрегатные состояния веществ, количества и тепловые эффекты, называются термохимическими.
Н2(г) + С12(г) = 2НС1(г) + 92,3 кДж
N2(г) + O2(г) = 2NO(г) - 90,4 кДж
Для возможности сопоставления энергетических эффектов различных процессов их принято измерять в стандартных условиях: химически чистые вещества, при температуре 25°С (298 К) и давлении в 1 атм.
Тепловой эффект химической реакции при постоянном объёме (Qv) равен изменению внутренней энергии: Qv= -ΔU. Тепловой эффект реакции при постоянном давлении (QР) равен изменению энтальпии: QР= -ΔН. Энтальпию Н можно рассматривать как энергию расширенной системы: Н = U + РV.
Тепловой эффект реакции образования одного моля сложного вещества из простых веществ в модификациях устойчивых в стандартных условиях, называется стандартной теплотой образования (стандартной энтальпией образования) данного вещества: ∆Hºобр (кДж/моль). Теплота образования устойчивых модификаций простых веществ в стандартном состоянии принимается равной нулю. Важнейшим свойством любой функции состояния является независимость ее изменения от способа, или пути, изменения состояния системы. Данное заключение отражено в законе Гесса: тепловой эффект химических реакций, протекающих при постоянном давлении или объеме, не зависит от пути протекания реакции и определяется состоянием исходных веществ и продуктов реакции.
Тепловой эффект химической реакции при стандартных условиях, как одно из следствий, равен разности сумм стандартных энтальпий образования продуктов реакции и стандартных энтальпий образования исходных веществ, с учётом числа молей соответствующих веществ:
∆ H º = Σ прод.∆ H ºобр.(прод.) – Σ исх.∆ H ºобр.(исх.),
где прод - количество вещества (моль) продукта реакции, исх - количество вещества (моль) исходных реагентов, ∆Hºобр.(прод.) и ∆Hºобр.(исх.) – энтальпии образования продуктов и исходных реагентов [кДж/моль] соответственно.
В химических процессах одновременно действуют две силы: стремление частиц объединиться за счёт прочных связей, что уменьшает энтальпию системы ΔН0. Энтропия S [Дж/(моль К)] является мерой свободы или мерой беспорядка. Две эти силы всегда направлены навстречу друг другу. При их равенстве система находится в равновесии. Результат действия энтальпийного (ΔН) и энтропийного (TΔS) факторов отражает термодинамический потенциал. В условиях постоянных температуры и давления этот потенциал называется энергией Гиббса G или изобарно–изотермическим потенциалом:ΔG = ΔН – TΔS.
По тепловому эффекту реакции делят на экзотермические и эндотермические.
· Экзотермические реакции протекают с выделением энергии.
К ним относятся почти все реакции соединения. Редкое исключение составляют эндотермические реакции синтеза оксида азота (IV) из азота и кислорода и реакция газообразного водорода с твердым иодом.
Экзотермические реакции, которые протекают с выделением света, относят к реакциям горения. Гидрирование этилена — пример экзотермической реакции. Она идет при комнатной температуре.
· Эндотермические реакции протекают с поглощением энергии.
- Обжиг известняка
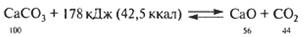
- Крекинг бутана
Домашнее задание
Изучить текст лекции, записать краткий конспект – тип реакции и примеры.
Выполнить упражнения:
1) Дано уравнение реакции получения оксида азота (ΙΙ):
N2 + O2 ↔ 2NO – Q
Дайте характеристику реакции по всем изученным вами классификационным признакам.
2) Проставьте коэффициенты в следующих схемах реакции, определите к какому типу относиться каждая из них:
- Al + О2 → Al2O3
- CaO + HCl → CaCl2 + H2O
- NaHCO3 → Na2CO3 + H2O + CO2
- Mg + H2SO4 → MgSO4 + H2
Дата добавления: 2020-11-15; просмотров: 40; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
