Перечень практических заданий к государственному экзамену
1. Как изменится скорость реакции А2 + 2В2 → 2АВ2, протекающей в газовой фазе в закрытом сосуде, если увеличить давление в 6 раз?
2. Какое количество бария нужно взять, чтобы при его взаимодействии с 1 л воды образовался 2%-ный раствор гидроксида бария?
3. Во сколько раз изменится скорость прямой реакции 2А + В  А2В, если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества В уменьшить в 2 раза?
А2В, если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества В уменьшить в 2 раза?
4. Во сколько раз следует увеличить концентрацию вещества В2 в газофазной реакции 2А2+ В2= 2А2В, чтобы при уменьшении концентрации вещества А в 4 раза скорость реакции не изменилась?
5. При взаимодействии оксида серы (IV) и кислорода концентрация кислорода уменьшилась на 0,25 моль/л в течение часа. Как и на сколько изменится при этом концентрация оксида серы (IV) и чему будет равна средняя скорость этой реакции по кислороду?
6. Прямая реакция между веществами А и В протекает по уравнению 2А + В = С. Начальные молярные концентрации веществ А и В равны 4 и 3 моль/л соответственно. Константа скорости реакции равна 0,1 л2/(моль2×с). Найдите скорость реакции в тот момент, когда прореагирует 50 % вещества А.
7. Константа скорости прямой реакции А + 2В = 3С равна 0,6 л2/(моль2·с). Начальные молярные концентрации веществ А и В равны 2,0 и 2,5 моль/л соответственно. В результате реакции молярная концентрация вещества В оказалась равной 0,5 моль/л. Вычислите, какова молярная концентрация вещества А и скорость реакции.
8. Прямая газофазная реакция идет по уравнению 4NH3+ 5O2= 4NO + 6H2O.
Как изменится скорость прямой реакции, если увеличить давление в 2 раза.
Ответ: увеличится в 512 раз.
9. Как и во сколько раз изменится скорость образования аммиака из газообразных азота и водорода, если уменьшить вместимость реакционного сосуда в 5 раз?
10. Константа скорости прямой газофазной реакции А + 2В = С при некоторой температуре равна 0,4 л2/(моль2×с), а начальные молярные концентрации веществ А и В составили соответственно 0,3 и 0,5 моль/л. Вычислите скорость этой реакции после того, как прореагирует 0,1 моль/л вещества А.
11. При некоторой температуре константа скорости прямой газофазной реакции
H2+ I2= 2HIсоставляет 0,16 л/(моль×мин), а начальные молярные концентрации водорода и йода соответственно равны 0,04 и 0,05 моль/л. Вычислите скорость реакции в момент времени, когда 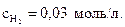
12. Во сколько раз надо увеличить концентрацию водорода, чтобы увеличить в 216 раз скорость реакции синтеза аммиака из водорода и азота?
Ответ: в 6 раз.
13. Во сколько раз надо повысить давление при синтезе аммиака из газообразных водорода и азота, чтобы увеличить скорость этой реакции в 256 раз?
14. Во сколько раз станет больше скорость прямой реакции по сравнению со скоростью обратной реакции в обратимой газофазной реакции 2NO + O2  2NO2, если увеличить давление в 5 раз?
2NO2, если увеличить давление в 5 раз?
15. Как изменится скорость прямой реакции СаО(к)+ СО2(г)= СаСО3(к), если увеличить концентрацию СО2 в 3 раза?
16. Температурный коэффициент скорости реакции равен 2,1. На сколько градусов следует увеличить начальную температуру, чтобы сократить время протекания реакции в 103 раз. Ответ: на 93,1С.
17. Насколько нужно повысить температуру, чтобы скорость реакции возросла в 90 раз? Температурный коэффициент равен 2,7. Ответ: на 45,3 градуса.
18. При повышении температуры с 20 до 60 С скорость реакции возросла в 150 раз. Найдите температурный коэффициент реакции.
19. При температуре 353 К реакция длится 20 с. Температурный коэффициент скорости данной реакции равен 2,5. Сколько времени будет проходить реакция при температуре 293 К?
20. Определите температурный коэффициент скорости реакции, если при понижении температуры на 45 С реакция замедлилась в 25 раз.
21. Константа скорости реакции, протекающей при температуре 273 К, равна 1,17 л/(моль×мин), а при температуре 298 К равна 6,56 л/(моль×мин). Найдите температурный коэффициент скорости реакции.
22. Температурный коэффициент скорости реакции разложения йодистого водорода равен 2. При температуре 629 К константа скорости равна 8,9×10-5 л/(моль×с). Вычислите константу скорости данной реакции, протекающей при температуре 674 К.
23. При температуре 0 С реакция заканчивается за 64 мин. Сколько времени потребуется для завершения этой реакции при температуре 50 С, если температурный коэффициент скорости реакции равен 2.
24. Две реакции при температуре 20 С протекают с одинаковой скоростью. Температурный коэффициент скорости первой реакции равен 2, а второй реакции равен 3. Как будут соотноситься скорости реакций, если первую проводить при температуре 60 С, а вторую при температуре 40 С?
25. Вычислите, при какой температуре реакция закончится за 45 мин, если при температуре 293 К на это требуется 3 часа. Температурный коэффициент скорости реакции равен 3,2.
26. Во сколько раз уменьшится скорость реакции, протекающей в газовой фазе, если понизить температуру от 120 до 80 С? Температурный коэффициент скорости реакции равен 3.
27. При температуре 150 С реакция заканчивается за 16 мин. Рассчитайте, через какое время закончится эта реакция, если ее проводить при температуре 200 С. Температурный коэффициент скорости реакции равен 2,5.
28. При температуре 393 К реакция заканчивается за 18 мин. Через какое время эта реакция закончится при температуре 453 К. Температурный коэффициент скорости реакции равен 3?
29. Константа скорости реакции, протекающей при температуре 288 К, равна 2×10-2 с-1, а при температуре 325 К равна 0,38 с-1. Рассчитайте температурный коэффициент скорости этой реакции.
30. Две реакции протекают при температуре 283 К с одинаковой скоростью. Температурный коэффициент скорости первой реакции равен 2,5, а второй – 3,0. Как будут соотноситься скорости реакций, если первую из них провести при температуре 350 К, а вторую – при температуре 330 К?
Дата добавления: 2020-04-25; просмотров: 60; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
