Раздел №2. Структура, свойства и функции ( 7 баллов)
Раздел №1. Материя (10 баллов)
Масс-спектрометрия – незаменимый инструмент в руках современного химика-исследователя. Данный инструмент позволяет находить точную массу молекул, находящихся в растворе (бывают настолько точные инструменты, что пренебрегать массой электронов становится невозможным!).
Например, если поместить жидкий гексан (C6H14) в масс-спектрометр, можно увидеть молекулярный пик (М) величиной в 86 единиц.
Аналогично для воды – М = 18 единиц.
В природе чаще всего встречаются два изотопа углерода: 12C и 13С (относительная частота 1.1%). Несмотря на то, что изотоп углерод-12 очевидно преобладает, при наличии большого количества атомов углерода в молекуле в масс спектрометре начинает появляться маленький пик М+1.
1. Сколько атомов углерода в неизвестном соединении X, если относительные частоты пиков M:M+1 равны 4.289:1. (1 балл)
Воспользуемся простейшими соображениями теории вероятности. Если в соединении будет один атом углерода, соотношение М+1:M должно быть равно 1.1%. Чем больше атомов углерода, тем больше вероятность того, что в соединении попадется один (поскольку пик М+1) изотоп 13С. Если быть точнее, эта вероятность равна 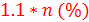 , где n – количество атомов углерода. Таким образом, получаем:
, где n – количество атомов углерода. Таким образом, получаем:
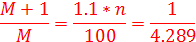
Откуда n = 21. (1 балл)
В таблице ниже приведены относительные частоты изотопов часто встречающихся элементов.
| Изотоп | 32S | 34S | 35Сl | 37Сl | 79Br | 81Br | 14N | 15N |
| Относительная частота (%) | 94.93 | 4.29 | 75.76 | 24.24 | 50.69 | 49.31 | 99.64 | 0.36 |
Юный химик-исследователь Ануар получил четыре образца: S 1, S 2, S 3, S 4. Первым делом он пошел к масс-спектрометру и получил следующие данные:
|
|
|
· В спектре S 1 наблюдается два молекулярных пика с относительной частотой 1:1 (М:М+2)
· В спектре S 2 наблюдается два молекулярных пика с относительной частотой 3:1 (М:М+2)
· В спектре S 3 наблюдается три молекулярных пика с относительной частотой 9:6:1 (М:М+2:М+4)
· В спектре S 4 наблюдается три молекулярных пика с относительной частотой 1:2:1 (М:М+2:М+4)
2. Что вы можете сказать об атомном составе S 1? (1 балла)
Мы наблюдаем два молекулярных пика, которые отличаются на 2 атомные единицы в соотношении 1:1. Это все указывает на то, что в соединении должен быть атом, который в природе представлен в виде двух изотопов в соотношении 1:1. Воспользовавшись таблицей, приходим к выходу, что это Бром. Значит, в составе S1 есть один атом брома (1 балл).
3. Что вы можете сказать об атомном составе S 2? (1 балл)
Аналогично первому пункту, только теперь соотношение 3:1. В данном случае подходит хлор (1 балл)
4. Что вы можете сказать об атомном составе S 3? (2 балл)
Первый вариант – возможно наличие одного атома, который представлен тремя изотопами, каждый из которых отличается на две массовые единицы. Таких атомов в таблице не наблюдаем. Значит что-то другое.
|
|
|
Возможно ли сочетание двух атомов, каждый из которых представлен в виде двух изотопов? Нужно попробовать. Изотопы серы и азота находятся в соотношениях как минимум 23:1, значит, наверняка, их в соединении нет.
Что если в соединении два брома, два хлора или один бром один хлор?
Проверим вариант с бромом (соотношение изотопов 1:1):
Допустим в соединении два атома А и Б.
У нас есть четыре варианта:
· А – 79Br, Б – 79Br, масса М
· А – 79Br, Б – 81Br, масса М+2
· А – 81Br, Б – 79Br, масса М+2
· А – 81Br, Б – 81Br, масса М+4
Поскольку частота изотопов брома одинаковая (соотношение 1:1), все четыре варианта равновозможны, а значит соотношение пиков должно быть 1:2:1. Это не подходит под описание S3, но подходит под описание S4.
Попробуем вариант с двумя хлорами. Снова четыре варианта:
1. А – 35Cl, Б – 35Cl, масса М
2. А – 35Cl, Б – 37Cl, масса М+2
3. А – 37Cl, Б – 35Cl, масса М+2
4. А – 37Cl, Б – 37Cl, масса М+4
В данном случае соотношение изотопов 3:1, а значит четыре варианта не равновозможны. Вероятность того, что атом хлора окажется изотопом 35Cl равна  , а вероятность того, что атом хлора окажется изотопом 37Cl равна
, а вероятность того, что атом хлора окажется изотопом 37Cl равна  .
.
|
|
|
Тогда, получаем вероятности четырех вариантов:
1. 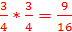
2. 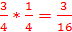
3. 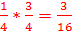
4. 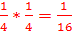
Поскольку второй и третий вариант обладают одинаковыми массами, получаем соотношение 9:6:1. Это соответствует описанию S3. Значит, мы можем сказать, что в S3 содержится два атома хлора (2 балла)
5. Что вы можете сказать об атомном составе S 4? (2 балла)
В нем находится два атома брома (как показано в предыдущем пункте). 2 балла.
Изомерия – это феномен в органической химии, когда два соединения с одинаковой химической формулой могут иметь разную структуру. Например, у гексана (C6H14) есть по меньшей мере два изомера:
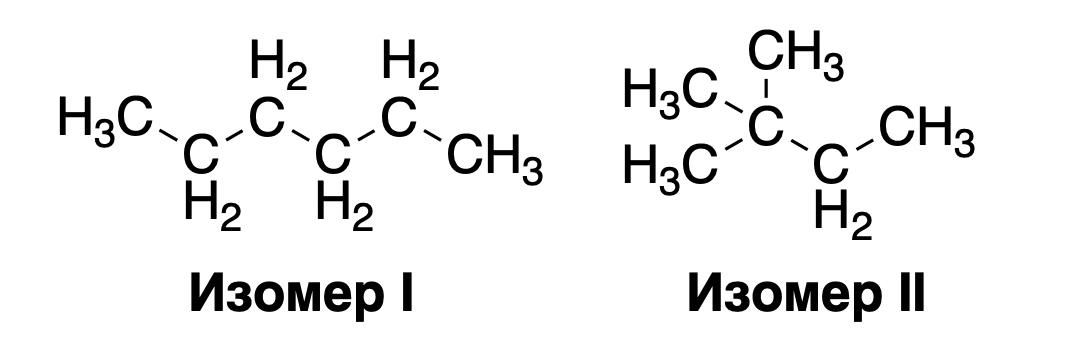
6. Используя ваши знания о природе межмолекулярных взаимодействий, предположите, какой изомер будет обладать более низкой температурой кипения? (1 балл)
У двух изомеров одинаковая формула, а значит одинаковая масса и количество электронов. Мы видим, что соединения состоят в основном из связей C-H и С-С. С-С связь ковалентная неполярная, а С-Н слабополярная, т.к. С и Н обладают очень схожими значениями электронейтральности. Таким образом, влияние диполь-дипольных взаимодействий должно быть небольшим.
Это все наталкивает на мысль о том, что главную роль играют дисперсионные силы (лондоновские силы). Ключ к разгадке ответа на вопрос заключается в том, что дисперсионные силы пропорциональны площади поверхности молекулы. Нетрудно заметить, что второй изомер обладает меньшей площадью поверхности, поскольку он более сжатый в «комочек» нежели первый изомер. Таким образом, за счет меньшей площади поверхности дисперсионные силы притяжения будут слабее, а значит температура кипения данного изомера тоже будет ниже. (1 балл)
|
|
|
Раздел №2. Структура, свойства и функции ( 7 баллов)
Хром является довольно распространённым элементом в земной коре. В свободном виде голубовато-белый металл с кубической объемно-центрированной решёткой. Устойчив на воздухе за счёт пассивирования. Для хрома характерны степени окисления +2, +3 и +6. Степень окисления +3 соответствует амфотерный гидроксид Cr(OH)3 . Благодаря амфотерным свойствам легко происходят реакции с растворами щелочей, но в их избытке образуется растворимый гидроксокомплекс. Хром, полученный при электролизе раствора нитрата хрома(III) обработали соляной кислотой, после чего раствор оставили на воздухе. Затем к этому раствору постепенно прилили раствор NaOH до полного растворения выпавшего вначале осадка. При этом израсходовано 228,6 см3 раствора NaOH с массовой долей 30 % (ρ = 1,40 г/см3).
7. Напишите уравнения реакций и рассчитайте массу выделенного на катоде хрома. Определите объем (н.у.) выделившего газа на аноде.
1) 4Cr(NO3)3 + 6 H2O  4Cr + 3O2↑ + 12HNO3 (электролиз) (1 балл)
4Cr + 3O2↑ + 12HNO3 (электролиз) (1 балл)
2) Cr + 2HCl  CrCl2 + H2↑ (0.5 балла)
CrCl2 + H2↑ (0.5 балла)
3) 4CrCl2 + O2 + 4HCl  4CrCl3 + 2H2↑ (1 балл)
4CrCl3 + 2H2↑ (1 балл)
4) 3NaOH + CrCl3  Cr(OH)3↓+ 3NaCl (0.5 балла)
Cr(OH)3↓+ 3NaCl (0.5 балла)
5) Cr(OH)3 + NaOH  Na[Cr(OH)4] (0.5 балла)
Na[Cr(OH)4] (0.5 балла)
Суммарные уравнения реакций.
6) 4Cr + 12HСl + 3O2  4CrCl3 + 6H2O
4CrCl3 + 6H2O
7) CrCl3 + 4NaOH  Na[Cr(OH)4] + 3NaCl
Na[Cr(OH)4] + 3NaCl
M(NaOH) = 40 г/моль; M(Cr) = 52 г/моль.
Масса раствора NaOH 228,6•1,4 = 320,04г. Масса NaOH 320,04•0,3 = 96,012г. Количество NaOH в растворе составит 96,012/40 = 2,4 моль. Из уравнений реакций (6, 7) следует, что 1 моль Cr → 1 моль CrCl3 → 4 моль NaOH, т.е. в реакцию с 2,4 моль NaOH вступает 2,4/4 моль хрома или 0,6•52 = 31,2 г. Следовательно, на катоде выделится 31,2 г хрома. (2 балла)
Количество кислорода определяем из уравнения реакции (1): оно равно 0,45 моль или 0,45•22,4 = 10,08 л кислорода. (1,5 балла)
Дата добавления: 2020-04-08; просмотров: 221; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
