Задания для самостоятельного решения
КИСЛОРОДСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ ВЕЩЕСТВА
Спирты
Цель: изучить строение, номенклатуру, способы получения, физические и химические свойства, применение одноатомных и многоатомных спиртов.
План лекции
1. Строение спиртов
2. Физические свойства
3. Способы получения одноатомных спиртов
4. Химические свойства одноатомных спиртов
5. Способы получения многоатомных спиртов
6. Химические свойства многоатомных спиртов
Спиртами называются производные углеводородов, в молекулах которых содержится одна или несколько гидроксильных групп (-ОН), связанных с насыщенными атомами углерода. Группа -ОН (гидроксильная, оксигруппа) является в молекуле спирта функциональной группой. Систематические названия даются по названию углеводорода с добавлением суффикса -ол и цифры, указывающей положение гидроксигруппы. Нумерация ведется от ближайшего к ОН-группе конца цепи. По числу гидроксильных групп спирты подразделяются на одноатомные (одна группа -ОН), многоатомные (две и более групп -ОН). Одноатомные спирты: метанол СН3ОН, этанол С2Н5ОН; двухатомный спирт: этиленгликоль (этандиол-1,2) HO–СH2–CH2–OH; трехатомный спирт: глицерин (пропантриол-1,2,3) HO–СH2–СН(ОН)–CH2–OH. В зависимости от того, с каким атомом углерода (первичным, вторичным или третичным) связана гидроксигруппа, различают спирты первичные R–CH2–OH, вторичные R2CH–OH, третичные R3C–OH. По строению радикалов, связанных с атомом кислорода, спирты подразделяются на предельные, или алканолы (СH3CH2–OH), непредельные, или алкенолы (CH2=CH–CH2–OH), ароматические (C6H5CH2–OH). Виды изомерии (структурная изомерия): 1) изомерия положения ОН-группы (начиная с С3); 2) углеродного скелета (начиная с С4); 3) межклассовая изомерия с простыми эфирами (например, этиловый спирт СН3CH2OH и диметиловый эфир CH3–O–CH3). Следствием полярности связи О–Н и наличия неподеленных пар электронов на атоме кислорода является способность спиртов к образованию водородных связей.
|
|
|
Физические свойства
Спирты, содержащие не более 11 атомов углерода, представляют собой жидкости, высшие гомологи (C12 и более) - твёрдые вещества. Низшие спирты (С1-С3) имеют характерный алкогольный запах и жгучий вкус, обладают сильным физиологическим действием. С4-С6 имеют резкий, неприятный (сивушный) запах.
Первые гомологи хорошо растворяются в воде, по мере увеличения молекулярной массы растворимость падает. Жидкие спирты - хорошие растворители многих органических соединений. Температура кипения спиртов выше, чем температура кипения соответствующих углеводородов и галогенопроизводных. Это определяется главным образом наличием полярной гидроксильной группы и ее способностью обуславливать образование водородных связей (природа водородной связи имеет электростатический и донорно-акцепторный характер) молекулами спирта как между собой, так и с молекулами полярных растворителей.
|
|
|

Отдельные молекулы спиртов соединяются между собой с помощью водородных связей, возникающих между водородом и кислородом атомами гидроксильных групп различных молекул спирта (с участием неподелённой пары электронов кислорода). В многоатомных спиртах наличие нескольких гидроксильных групп приводит к увеличению числа межмолекулярных водородных связей. Такое межмолекулярное связывание ведёт к заметному увеличению вязкости и температуры кипения многоатомных спиртов по сравнению с одноатомными спиртами.
Способы получения
1. CH2=CH2 + H2O/H+® CH3-CH2OH (гидратация алкенов)
2. CH3-CHO + H2  C2H5OH (восстановление альдегидов и кетонов)
C2H5OH (восстановление альдегидов и кетонов)
3. C2H5Br + NaOH (водн.) ® C2H5OH + NaBr (гидролиз галогенопроизводных
ClCH2–CH2Cl + 2NaOH (водн.) ® HOCH2–CH2OH + 2NaCl
4. СO + 2H2  СH3OH (получение метанола)
СH3OH (получение метанола)
5. C6H12O6  2C2H5OH + 2CO2 (брожение моноз)
2C2H5OH + 2CO2 (брожение моноз)
Химические свойства
Химические свойства спиртов связаны с наличием в их молекуле группы –ОН. Для спиртов характерны два типа реакций: разрыв связи С-О и связи О-Н.
|
|
|
1. 2C2H5OH + 2Na ®H2 + 2C2H5ONa (образование алкоголятов металлов Na, K, Mg, Al)
2. а) C2H5OH + HBr ® C2H5Br + H2O;
б) C2H5OH + PCl5 ® C2H5Cl + POCl3 + HCl;
в) C2H5OH + SOCl2 ®C2H5Cl + SO2 + HCl (замещение гидроксильной группы на галоген)
3. C2H5OH + HOC2H5  C2H5-O-C2H5 + H2O (межмолекулярная дегидратация)
C2H5-O-C2H5 + H2O (межмолекулярная дегидратация)
4. C2H5OH  CH2=СН2 + H2O (внутримолекулярная дегидратация)
CH2=СН2 + H2O (внутримолекулярная дегидратация)
5. СН3-СН2ОН + CuO → CH3-CHO + Cu + 2H2O (окисление до альдегидов)
Многоатомные спирты

Способы получения
1. 3СH2=CH2 + 2KMnO4+ 4H2O ®3CH2OH-CH2OH+ 2КОН+ 2MnO2 (окисление в мягких условиях, реакция Вагнера), образуется этиленгликоль

Химические свойства
1. Многоатомные спирты более сильные кислоты, чем одноатомные спирты (большее количество гидроксильных групп, кроме того, они оказывают взаимное влияние друг на друга).
Гликоли и глицерины образуют алкоголяты, аналогично одноатомным спиртам. Отличительным свойством является образование соединений типа хелатов с ионами тяжелых металлов. С Cu(ОН)2 образуется раствор ярко-синего цвета (качественная реакция).
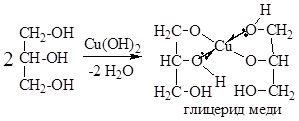

Реакция протекает с избытком реагентов
3. Реакция с HCl, HBr
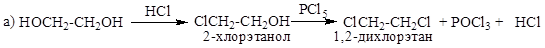


Применение спиртов
Метиловый спирт (метанол) CH3OH: а) производство формальдегида, муравьиной кислоты; б) растворитель. Этиловый спирт (этанол) С2Н5ОН: а) производство ацетальдегида, уксусной кислоты, бутадиена-1,3, простых и сложных эфиров; б) растворитель для красителей, лекарственных и парфюмерных средств; в) производство ликеро-водочных изделий; г) дезинфицирующее средство в медицине; д) горючее для двигателей, добавка к моторным топливам. Этиленгликоль HOCH2–CH2OH: а) производство пластмасс; б) компонент антифризов; в) сырье в органическом синтезе. Глицерин HOCH2–CH(OH)–CH2OH: а) фармацевтическая и парфюмерная промышленность; б) смягчитель кожи и тканей; в) производство взрывчатых веществ.
|
|
|
Фенолы
Цель: изучить строение, способы получения, химические свойства, применение фенола.
План лекции
1. Строение фенолов
2. Способы получения
3. Химические свойства
4. Применение фенолов
Фенолами называются производные аренов, в которых один или несколько атомов водорода ароматического кольца замещены на гидроксильные группы. По числу гидроксильных групп в ароматическом кольце различают одно- и многоатомные (двух- и трехатомные) фенолы. Для большинства фенолов используются тривиальные названия. Структурная изомерия фенолов связана с различным положением гидроксильных групп.

Способы получения
1. C6H5Cl + NaOH (p, 340°С) → C6H5OH + NaCl (щелочной гидролиз хлорбензола)
Химические свойства
Фенолы в большинстве реакций по связи О–Н активнее спиртов, поскольку эта связь более полярна за счёт смещения электронной плотности от атома кислорода в сторону бензольного кольца (участие неподелённой электронной пары атома кислорода в системе p-сопряжения). Кислотность фенолов значительно выше, чем спиртов. Для фенолов реакции разрыва связи С-О не  характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счёт участия своей неподелённой электронной пары в системе сопряжения. Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара-положениях (+М-эффект ОН-группы). Для обнаружения фенолов используется качественная реакция с хлоридом железа (III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счёт участия своей неподелённой электронной пары в системе сопряжения. Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара-положениях (+М-эффект ОН-группы). Для обнаружения фенолов используется качественная реакция с хлоридом железа (III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
1. 2C6H5OH + 2Na ® 2C6H5ONa + H2 (также как и этанол)
2. C6H5OH + NaOH ® С6H5ONa + H2O (в отличии от этанола)
3. C6H5OH + 3Br2 → C6H2OHBr3 + 3HBr
4. C6H5OH + 3HONO2 → C6H2OH(NO2)3 + 3H2O
Применение фенолов
Фенол - твёрдое вещество, с характерным запахом, вызывает ожоги при попадании на кожу. Ядовит. Растворяется в воде, его раствор называют карболовой кислотой (антисептик). Она была первым антисептиком, введённым в хирургию. Широко используется для производства пластмасс, лекарственных средств (салициловая кислота и её производные), красителей, взрывчатых веществ.
Спирты. Фенолы
Задания для самостоятельного решения
1. Приведите примеры важнейших представителей одноатомных и многоатомных спиртов. Укажите промышленные способы их получения и область применения в промышленности.
2. Приведите структурные формулы всех спиртов, изомерных диэтиловому эфиру. Назовите их.
3. Какие спирты можно получить при гидратации в кислой среде:
а) изобутилена; б) 2-метилпентена-1; в) пропилена; г) 2-метилбутена-2?
4. Напишите уравнения реакций получения этиленгликоля из этилена несколькими способами.
5. Охарактеризуйте особенности получения и характерные химические свойства фенолов.
6. Напишите уравнения межмолекулярной и внутримолекулярной дегидратации пропилового спирта в присутствии серной кислоты. Укажите условия реакции.
7. Напишите уравнения реакций взаимодействия глицерина: а) с гидроксидом меди (II), б) с двумя молекулами стеариновой кислоты, в) с тремя молекулами азотной кислоты. Назовите полученные соединения. Какие свойства глицерина проявляются в этих реакциях?
8. В разных пробирках находятся глицерин и этиловый спирт. Как экспериментально определить, в какой пробирке находится каждое вещество? Какие свойства должны быть использованы для определения этих соединений?
9. Какие из следующих веществ: а) оксид кальция, б) натрий, в) гидроксид меди (II), г) гидроксид натрия – будут реагировать с этанолом и с глицерином? Приведите соответствующие уравнения реакций. Дайте объяснения.
10. Напишите структурные формулы изомерных одноатомных спиртов состава С6Н13ОН и назовите их по систематической номенклатуре.
11. Напишите структурную формулу двухатомного спирта состава С5Н10(ОН)2, содержащего три метильные группы, назовите его по систематической номенклатуре.
12. Из представленных формул выберите те, которые могут отвечать фенолам: С6Н6О; С6Н6О3; С6Н12О; С7Н8О; С7Н14О; С6Н14О. Напишите структурные формулы выбранных фенолов. Сколько изомеров существует для каждого из них, приведите формулы этих изомеров и назовите их.
13. Составьте структурные формулы всех изомерных спиртов, отвечающих формуле С5Н11ОН. Назовите эти изомеры по систематической номенклатуре.
14. Напишите структурные формулы: а) 3-метилгексанола-3; б) 2,3-диметилбутанола-2; в) 2-метилпентанола-1; г) 3,3,4-триметилгексанола-1. Какие из них являются первичными?
15. Напишите структурные формулы веществ: а) бутандиол-1,3; б) бутандиол-2,3; в) 2-метилпропандиол-1,2; г) 2,3-диметилбутандиол-2,3; д) 3,3-диметилбутандиол-1,2; е) пропандиол-1,2; ж) бутантриол-1,2,3.
16. С каким из приведённых спиртов взаимодействует Cu(OH)2: а) СН3ОН; б) СН3-СНОН-СН3; в) СН3-СН2-СН2ОН; г) НОСН2-СН2ОН? Привести уравнение реакции.
17. Напишите структурные формулы следующих одноатомных спиртов: а) 2-метилпропанол-2; б) 2,3-диметилпентанол-3; в) 2,4,4-триметилпентанол-2; г) 2,3-диметилбутанол-2.
Альдегиды и кетоны
Цель: изучить строение, способы получения, физические и химические свойства альдегидов и кетонов, их применение.
План лекции
1. Строение альдегидов и кетонов
2. Физические свойства
3. Способы получения
4. Химические свойства
5. Применение
Альдегидами называются соединения, в которых карбонильная группа соединена с углеводородным радикалом и атомом водорода, а кетонами – карбонильные соединения с двумя углеводородными радикалами.

Систематические названия альдегидов строят по названию соответствующего углеводорода с добавлением суффикса -аль. Нумерацию цепи начинают с карбонильного атома углерода. Тривиальные названия производят от тривиальных названий тех кислот, в которые альдегиды превращаются при окислении:H2C=O –метаналь (муравьиный альдегид, формальдегид); CH3CH=O – этаналь (уксусный альдегид). Систематические названия кетонов несложного строения производят от названий радикалов с добавлением слова кетон. В более общем случае название кетона строится по названию соответствующего углеводорода и суффикса -он; нумерацию цепи начинают от конца цепи, ближайшего к карбонильной группе. Примеры: CH3–CO–CH3 - диметилкетон (пропанон, ацетон); CH3CH2CH2–CO–CH3 - метилпропилкетон (пентанон-2). Для альдегидов и кетонов характерна структурная изомерия. Изомерия альдегидов: а) изомерия углеродного скелета, начиная с С4; б)межклассовая изомерия. Изомерия кетонов: а) углеродного скелета (c C5); б)положения карбонильной группы (c C5); в) межклассовая изомерия.
Атомы углерода и кислорода в карбонильной группе находятся в состоянии sp 2-гибридизации. Связь С=О сильно полярна. Электроны кратной связи С=О смещены к электроотрицательному атому кислорода, что приводит к появлению на нём частичного отрицательного заряда, а карбонильный атом углерода приобретает частичный положительный заряд.
Физические свойства
Все низшие алифатические альдегиды и кетоны представляют собой бесцветные легкоподвижные жидкости (исключение формальдегид - газ). Температуры кипения ихзначительно ниже, чем соответствующих спиртов (так как молекулы не ассоциированы, нет подвижных водородов). Альдегиды и кетоны хорошо растворяются во всех органических растворителях. Формальдегид, уксусный альдегид, ацетон смешиваются с водой. Все они легче воды, горючи и ядовиты. Низшие альдегиды и кетоны имеют сильный и резкий запах. Ароматические альдегиды и кетоны, наоборот являются высококипящими жидкостями или твердыми веществами. Эти альдегиды мало токсичны, являются душистыми веществами. Они встречаются в природе и используются в парфюмерии, имея запах горького миндаля (бензальдегид), корицы (коричный альдегид), ванили (ванилин). Ароматическое ядро сильно уменьшает их растворимость в воде.
Способы получения
1. С2H5ОН + CuO → CH3CHO + Cu + H2O (окисление первичных спиртов)
2. а) СH3CH2CHCl2 + 2NaOH  CH3CH2CHO + 2NaCl + H2O (гидролиз)
CH3CH2CHO + 2NaCl + H2O (гидролиз)
б) СH3ССl2CH3 + 2NaOH  СH3COCH3 + 2NaCl + H2O из дигалогенопроизводных)
СH3COCH3 + 2NaCl + H2O из дигалогенопроизводных)

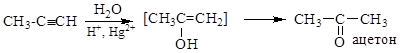
4. CH2=CH2 + [O] ®CH3-CH=O (PdCl2, Cu2Cl2 100о С, 1МПа) (окисление этилена до этаналя)
CH4 + O2 ® H2C=O + H2O (400-600о С, NO) (окисление метана до формальдегида)
Химические свойства
Для альдегидов и кетонов характерны реакции различных типов: восстановление и окисление.

2. R-CH=O + Ag2O  R-COOH + 2Ag¯ (окисление, реакция "серебряного зеркала")
R-COOH + 2Ag¯ (окисление, реакция "серебряного зеркала")
R-CH=O + 2Cu(OH)2 ® R-COOH + Cu2O¯ + 2H2O (красный осадок, окисление)
Дата добавления: 2020-04-25; просмотров: 83; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
