Обсуждение первого закона термодинамики
Тема: Законы термодинамики
1. Историческая справка.
В середине ХIХ века на основе работ, выполненных несколькими учеными (независимо друг от друга) был сформулирован закон сохранения энергии для тепловых процессов. Этот закон, позднее, получил название: «Первого закона термодинамики». Немецкий ученый Р. Майер выдвинул теоретические предпосылки закона. Английский физик Д. Джоуль провел его опытные обоснования и измерения. Немецкий ученый Г. Гельмгольц получил математическую формулу закона, обобщил и распространил полученные результаты на все явления природы.
4.2. Формулировка 1-го закона термодинамики для случаев, если:
а) работа совершается над газом: ΔU = Q + A;
б) работу совершает газ: ΔU = Q – A;
При определенных условиях полная механическая энергия тел, входящих в систему, может сохраняться. Есть и условия, при которых она не сохраняется, это тот случай, если в системе действуют так называемые диссипативные силы, примером такой силы является сила трения. В этом случае полная механическая энергия уменьшается, однако, как показывают наблюдения, температура тел, входящих в систему, растет.
Могут наблюдаться и в некотором смысле противоположные процессы. Например, вылет пробки из бутылки с газированной водой, механическая энергия пробки при этом, безусловно, возрастает, а вот содержимое бутылки при этом охлаждается (см. рис. 1).
|
|
|

Рис. 1. Пример процессов, наблюдаемых при вылете пробки из бутылки
Переход одного вида энергии в другую
За исключением движения небесных тел, нет таких явлений, в которых механическое движение не сопровождалось бы нагреванием или охлаждением окружающих тел. Когда тело благодаря трению остановилось, его кинетическая энергия на первый взгляд пропала, однако это лишь на первый взгляд. На самом деле сохранение имеет место с абсолютной точностью, Механическая энергия тела ушла на нагрев среды (рис. 2), вы это можете наблюдать, потерев ладони друг о друга.
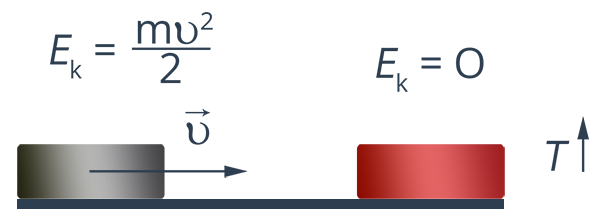
Рис. 2. Переход одного вида энергии в другой вид
Но что это значит на языке молекул? А вот что (рис. 3): кинетическая энергия тела перешла в кинетическую энергию молекул среды. А что происходит в том случае, если мы толчем в ступке лед? Ведь термометр в этом случае всегда показывает ноль, т. е. казалось бы, механическая работа происходит, а внутренняя энергия не изменяется. Куда она делась? И здесь ответ нам ясен: лед превратился в воду, значит, механическая энергия пошла на разрыв связей между молекулами (рис. 4). Т. е., как и в предыдущем случае, изменилась внутренняя энергия.
|
|
|

Рис. 3. Переход кинетической энергии тела в кинетическую энергию среды

Рис. 4. Изменение внутренней энергии, разрыв связей между молекулами, что приводит к образованию воды
Каждый раз, когда нам кажется, что механическая энергия куда-то исчезла, она переходит во внутреннюю энергию тела. В замкнутой системе одни тела могут терять энергию, другие тела могут приобретать эту энергию, однако полная сумма всей механической энергии тел и внутренней энергии тел системы остается неизменной.
Теперь рассмотрим два момента времени: в первый момент тела покоились, потом происходили какие-то события, а теперь тела снова покоятся. Мы уверены в том, что внутренняя энергия всех тел, входивших в систему, осталась неизменной:
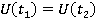
Но одни тела потеряли энергию, а другие приобрели. Это могло произойти двумя способами: либо одно тело совершило над другим механическую работу, допустим, сжало его или растянуло, либо одно тело предало другому тепло. Тепло и работа являются двумя формами, которыми энергия может передаваться от одного теля к другому, разница лишь в способе этой передачи. Передача тепла происходит беспорядочными ударами молекул, а передача механической энергии состоит в том, что молекулы одного тела стройно, как бы двигаясь шеренгой, передают свою энергию другому телу.
|
|
|
Первый закон термодинамики
Внутреннюю энергию системы можно совершить двумя способами: совершить над системой работу и/или передать системе некоторое количество теплоты. Это утверждение, только выраженное в строгой математической формуле, и получило название первого закона термодинамики. Иногда встречаются определения «первое начало термодинамики».
Изменение внутренней энергии системы равно разности между количеством теплоты, подведенным к системе, и работой, совершенной системой:
|
|
|
ΔU = Q – A
А – работа, совершенная системой,
Q – количество теплоты, переданной системе от внешних тел,
ΔU – это изменение внутренней энергии.
Первое начало термодинамики было сформулировано задолго до того, как в науке укрепилось понятие молекул, т. е. еще не была известна молекулярно-кинетическая теория. Поэтому первый закон термодинамики часто носит название феноменологического, т. е. такого, который относится к тому или иному явлению.
По большому счету можно сказать, что первый закон термодинамики является расширением и уточнением закона сохранения энергии.
Обсуждение первого закона термодинамики
Начнем с внутренней энергии. В дальнейшем, если это особо не оговорено, в качестве термодинамической системы будем рассматривать идеальный газ в каком-либо сосуде. Внутренняя энергия системы зависит от величин давления, объема и температуры:

А изменение внутренней энергии будет определяться только начальным и конечным состоянием и не будет зависеть от того, каким образом система перешла из одного состояния в другое:

Вспоминаем, что в идеальном газе мы пренебрегаем взаимодействием между молекулами, т. е. внутренняя энергия определяется только суммой кинетических энергий каждой из молекул. Давайте вспомним, что средняя кинетическая энергия движения молекул определяется только температурой. Тогда можем смело записать выражение для внутренней энергии:
 ,
,
где v – количество вещества,
R – универсальная газовая постоянная,
T – температура,
i – число степеней свободы молекул газа.
Таким образом, мы можем сказать, что внутренняя энергия идеального газа зависит только от температуры.
Переходим к величине работы. Работа, как и количество теплоты, входящее в левую часть уравнения для первого закона термодинамики, не являются характеристиками состояния системы, а зависят от процесса перехода, это логично. Например, переход системы из состояния один в состояние два (рис. 5) может осуществляться разными способами, в частности по пути а или по пути b. При этом изменение внутренней энергии будет одним и тем же для обоих процессов, а вот работа и количество теплоты будут различаться:



 Рис. 5. Переход системы из состояния 1 в состояние 2
Рис. 5. Переход системы из состояния 1 в состояние 2
Обозначим через  работу, выполняемую самой системой, идеальным газом, против внешних сил. Например, если газ расширяется, двигая поршень в сосуде, то этот газ совершает работу против сил тяжести поршня и против сил атмосферного давления, действующих на поршень с внешней стороны (рис. 6).
работу, выполняемую самой системой, идеальным газом, против внешних сил. Например, если газ расширяется, двигая поршень в сосуде, то этот газ совершает работу против сил тяжести поршня и против сил атмосферного давления, действующих на поршень с внешней стороны (рис. 6).
 Рис. 6. Действие внешних сил на поршень с идеальным газом
Рис. 6. Действие внешних сил на поршень с идеальным газом
Совершенно очевидно, что согласно третьему закону Ньютона эта работа будет равна работе внешних сил, взятой с обратным знаком:

Тогда уравнение для первого закона термодинамики можно переписать в виде:

Словесная формулировка этого выражения будет звучать так: сообщенная системе теплота идет на изменение ее внутренней энергии и на совершение системой механической работы против внешних сил.
Вывод
Теперь видна и практическая польза. Вопрос формулируется следующим образом: можно ли создать такое устройство, которое при передаче ему некоторого количества теплоты превратит это количество теплоты в полезную механическую работу? Ответ известен, такие устройства существуют, и называются они тепловыми двигателями. Фактически, стоит задача – как максимально эффективно превратить количество теплоты, которое мы передаем такому тепловому двигателю, в механическую работу.
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и на совершение работы над внешними телами:
|
ОПОРНЫЙ КОНСПЕКТ
| Первый закон термодинамики |
| Количество теплоты, которое отдано системе, идет на увеличение ее внутренней энергии и совершение работы системой над внешними телами |
| Q = А - ΔU |
| Изменение внутренней энергии системы во время ее перехода из одного состояния в другое равно сумме работы внешних сил над системой и количеству теплоты, отданному системе |
| ΔU = А′ - Q |
В изохорном процессе газ работы не совершает, и ΔU = Q. В изобарном процессе A = pΔV = p (V2 – V1). В изотермическом процессе ΔU = 0, и A = Q; вся теплота, переданная телу, идет на работу над внешними телами. Графически работа равна площади под кривой процесса на плоскости p, V.

|
| Рис. 7. Первое начало термодинамики для изохорного процесса. |
 Рис.8. Первое начало термодинамики для изобарного процесса.
Рис.8. Первое начало термодинамики для изобарного процесса.
|

|
| Рис. 9. Первое начало термодинамики для изотермического процесса. |

|
| Рис.10. Первое начало термодинамики для адиабатного процесса. |
Адиабатным называется процесс, при котором системе не передается тепло из окружающей среды: Q = 0. В адиабатном процессе вся работа совершается за счет внутренней энергии газа.
Дата добавления: 2020-04-25; просмотров: 225; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
