Аутоиммунизация и аутоиммунные болезни
Аутоиммунизация (аутоаллергия, аутоагрессия) - состояние, характеризующееся появлением реакции иммунной системы на нормальные антигены собственных тканей.
Аутоиммунизация тесно связана с понятием иммунологической толерантности (от лат. tolerare - переносить, терпеть). Оно характеризуется состоянием ареактивности («терпимости») лимфоидной ткани по отношению к антигенам, способным вызывать иммунный ответ. В период созревания лимфоидной ткани возникает иммунологическая
толерантность к антигенам всех органов и тканей, кроме тканей глаза, щитовидной железы, семенников, надпочечников, головного мозга и нервов. Считается, что антигены этих органов и тканей отграничены от лимфоидной ткани физиологическими барьерами, что и объясняет отсутствие к ним толерантности иммунокомпетентной системы. «Свои» и «чужие» тканевые антигены иммунная система начинает распознавать у новорожденного через несколько недель после рождения. При этом продукция аутоантител в незначительных количествах постоянно происходит на протяжении всей жизни и ауто-антитела, как полагают, принимают участие в регу-
ляции различных функций организма. Их действие находится под контролем Т-супрессоров и антиидиотипических антител, что не позволяет развиться аутоиммунному процессу.
Среди этиологических факторов аутоиммунизации ведущее значение придается хронической вирусной инфекции, радиации и генетическим нарушениям. Этиология тесно связана с патогенезом. В патогенезеаутоиммунных
|
|
|
заболеваний различают предрасполагающие, инициирующие и способствующие факторы. Кпредрасполагающим факторам относят определенные гены системы HLA, определяющие количественные и качественные индивидуальные особенности иммунного ответа; гормональный фон, связанный прежде всего с полом (у женщин аутоиммунные болезни встречаются в 6-9 раз чаще, чем у мужчин), и генетически обусловленные особенности клеток органов-мишеней аутоиммунного процесса. Неблагоприятное сочетание этих факторов определяет 50% риска развития болезни. Инициирующими факторами могут быть вирусные и бактериальные инфекции, физические, химические воздействия как на органы иммунной системы, так и на органы-мишени. Способствующие факторы аутоиммунизации - это дисфункция иммунной системы - снижение супрессорной активности Т-лимфоцитов и антиидиотипических антител.
Аутоиммунные болезни - это болезни, в основе которых лежит аутоиммунизация, т.е. агрессия аутоантител, циркулирующих иммунных комплексов, содержащих аутоантигены, и эффекторных иммунных клеток (лимфоцитов-киллеров) в отношении антигенов собственных тканей организма. Поэтому аутоиммунные болезни называют также аутоагрессивными.
|
|
|
Руководствуясь механизмом аутоиммунизации, различают две группы аутоиммунных заболеваний. Первая группа - это органоспецифические аутоиммунные болезни, которые развиваются в связи с повреждением физиологических барьеров иммунологически обособленных органов, что позволяет иммунной системе реагировать на их неизмененные антигены выработкой аутоантител и сенсибилизированных лимфоцитов. При этом в органах развиваются морфологические изменения, характерные преимущественно для ГЗТ: ткань органов инфильтрируется лимфоцитами, паренхиматозные элементы погибают, в финале развивается склероз. В эту группу входят тиреоидит (болезнь Хасимото) (рис. 80), энцефаломиелит, полиневрит, рассеянный склероз, идиопатическая аддисонова болезнь, асперматогения, симпатическая офтальмия.
Вторая группа - это органонеспецифические аутоиммунные заболевания. Ведущими при этих заболеваниях являются нарушения контроля иммунологического гомеостаза лимфоидной системой. Аутоиммунизация при этом развивается по отношению к антигенам многих органов и тканей, не обладающих органной специфичностью и неспособных вызывать продукцию антител при парентеральном введении. В органах и тканях развиваются морфологические изменения, характерные для реак-
|
|
|
 Рис.
Рис.
80. Тиреоидит Хасимото:
а - инфильтрация лимфоцитами ткани щитовидной железы, разрушение паренхиматозных элементов (микроскопическая картина); б - миграция лимфоцита (Лц) между клетками фолликула (КФ); множественные контакты и переплетения цитоплазматических отростков лимфоцита и фолликулярных клеток. Пр - просвет фолликула. Электронограмма. χ10 000 (по Ирвину и Муру)
ций гиперчувствительности как замедленного, так и особенно немедленного типов. К этой группе аутоиммунных заболеваний относят системную красную волчанку, ревматоидный артрит, системную склеродермию, дерматомиозит (группа ревматических болезней), вторичную тромботическую тромбоцитопеническую пурпуру (болезнь Мошковича).
Существуют аутоиммунные болезни промежуточного типа, т.е. близкие аутоиммунным заболеваниям первого или второго типа. Это миастения гравис, сахарный диабет I типа, тиреотоксикоз, синдромы Шегрена и Гудпасчера и др.
Помимо аутоиммунных заболеваний, выделяют болезни с аутоиммунными нарушениями. Появление аутоантигенов при этих заболеваниях связывают с изменением
|
|
|
антигенных свойств тканей и органов - денатурацией тканевых белков (при ожоге, облучении, травме, хроническом воспалении, вирусной инфекции); образование аутоантигена возможно при воздействии бактериального антигена, особенно перекрестно реагирующего (например, при гломерулонефрите, ревматизме). В образовании аутоантигена большое значение придается гаптенному механизму, причем в роли гаптена могут выступать как продукты обмена тела, так и микроорганизмы, токсины и лекарственные средства. Аутоиммунизация в
этих условиях определяет не возникновение заболевания, а прогрессирование характерных для него локальных (органных) изменений, которые отражают «морфологию реакций гиперчувствительности замедленного и немедленного типов. В эту группу заболеваний включают: определенные формы гломерулонефрита, гепатита, хронического гастрита и энтерита, цирроз печени, ожоговую болезнь, аллергические анемии, тромбоцитопению, агранулоцитоз, лекарственную аллергию.
Иммунодефицитные синдромы
Иммунодефицитные синдромы являются крайним проявлением недостаточности иммунной системы. Они могут быть первичными, обусловленными недоразвитием (гипоплазия, аплазия) иммунной системы -наследственные и врожденные иммунодефицитные синдромы, или вторичными (приобретенными), возникающими в связи с болезнью или проводимым лечением.
Первичные иммунодефицитные синдромы
Первичные иммунодефицитные синдромы могут быть выражением недостаточности: 1) клеточного и гуморального иммунитета; 2) клеточного иммунитета; 3) гуморального иммунитета.
Синдромы недостаточности клеточного и гуморального
иммунитета называют комбинированными. Они встречаются у детей и новорожденных, наследуются по аутосомно-доминантному типу (агаммаглобулинемия швейцарского типа, или синдром Гланцманна-Риникера; атаксиятелеангиэктазия Луи-Бар). При этих синдромах находят гипоплазию как вилочковои железы, так и периферической лимфоидной ткани (табл. 4), что и определяет дефект клеточного и гуморального иммунитета. В связи с
| |||||||||||||||||||||||||||||
Синдромы недостаточности клеточного иммунитета в одних случаях наследуются обычно по аутосомно-доминантному типу (иммунодефицит с ахондроплазией, или синдром Мак-Кьюсика), в других являются врожденными (агенезия или гипоплазия вилочковои железы, или синдром Дайджорджа). Помимо агенезии или гипоплазии вилочковои железы и Т- зависимых зон периферической лимфоидной ткани, что определяет дефицит клеточного иммунитета, для этих синдромов характерны множественные пороки развития (см. табл. 4).
Дети погибают от пороков развития либо от осложнений инфекционных заболеваний.
Синдромы недостаточности гуморального иммунитета имеют наследственную природу, причем установлена сцепленность их с Х-хромосомой (см. табл. 4). Болеют дети первых пяти лет жизни. Для одних синдромов
Таблица 4. Первичные иммунодефицитные синдромы
|
| Название синдрома | Тип наследования | Клинико-морфологические проявления | Иммунные нарушения |
| Синдромы недостаточности гуморального иммунитета | |||
| Агаммаглобулинемия, сцепленная с Х- хромосомой (синдром Брутона) | Сцепленный с Х-хромосомой | Вилочковая железа сохранена. Отсутствие В-зависимых зон и клеток плазмоцитарного ряда в лимфатических узлах и селезенке, частные инфекционные заболевания | Дефект гуморального иммунитета, потеря способности к синтезу иммуноглобулинов |
| Избирательный дефицит IgA (синдром Веста) | То же | Структура лимфоидной ткани сохранена. Проявления аллергии. Частые инфекции дыхательных путей и желудочнокишечного тракта в сочетании с аутоиммунными болезнями, синдром нарушенного всасывания, иногда с опухолями | Потеря способности к синтезу IgA |
(агаммаглобулинемия, сцепленная с Х-хромосомой, или синдром Брутона) характерна потеря способности к синтезу всех иммуноглобулинов, что морфологически подтверждается отсутствием В-зависимых зон и клеток плазмоцитарного ряда в периферической лимфоидной ткани, прежде всего в лимфатических узлах и селезенке. Другим синдромам свойствен дефицит одного из иммуноглобулинов (например, избирательный дефицит IgA, или синдром Веста), тогда структура лимфоидной ткани остается сохранной. Однако при всех синдромах недостаточности гуморального иммунитета развиваются тяжелые бактериальные инфекции с преобладанием гнойно-деструктивных процессов в бронхах и легких, желудочнокишечном тракте, коже, ЦНС, нередко заканчивающихся сепсисом.
Помимо иммунодефицитных, известны синдромы недостаточности системы моноритарных фагоцитов и нейтрофилов, среди которых наследственные заболевания и синдромы - хроническая гранулематозная болезнь, синдромы Чедиака-Хигаси и Джоба и др.
Вторичные иммунодефицитные синдромы
Вторичные (приобретенные) иммунодефицитные синдромы в отличие от первичных возникают в связи с болезнью или определенным видом лечения.
Среди заболеваний, ведущих к развитию недостаточности иммунной системы, основное значение имеет безудержно распространяющийся во многих странах мира синдром приобретенного иммунного дефицита,или СПИД, - самостоятельное заболевание, вызываемое определенным вирусом (см. Вирусные инфекции). К развитию вторичных иммунодефицитных синдромов ведут также другие инфекции, лейкозы, злокачественные
лимфомы (лимфогранулематоз, лимфосаркома, ретикулосаркома), тимома, саркоидоз. При этих заболеваниях возникает недостаточность гуморального и клеточного иммунитета в результате дефекта популяции как В-, так и Т-лимфоцитов, а возможно, и их предшественников.
Среди видов лечения, ведущих к вторичной недостаточности иммунной системы, наибольшее значение имеют лучевая терапия, применение кортикостероидов и иммунодепрессантов, антилимфоцитарной сыворотки, тимэктомия, дренирование грудного протока и др.
Недостаточность иммунной системы, развивающаяся в связи с лечением той или иной болезни, рассматривается как патология терапии (ятрогения).
При вторичных, как и при первичных, иммунодефицитных синдромах часто наблюдаются гнойные инфекции, обострение туберкулезного процесса, сепсис.
РЕГЕНЕРАЦИЯ
Общие сведения
Регенерация (от лат. regeneratio - возрождение) - восстановление (возмещение) структурных элементов ткани взамен погибших. В биологическом смысле регенерация представляет собой приспособительный процесс,выработанный в ходе эволюции и присущий всему живому. В жизнедеятельности организма каждое функциональное отправление требует затрат материального субстрата и его восстановления. Следовательно, при регенерации происходит самовоспроизведение живой материи, причем это самовоспроизведение живого отражает принцип ауторегуляции и автоматизации жизненных отправлений (Давыдовский И.В., 1969).
Регенераторное восстановление структуры может происходить на разных уровнях - молекулярном, субклеточном, клеточном, тканевом и органном, однако всегда речь идет о возмещении структуры, которая способна выполнять специализированную функцию.
Регенерация - это восстановление как структуры, так и функции. Значение регенераторного процесса - в материальном обеспечении гомеостаза.
Восстановление структуры и функции может осуществляться с помощью клеточных или внутриклеточных гиперпластических процессов. На этом основании различают клеточную и внутриклеточную формы регенерации (Саркисов Д.С., 1977). Для клеточной
формы регенерации характерно размножение клеток митотическим и амитотическим путем, для внутриклеточной формы, которая может быть органоидной и внутриорганоидной, - увеличение числа (гиперплазия) и размеров (гипертрофия) ультраструктур (ядра, ядрышек, митохондрий, рибосом, пластинчатого комплекса и т.д.) и их компонентов (см. рис. 5, 11, 15).Внутриклеточная форма регенерации является универсальной, так как она свойственна всем органам и тканям. Однако структурно-функциональная специализация органов и тканей в фило- и онтогенезе «отобрала» для одних преимущественно клеточнуую форму, для других
- преимущественно или исключительно внутриклеточную, для третьих - в равной мере обе
формы регенерации (табл. 5). Преобладание той или иной формы регенерации в определенных органах и тканях определяется их функциональным назначением, структурно- функциональной специализацией. Необходимость сохранения целостности покровов тела объясняет, например, преобладание клеточной формы регенерации эпителия как кожи, так и слизистых оболочек. Специализированная функция пирамидной клетки головного
мозга, как и мышечной клетки сердца, исключает возможность деления этих клеток и позволяет понять необходимость отбора в фило- и онтогенезе внутриклеточной регенерации как единственной формы восстановления данного субстрата.
Таблица 5. Формы регенерации в органах и тканях млекопитающих (по Саркисову Д.С., 1988)
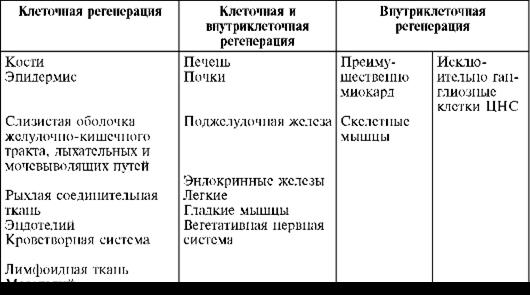 Эти данные опровергают существовавшие до недавнего времени представления об утрате некоторыми
Эти данные опровергают существовавшие до недавнего времени представления об утрате некоторыми
органами и тканями млекопитающих способности к регенерации, о «плохо» и «хорошо» регенерирующих тканях человека, о том, что существует «закон обратной зависимости» между степенью дифференцировки тканей и способностью их к регенерации. В настоящее время установлено, что в ходе эволюции способность к регенерации в некоторых тканях и органах не исчезла, а приняла формы (клеточную или внутриклеточную), соответствующие их структурному и функциональному своеобразию (Саркисов Д.С., 1977). Таким образом, все ткани и органы обладают способностью к регенерации, различны лишь ее формы в зависимости от структурно-функциональной специализации ткани или органа.
Морфогенез регенераторного процесса складывается из двух фаз - пролиферации и дифференцировки. Особенно хорошо эти фазы выражены при клеточной форме регенерации. В фазу пролиферацииразмножаются молодые, недифференцированные клетки. Эти клетки называют камбиальными (от лат. cambium- обмен, смена), стволовыми
клетками и клетками-предшественниками.
Для каждой ткани характерны свои камбиальные клетки, которые отличаются степенью пролиферативной активности и специализации, однако одна стволовая клетка может быть родоначальником нескольких видов
клеток (например, стволовая клетка кроветворной системы, лимфоидной ткани, некоторые клеточные представители соединительной ткани).
В фазу дифференцировки молодые клетки созревают, происходит их структурно- функциональная специализация. Та же смена гиперплазии ультраструктур их дифференцировкой (созреванием) лежит в основе механизма внутриклеточной регенерации.
Регуляция регенераторного процесса. Среди регуляторных механизмов регенерации различают гуморальные, иммунологические, нервные, функциональные.
Гуморальные механизмы реализуются как в клетках поврежденных органов и тканей (внутритканевые и внутриклеточные регуляторы), так и за их пределами (гормоны, поэтины, медиаторы, факторы роста и др.). К гуморальным регуляторам относят кейлоны (от
греч. chalaino - ослаблять) - вещества, способные подавлять деление клеток и синтез ДНК; они обладают тканевой специфичностью. Иммунологические механизмырегуляции связаны с
«регенерационной информацией», переносимой лимфоцитами. В связи с этим следует заметить, что механизмы иммунологического гомеостаза определяют и структурный гомеостаз. Нервные механизмы регенераторных процессов связаны прежде всего с трофической функцией нервной системы, афункциональные механизмы - с функциональным
«запросом» органа, ткани, который рассматривается как стимул к регенерации.
Развитие регенераторного процесса во многом зависит от ряда общих и местных условий, или факторов. Кобщим следует отнести возраст, конституцию, характер питания, состояние обмена и кроветворения, кместным - состояние иннервации, крово- и лимфообращения ткани, пролиферативную активность ее клеток, характер патологического процесса.
Классификация. Различают три вида регенерации: физиологическую, репаративную и патологическую.
Физиологическая регенерация совершается в течение всей жизни и характеризуется постоянным обновлением клеток, волокнистых структур, основного вещества соединительной ткани. Нет таких структур, которые не подвергались бы физиологической регенерации. Там, где доминирует клеточная форма регенерации, имеет место обновление клеток. Так происходит постоянная смена покровного эпителия кожи и слизистых оболочек, секреторного эпителия экзокринных желез, клеток, выстилающих серозные и синовиальные оболочки, клеточных элементов соединительной ткани, эритроцитов, лейкоцитов и тромбоцитов крови и т.д. В тканях и органах, где клеточная форма регенерации утрачена, например в сердце, головном мозге, происходит обновление внутриклеточных структур. Наряду с обновлением клеток и субклеточных структур постоянно совершаетсябиохимическая регенерация, т.е. обновление молекулярного состава всех компонентов тела.
Репаративная или восстановительная регенерация наблюдается при различных патологических процессах, ведущих к повреждению клеток и тка-
ней. Механизмы репаративной и физиологической регенерации едины, репаративная регенерация - это усиленная физиологическая регенерация. Однако в связи с тем, что репаративная регенерация побуждается патологическими процессами, она имеет качественные морфологические отличия от физиологической. Репаративная регенерация может быть полной и неполной.
Полная регенерация, или реституция, характеризуется возмещением дефекта тканью, которая идентична погибшей. Она развивается преимущественно в тканях, где преобладает клеточная регенерация. Так, в соединительной ткани, костях, коже и слизистых оболочках даже относительно крупные дефекты органа могут путем деления клеток замещаться тканью, идентичной погибшей. При неполной регенерации, илисубституции, дефект замещается соединительной тканью, рубцом. Субституция характерна для органов и тканей, в которых преобладает внутриклеточная форма регенерации, либо она сочетается с клеточной регенерацией. Поскольку при регенерации происходит восстановление структуры, способной к выполнению специализированной функции, смысл неполной регенерации не в замещении дефекта рубцом, а вкомпенсаторной гиперплазии элементов оставшейся специализированной ткани, масса которой увеличивается, т.е.
происходит гипертрофия ткани.
При неполной регенерации, т.е. заживлении ткани рубцом, возникает гипертрофия как выражение регенераторного процесса, поэтому ее называют регенерационной, в ней - биологический смысл репаративной регенерации. Регенераторная гипертрофия может осуществляться двумя путями - с помощью гиперплазии клеток или гиперплазии и гипертрофии клеточных ультраструктур, т.е. гипертрофии клеток.
Восстановление исходной массы органа и его функции за счет преимущественно гиперплазии клетокпроисходит при регенерационной гипертрофии печени, почек, поджелудочной железы, надпочечников, легких, селезенки и др. Регенерационная гипертрофия за счет гиперплазии клеточных ультраструктур характерна для миокарда, головного мозга, т.е. тех органов, где преобладает внутриклеточная форма регенерации. В миокарде, например, по периферии рубца, заместившего инфаркт, размеры мышечных волокон значительно увеличиваются, т.е. они гипертрофируются в связи с гиперплазией их субклеточных элементов (рис. 81). Оба пути регенерационной гипертрофии не исключают друг друга, а, наоборот,
нередко сочетаются. Так, при регенерационной гипертрофии печени происходит не только увеличение числа клеток в сохранившейся после повреждения части органа, но и гипертрофия их, обусловленная гиперплазией ультраструктур. Нельзя исключить того, что в мышце сердца регенерационная гипертрофия может протекать не только в виде гипертрофии волокон, но и путем увеличения числа составляющих их мышечных клеток.
Восстановительный период обычно не ограничивается только тем, что в поврежденном органе развертывается репаративная регенерация. Если
 Рис.
Рис.
81. Регенерационная гипертрофия миокарда. По периферии рубца расположены гипертрофированные мышечные волокна
воздействие патогенного фактора прекращается до гибели клетки, происходит постепенное восстановление поврежденных органелл. Следовательно, проявления репаративной реакции должны быть расширены за счет включения восстановительных внутриклеточных процессов в дистрофически измененных органах. Общепринятое мнение о регенерации только как о завершающем этапе патологического процесса малооправданно. Репаративная регенерация не местная, а общая реакция организма, охватывающая различные органы, но реализующаяся в полной мере лишь в том или ином из них.
О патологической регенерации говорят в тех случаях, когда в результате тех или иных причин имеетсяизвращение регенераторного процесса, нарушение смены
фаз пролиферации
и дифференцировки. Патологическая регенерация проявляется в избыточном или недостаточном образовании регенерирующей ткани (гипер- или гипорегенерация), а также в
превращении в ходе регенерации одного вида ткани в другой [метаплазия - см. Процессы приспособления (адаптации) и компенсации]. Примерами могут служить гиперпродукция соединительной ткани с образованием келоида, избыточная регенерация периферических нервов и избыточное образование костной мозоли при срастании перелома, вялое заживление ран и метаплазия эпителия в очаге хронического воспаления. Патологическая регенерация обычно развивается при нарушениях общих и местных условий регенерации (нарушение иннервации, белковое и витаминное голодание, хроническое воспаление и т.д.).
Дата добавления: 2020-04-25; просмотров: 101; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
