Реагирует с солями, вытесняет слабые кислоты из их солей
2HNO3 + Na2CO3 → 2NaNO3 + H2O + CO2
2H+ + 2NO3- + 2Na+ + СO32- → 2Na+ + 2NO3- + H2O + CO2
2H+ + СO32- → H2O + CO2
СПЕЦИФИЧЕСКИЕ СВОЙСТВА АЗОТНОЙ КИСЛОТЫ
Азотная кислота - сильный окислитель
N +5 → N +4 → N +2 → N +1 → No → N -3
N +5 + 8 e - → N -3 окислитель, восстанавливается.
Разлагается на свету и при нагревании
4HNO3 t˚C→ 2H2O + 4NO2 + O2
Образуется бурый газ

2. Окрашивает белки в оранжево-желтый цвет (при попадании на кожу рук - " ксантопротеиновая реакция")
Реагирует с металлами.
В зависимости от концентрации кислоты и положения металла в электрохимическом ряду напряжений Н. Бекетова могут образовываться разные азотсодержащие продукты.
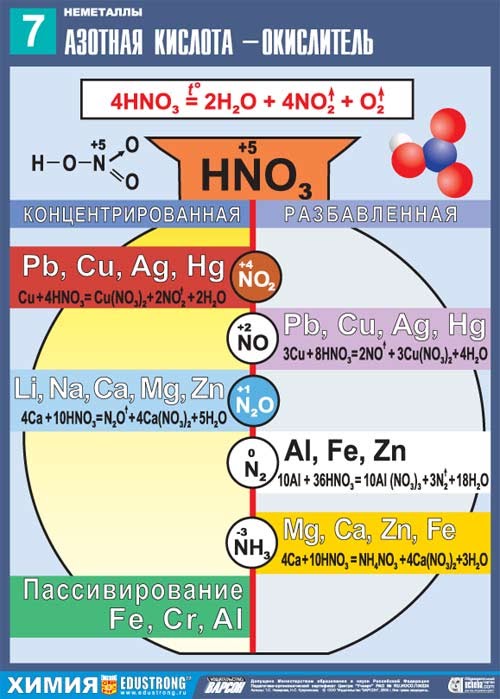
При взаимодействии с металлами никогда не выделяется водород
HNO 3 + Me = соль + H 2 O + Х
| Щелочные и щелочноземельные | Fe, Cr, Al, Ni, Co | Металлы до водорода | Металлы после водорода (Cu и др) | Благородные Au, Pt, Os, Ir, Ta | |
| HNO3 (конц.ω>60%) | N2O | пассивация (при обычных условиях); NO2 (при нагревании) | NO2 | NO2 | Нет реакции |
| HNO3 (разбавл.) | NH3, NH4NO3 | Основной NO, но в зависимости от разбавления могут образовываться N2, N2O, NH3, NH4NO3. Чем больше разбавлена кислота, тем ниже степень окисления азота. | NO | ||
Таблица. Продукты реакции взаимодействия азотной кислоты с металлами
Взаимодействие меди с азотной кислотой
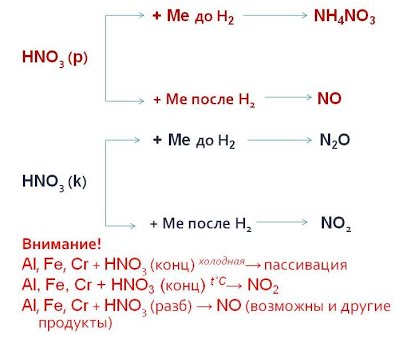
Упрощенная схема «Продукты реакции взаимодействия азотной кислоты с металлами»
Царская водка: V(HNO3) : V(HCl) = 1 : 3 растворяет благородные металлы.
|
|
|
HNO3 + 4HCl + Au = H[AuCl4] + NO + 2H2O
4HNO3 + 18HCl + 3Pt = 3H2[PtCl6] + 4NO + 8H2O
Реагирует с неметаллами.
Азотная кислота превращается в NO (или в NO2); неметаллы окисляются до соответствующих кислот:
Видео "Взаимодействие азотной кислоты с углем"
S0 + 6HNO3(конц) → H2S+6O4 + 6NO2 + 2H2O
B0 + 3HNO3 → H3B+3O3 + 3NO2
3P0 + 5HNO3 + 2H2O → 5NO + 3H3P+5O4
HNO 3 (конц.) + неметалл = окисление неметалла до кислоты в высшей степени окисления + NO 2 + вода
HNO 3 (разбав.) + неметалл + вода = окисление неметалла до кислоты в высшей степени окисления + NO
ВИДЕО - ЭКСПЕРИМЕНТЫ
Видео - Эксперимент " Индикаторы в азотной кислоте"
Видео - Эксперимент "Действие азотной кислоты на белки"
Видео - Эксперимент "Действие азотной кислоты на бумагу и солому"
Видео - Эксперимент "Взаимодействие меди с азотной кислотой"
Видео - Эксперимент "Свойства азотной кислоты"
Видео - Эксперимент "Взаимодействие азотной кислоты с металлами"
Видео - Эксперимент "Взаимодействие безводной азотной кислоты с белым фосфором"
Видео - Эксперимент "Взаимодействие безводной азотной кислоты с углем"
Видео - Эксперимент "Взаимодействие безводной азотной кислоты со скипидаром"
|
|
|
Видео - Эксперимент "Окислительные свойства азотной кислоты"
Окислительные свойства концентрированной серной кислоты
Особые свойства концентрированной серной кислоты
а) концентрированная H2+6SO4 – сильный окислитель; при взаимодействии с металлами (кроме Au, Pt) может восстанавливаться до S+4O2, S0 или H2S-2 (без нагревания не реагируют также Fe, Al, Cr - пассивируются): 2Ag0 + 2H2+6SO4 → Ag2+1SO4 + S+4O2 + 2H2O
8Na0 + 5H2+6SO4 → 4Na2+1SO4 + H2S-2 + 4H2O б) концентрированная H2S+6O4 реагирует при нагревании с некоторыми неметаллами за счет своих сильных окислительных свойств, превращаясь в соединения серы более низкой степени окисления, (например, S+4O2): С0 + 2H2S+6O4(конц) → C+4O2 + 2S+4O2 + 2H2O S0 + 2H2S+6O4(конц) → 3S+4O2 + 2H2O 2P0 + 5H2S+6O4(конц) → 5S+4O2 + 2H3P+5O4 + 2H2O |
Дата добавления: 2020-04-25; просмотров: 175; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
