Работа расширения термодинамической системы
Работа А в термодинамике определяется изменением объема ∆V = V2 – V1 газа за счет его расширения (газ совершает работу) или сжатия (над газом совершается работа):
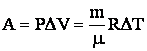
В. Количество теплоты Q – мера изменения внутренней энергии при теплопередаче, т.е. переходе энергии (теплоты) от более нагретых тел к менее нагретым.
Основными видами теплопередачи являются: теплопроводность, конвекция, излучение.
Изменение ΔQ пропорционально изменению температуры тела ΔТ:
ΔQ = C·ΔT
где C – теплоемкость тела.
Теплоемкость тела не универсальная постоянная для тела, а является функцией условий, при которых происходит нагревание (охлаждение) и зависит от свойств тела.
Теплоемкость единицы массы вещества называется удельной теплоемкостью Cуд:
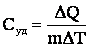 , откуда ΔQ = Суд·mΔT
, откуда ΔQ = Суд·mΔT
Внутренняя энергия U системы может изменяться двумя путями:
а) путем теплопередачи (Q);
б) путем совершения работы (системой или над системой А).
Уравнение, связывающее эти три величины
Q = ΔU + A
Удельная теплоемкость газов
Теплоемкость – это количество тепла, которое необходимо подвести к единице количества вещества, чтобы нагреть его на 10.
Различают теплоемкости:
· массовую (c, Дж/кг×К), отнесенную к одному килограмму газа;
· объемную (c ¢¢, Дж/м3×К), отнесенную к одному м3 объема при нормальных физических условиях;
· мольную (m с, Дж/кмоль×К), отнесенную к 1 киломолю газа,
|
|
|
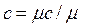 , , 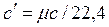 , , 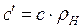 , ,
|
где r Н - плотность газа при нормальных физических условиях (p=760 мм рт. ст., t = 00 С).
Согласно определению теплоемкости 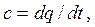
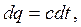
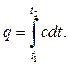
Теплоемкость реальных газов зависит от давления и от температуры 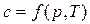 .
.
Теплоемкость идеальных газов (кроме одноатомного) зависит только от температуры 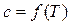 .
.
Теплоемкость одноатомного идеального газа постоянна (c = const).
Удельная энтальпия, как параметр идеального газа
Энтальпия h = u + Рv, как любой параметр состояния, может быть определена через любую пару независимых параметрами состояния. Выразим полный дифференциал энтальпии, используя при его определении в качестве независимых термических параметров Р и Т 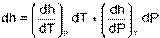
Для изобарного процесса при Р=const, используя первый закон термодинамики, получим выражение 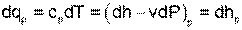
в соответствии с которым, изобарная теплоемкость определяется как 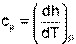
Применив уравнение (4.47) к (4.46) получим выражение для определения элементарного изменения энтальпии реальных веществ 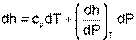
Для энтальпии идеального газа, подчиняющегося уравнению Pv=RT, будет выполняться равенство
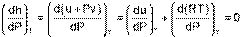
| (4.49) |
т.е. энтальпия идеальных газов не зависит от давления, а выражение (4.48) для идеальных газов примет вид 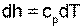
Поскольку изобарная теплоемкость идеальных газов величиа постоянная, то энтальпия идеальных газов есть функция только температуры. В свою очередь, для изобарной теплоемкости идеального газа не зависимо от процесса справедливо выражение 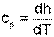
|
|
|
Абсолютное значение энтальпии можно получить интегрированием выражения (4.48). При этом, необходимо выбрать начало ее отсчета, приняв h0 при фиксированных параметрах газа РО и ТО. 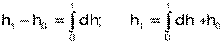
Необходимо помнить, что начало отсчета энтальпии и внутренней энергии связаны соотношением 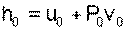
в соответствии с которым, приняв uО=0, получим hО = PОvО, т.е. начало отсчета энтальпии будет больше нуля.
При различных значениях РО и ТО будут различными и абсолютные значения энтальпии. Однако в расчетах процессов используется разница энтальпий, а не их абсолютные значения. Для разницы энтальпий процесса выбор параметров начала отсчета энтальпии никакой роли не играет 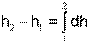
Прокомментируем расчет абсолютного значения энтальпии на примере идеального газа. Примем начало отсчета энтальпии идеального газа hО при 0 ОС. Приняв при 0 ОС uО=0, получим hО=uО+PОvО=RTО=273,15R, тогда абсолютное значение энтальпии вычисляется по формуле 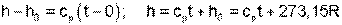
Приняв начало отсчета энтальпии и внутренней энергии идеального газа от абсолютного нуля ТО=0 К, и задав uО=0, получим hО=PОvО=RTО=0R=0, т.е. в данном случае численные значения начала отсчета внутренней энергии и энтальпии одинаковы и равны нулю. Расчетное выражение абсолютной энтальпии в этом случае будет представлено в виде 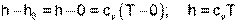
|
|
|
Абсолютные значения энтальпий и) при одинаковых температурах будут разные, но разница энтальпий в одинаковом интервале температур будет одинаковой 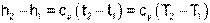
Таким образом, в расчетах абсолютного значения энтальпии основным требованием является необходимость выбора одинаковых параметров для принятия начала отсчета внутренней энергии и энтальпии. Для идеального газа начало отсчета энтальпии и внутренней энергии фиксируется только температурой.
При расчете разности энтальпий выбор параметров начала отсчета энтальпии никакой роли не играет. Поэтому, если сразу расчитывается разность энтальпий (выражение 4.55), то параметры начала отсчета энтальпии вообще не нужны, если разница энтальпий определяется через их абсолютные значения h2-h1, то они должны иметь одинаковые (любые) параметры начала их отсчета.
Энтропия идеальных газов
Для получения рассчетного выражения изменения энтропии идеальных газов воспользуемся первым законом термодинамики, в котором теплота определяется с использованием изменения энтальпии 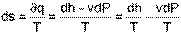
|
|
|
Для идеального газа изменение энтальпии определяется как dh=cPdT, а удельный объем v=RT/P. Подставив данные выражения изменения энталпии и удельного объема в уравнение (4.58), получим уравнение для изменения энтропии идеального газа 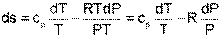
Разность энтропий идеального газа в конкретных двух состояниях можно получить интегрированием выражения (4.59) 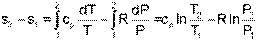
Воспользовавшись формулой Майера сР=сV+R и уравнением Менделеева-Клапейрона Pv=RT, выражение (4.60) можно записать и через две другие пары термических параметров состояния 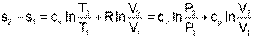
Для определения абсолюного значения энтропии идеального газа необходимо зафиксировать начало ее отсчета любой парой термических параметров состояния. Например, приняв s0=0 при Т0 и Р0, воспользовавшись уравнением (4.60), получим 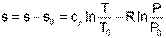
Выражение (4.62) свидетельствует о том, что энтропия идеального газа есть параметр состояния, поскольку ее можно определить через любую пару параметров состояния. В свою очередь, поскольку энтропия сама является параметром состояния, используя ее в паре с любым независимым параметром состояния, можно определить любой другой параметр состояния газа.
37. Формулировки второго закона термодинамики. Круговые процессы
Второй закон термодинамики определяет прежде всего, какие из процессов в рассматриваемой системе при заданной температуре, давлении, концентрации и пр. могут протекать самопроизвольно (т.е. без затраты работы извне), каково количество работы, которая может быть получена при этом, и каков предел возможного самопроизвольного течения процессов, т.е. каково состояние равновесия в данных условиях.
Второй закон дает возможность определить далее, какими должны быть условия, чтоб интересующий нас процесс мог происходить в нужном нам направлении и в требуемой степени. Для процессов, требующих затраты работы, с помощью второго закона можно определить количество работы, необходимой для проведения процесса, и зависимость этого количества от внешних условий.
Все это имеет очень большое значение как для исследования теоретических проблем естествознания, так и для решения различных задач прикладного характера в термодинамике.
В отличие от первого закона термодинамики, второй закон обладает более ограниченной областью применения. Он носит статистический характер и применим поэтому лишь к системам из большого числа частиц, т.е. таким, поведение которых может быть выражено законами статистики.
При однократном расширении рабочего тела можно получить ограниченное количество работы. Поэтому разомкнутый процесс непригоден для непрерывного превращения теплоты в работу. Для повторного получения работы необходимо возвратить рабочее тело в исходное состояние, то есть сжать рабочее тело. На сжатие рабочего тела должна быть затрачена работа. Эта работа подводится от какого-либо внешнего источника. Причём процесс сжатия рабочего тела должен осуществляться по пути, отличному от пути процесса расширения. В противном случае суммарная работа, полученная в результате кругового процесса, будет равна нулю. Поэтому путь процесса сжатия выбирается таким, чтобы работа сжатия по абсолютной величине была меньше работы расширения. На рис. 5.2 приведен круговой процесс, в котором рабочее тело расширяется по кривой 1-3-2. При этом работа расширения численно равна площади 132451. Процесс возвращения рабочего тела из конечного состояния 2 в начальное состояние 1 может осуществляться одним из следующих путей:
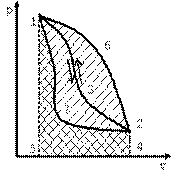
1. По кривой сжатия 2-3-1. При этом работа сжатия (площадь 231542) будет равна работе расширения (площадь 132451). В результате суммарная работа в таком круговом процессе равна нулю.
2. По кривой сжатия 2-6-1, расположенной над кривой расширения 1-3-2. При этом работа сжатия (площадь 261542) больше работы расширения (площадь 132451). Суммарная работа в таком круговом цикле будет отрицательной.
3. По кривой сжатия 2-7-1, расположенной ниже кривой расширения. В этом круговом процессе работа расширения (площадь 132451) больше работы сжатия (площадь 271542), а площадь, ограниченная замкнутой кривой 1-3-2-7-1, представляет собой работу цикла. Следовательно, чтобы работа была положительной, нужно, чтобы кривая сжатия 2-7-1 в pv-диаграмме была расположена ниже кривой расширения 1-3-2. Многократно повторяя такой круговой процесс, можно за счёт подвода теплоты получить любое количество работы.
Циклы, в которых теплота превращается в положительную работу, называются прямыми. Такие циклы в pv-диаграмме протекают по часовой стрелке. По прямым циклам работают тепловые двигатели.
Цикл, в котором получается отрицательная работа, называетсяобратным. В нём работа сжатия больше работы расширения. По обратным циклам работают холодильные машины.
Циклы могут быть обратимыми и необратимыми. Обратимым термодинамическим циклом называется цикл, все процессы которого обратимы. Необратимым термодинамическим циклом называется цикл, в котором хотя бы один из составляющих его процессов необратим.
38. Цикл Карно Любой тепловой двигатель может функционировать лишь при условии обмена теплом с двумя источниками различной температуры, причем газ (рабочее тело) получает тепло Q1 от источника с высокой температурой T1 (нагреватель) и отдает тепло Q2 источнику с низкой температурой T2 (холодильник). Передача тепла холодильнику необходима для того, чтобы привести газ, используемый в тепловых двигателях, в начальное состояние, т.к. для непрерывного действия теплового двигателя цикл должен быть замкнутым. Поэтому к.п.д. тепловых машин: n =(Q1 - Q2)/Q1 =1- Q2/Q1 всегда меньше единицы. Для идеального газа в цикле Карно процессы являются обратимыми (рис. 1.7.), и было показано, что Q1/Q2= T1/T2. Из этого следует, что Q1/T1= Q2/T2 или Q1/T1- Q2/T2 =0. В реальных тепловых машинах процессы являются необратимыми, и, чтобы привести газ в исходное состояние, необходимо передать холодильнику больше тепла, чем в идеальной тепловой машине. Коэффициент полезного действия реальных машин всегда меньше, чем для идеальных и Q1/T1 - Q2/T2 > 0.
39. Идеальный цикл тепловой машины. Обратный цикл Карно
КПД тепловой машины Карно
Количество теплоты, полученное рабочим телом от нагревателя при изотермическом расширении, равно
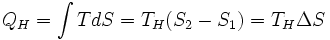 .
.
Аналогично, при изотермическом сжатии рабочее тело отдаёт холодильнику
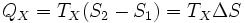 .
.
Отсюда коэффициент полезного действия тепловой машины Карно равен
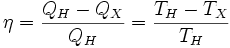 .
.
Первая и вторая теоремы Карно[править | править исходный текст]
Из последнего выражения следует, что КПД тепловой машины, работающей по циклу Карно, зависит только от температур нагревателя и холодильника, но не зависит ни от устройства машины, ни от вида или свойств её рабочего тела. Этот результат составляет содержание первой теоремы Карно[6]. Кроме того, из него следует, что КПД может составлять 100 % только в том случае, если температура холодильника равна абсолютному нулю. Это невозможно, но не из-за недостижимости абсолютного нуля (этот вопрос решается только третьим началом термодинамики, учитывать которое здесь нет необходимости), а из-за того, что такой цикл или нельзя замкнуть, или он вырождается в совокупность двух совпадающих адиабат и изотерм.
Поэтому максимальный КПД любой тепловой машины не может превосходить КПД тепловой машины Карно, работающей при тех же температурах нагревателя и холодильника. Это утверждение называется второй теоремой Карно[5]. Оно даёт верхний предел КПД любой тепловой машины и позволяет оценить отклонение реального КПД от максимального, то есть потери энергии вследствие неидеальности тепловых процессов.
Дата добавления: 2020-04-08; просмотров: 142; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
