Регуляция экспрессии генов у эукариот. Транскриптон. Дополнительно смотри презентацию на сайте ЮУГМУ.
Классификация генов: репрессированные, дерепрессированные, конститутивные, регулируемые
 |



1)репрессированные гены – это большая часть (90%) генов, находящаяся в неактивном состоянии;
Репрессия (repression) - Один из альтернативных механизмов регуляции действия генов, заключающийся в подавлении транскрипции или трансляции путем связывания белка-репрессора (кодируемого геном-регулятором) с оператором в ДНК либо специфическим участком мРНК.
2) дерепрессированные гены– около 10% генов, которые активно транскрибируются.
Среди дерепрессированной части генома различают:
а) конститутивные гены. Конститутивные гены постоянно находятся в активном состоянии. Их активность в малой степени зависти от состояния внешней среды (организма), т.е. практически не регулируется. Эти гены кодируют белки-ферменты, которые принимают участие в жизненно важных для клетки метаболических процессах. Например, таких как гликолиз. В сущности, эти гены полностью обеспечивают жизнедеятельность клетки.
Регуляция экспрессии генов у прокариот. Теория оперона.
В клетках прокариот процессы транскрипции и трансляции протекают почти одновременно, поэтому весьма сложно внести какие-либо изменения в структуру синтезированной РНК. Регуляция генной активности прокариот практически полностью осуществляется на уровне транскрипции. В 1961 г. французские ученые (будущие нобелевские лауреаты) Ф. Жакоб и Ж. Моно предложили модель оперона как системы регуляции экпрессии генов бактерий (Jacob F., Monod J., 1961). Важнейшей областью оперона (как и генов эукариот) является промотор – структура для «старта» процесса транскрипции, к которой присоединяется фермент РНК-полимераза. Помимо промотора Ф. Жакоб и Ж. Моно выделили в своей схеме и другие участки (рис. 6.5):
|
|
|
– оператор – участок присоединения белка-репрессора;
– терминатор – участок окончания синтеза генов оперона;
– ген-регулятор, кодирующий белок-репрессор. Ген-регулятор не входит в состав оперона. Он может быть с ним сцеплен, а может находиться на некотором расстоянии.
Белок-репрессор соединяется с оператором и блокирует транскрипцию, так как препятствует перемещению РНК-полимеразы. Весь оперон оказывается «выключен».
При наличии в среде индуктора (им часто служит какое-либо низкомолекулярное соединение) он взаимодействует с белком-репрессором, в результате чего репрессор не может присоединиться к оператору. Свободный оператор «открывает путь» РНК-полимеразе, и все геныоперона транскрибируются. При удалении индуктора репрессор вновь занимает место на операторе, и транскрипция прекращается.
|
|
|

Рис. 6.5. Структура оперона:
I – ген-регулятор; Р – промотор; О – участок-оператор; С1, С2, С3 – структурные гены оперона; Т – терминатор

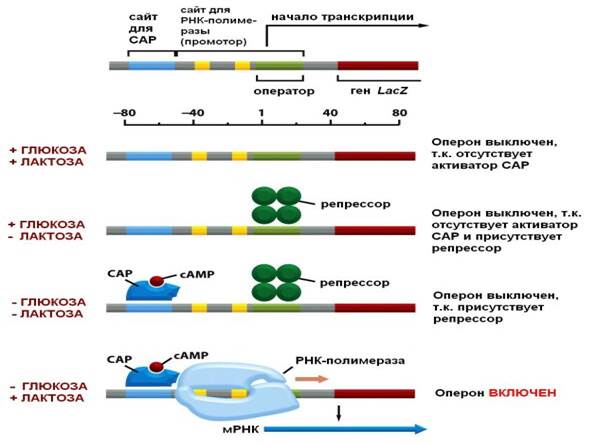
Такой механизм получил название негативной регуляции и впервые был исследован на лактозном опероне E. coli, где роль индуктора выполняет лактоза. При негативной регуляции гены транскрибируются, если они не выключены регуляторным белком (белком-репрессором).
Затем у бактерий был описан механизм позитивной регуляции. При этом способе структурные гены транскрибируются только в присутствии белка-активатора (апоиндуктора). Белок-активатор часто предварительно связывается с ц-АМФ.
Индукторы (обычно это используемые бактериями питательные вещества), белки-репрессоры и белки-активаторы находятся в отношениях обратной связи (положительной и отрицательной), формируя 4 варианта регуляции активности оперона (табл. 6.2).
Таблица 6.2. Регуляция активности оперонов прокариот

Один и тот же регуляторный белок может быть репрессором для гена А и активатором для гена В. С другой стороны, для активации некоторых оперонов необходимо два регуляторных белка, которые предварительно соединяются друг с другом.
Гены-регуляторы, синтезирующие белок-репрессор и белок-активатор, принципиально не отличаются от структурных генов, также обладая собственными промоторами и терминаторами.
|
|
|
Основным преимуществом оперонной регуляции для прокариот является синхронизация активности генов одного кластера. Выживаемость бактерий во многом зависит от их способности быстро переключать метаболизм с одного субстрата на другой. С эволюционной точки зрения скорость переключения для бактерий важнее тонкости регуляции.
Регуляция экспрессии генов у эукариот. Транскриптон. Дополнительно смотри презентацию на сайте ЮУГМУ.
Система регуляции экспрессии генов у эукариот связана с особенностями функционирования эукариотического генома. Хотя и у прокариот, и у эукариот функционируют системы регуляторных белков, наличие ядра и нуклеосомная организация хроматина эукариот дают намного больше возможностей для регуляции. Ядро явилось важнейшим эволюционным приобретением эукариот. Благодаря ядерной мембране, разделяются зоны транскрипции и трансляции, что позволяет осуществлять сложную и многообразную регуляцию экспрессии генов. Такая регуляция происходит на всех этапах.
Регуляция на уровне транскрипции. Основным уровнем регуляции экспрессии у эукариот является регуляция на уровне транскрипции. Варианты такой регуляции весьма разнообразны.
|
|
|
Наиболее универсальным методом регуляции транскрипции служит конденсация-деконденсация хроматина. Хорошо известно, что при активации генетического материала он деконденсируется. С другой стороны, далеко не весь эухроматин транскрибируется. Поэтому имеются и другие пути контроля транскрипции.
Для эукариот характерна дифференциальная экспрессия генов в разных клетках организма, поэтому многоклеточные организмы имеют разнообразные дифференцированные клетки. Хотя во всех клетках содержатся одинаковые гены, экспрессируются они не одинаково. Основное направление регуляции клеточной дифференцировки осуществляется при помощи тканеспецифических транскрипционных факторов. Они представляют собой белки регуляторных генов, контролирующие дифференциальную активность других генов.
Иным направлением является использование альтернативных промоторов. В разных типах клеток с одного гена могут быть образованы разные белки. Так, ген белка дистрофина содержит 7 промоторов, которые считывают информацию, начиная с разных экзонов.
Большое значение в регуляции экспрессии генов у эукариот придается фактору метилирования ДНК внутри регуляторных областей. Метилированию подвергается цитозин в составе ЦГ-динуклеотида, что обычно приводит к инактивации гена. Деметилирование ДНК восстанавливает активность. Этот важный процесс регулируют ферменты метилтрансферазы.
Частным случаем регуляции на уровне транскрипции является гормональная регуляция, при которой гены «включаются» в ответ на внешний сигнал. Сигнал запускает экспрессию только тех генов, которые имеют специфические последовательности ДНК в своих регуляторных областях.
Весьма загадочным способом регуляции является геномный импринтинг – дифференциальное проявление отцовских и материнских генов в организме. Геномыбудто бы «запоминают» свое происхождение. Механизм этого явления не установлен.
С данным явлением схожа инактивация Х-хромосомы в соматических клетках женского организма млекопитающих. Правда, одна из двух Х-хромосом в клетках плода инактивируется случайным образом, поэтому в разных клетках женского организма экспрессируются как отцовские, так и материнские Х-хромосомы.
На процессы «включения» и «выключения» генов, их конденсации и деконденсации ощутимое влияние оказывают различные хромосомные перестройки, МГЭ, изменяющие эффект положения гена.
Для эукариот не характерна регуляция по типу оперона. Большинство м-РНК эукариот – моноцистронные. Более того, гены, контролирующие один метаболический путь, у эукариот часто разбросаны по всему геному. Но в этом правиле есть исключение. Гены р-РНК и митохондрий транскрибируются на единую транскрипционную единицу, которая разрезается после процессинга. Считается, что такой способ позволяет унифицировать регуляцию схожих генов.
Регуляция на уровне процессинга. У эукариот транскрипция гена еще не означает его проявления в фенотипе. Молекулы РНК, синтезированные в ходе транскрипции, у эукариот подвергаются существенным модификациям. Совокупность таких преобразований и составляет сущность процессинга.
На уровне процессинга в первую очередь необходимо отметить механизм альтернативного сплайсинга, позволяющий изменять порядок сшивки экзонов. Таким образом, на основе одной и той же нуклеотидной последовательности одного гена формируются разные белки, состоящие из разных сочетаний одних и тех же аминокислотных блоков.
Феномен альтернативного сплайсинга изменил наши представления о природе гена. Его распространенность оказалась значительно выше, а роль в эволюции – важнее, чем предполагалось первоначально. Альтернативный сплайсинг характерен для более чем трети генов человека. Так, на гене белка тропонина, содержащего 18 экзонов, за счет альтернативного сплайсинга может образовываться 64 различных белковых продукта. В среднем один ген человека кодирует около трех белков (Тарантул В. З., 2003).
Другим интересным способом регуляции на уровне процессинга является тканеспецифическое редактирование РНК. Оно обнаружено у микроорганизмов, грибов, млекопитающих и проявляется заменой отдельных нуклеотидов в молекуле РНК при помощи специального ферментного комплекса. Если в случае замены вместо смыслового кодона образуется стоп-кодон, то в новой полипептидной цепи будут отсутствовать все аминокислоты, идущие после него. Получается белок с совершенно новыми свойствами.
В ооцитах некоторых животных происходит накопление и-РНК, у которых не закончен процессинг. Такие РНК не транслируются. Окончание процессинга и последующая экспрессия наступают только после оплодотворения.
Примерно половина гя-РНК полностью распадается в ядре, не выходя за его пределы. Возможно распаду подвержены такие транскрипты, которые не способны превратиться в зрелую и-РНК.
Регуляция на уровне трансляции. Механизмы регуляции экспрессии на уровне трансляции изучены недостаточно полно. Избирательная трансляция м-РНК осуществляется отбором определенных м-РНК путем блокировки доступа к рибосомам.
В случае избирательной стабилизации определенных типов м-РНК в цитоплазме, они не подвергаются распаду после трансляции. Наглядным примером дифференциальной стабильности м-РНК может служить синтез белков глобинов на стабильных м-РНК безъядерных ретикулоцитов млекопитающих. Мутации, блокирующие полиаденилирование, наоборот, приводят к образованию очень нестабильных транскриптов. Обнаружены и другие механизмы, регулирующие стабильность м-РНК.
Регуляция на уровне посттрансляционной модификации белка. Посттрансляционная модификация полипептида и превращение его в функционально активную молекулу белка завершает процесс реализации генетической информации. Она представляет собой различные модификации определенных аминокислот (фосфорилирование, ацетилирование), удаление некоторых из них, и на этой основе формирование вторичной, третичной, четвертичной структуры белка. На посттрансляционном уровне также возможна регуляция экспрессии. Широко распространен механизм регуляции активности ферментов, основанный на присоединении молекул-эффекторов, в роли которых часто выступают конечные продукты биосинтеза.
В последние годы в геномах разных животных были обнаружены многочисленные РНК, выполняющие регуляторные функции. Они получили название риборегуляторов. Особое значение имеют короткие двунитиевые микро-РНК. Их способность ослаблять работу отдельных генов получила название РНК-интерференции.
Проблема регуляции экспрессии генов приводит к вопросу о координации этой регуляции: каким образом в каждой клетке происходит активация именно необходимой комбинации генов, определяющих ее фенотип? Для млекопитающих (в том числе и для человека) установлено наличие большого числа факторов регуляции надклеточного уровня, включая факторы нервной и эндокринной систем.
Дата добавления: 2019-11-16; просмотров: 4045; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
