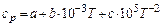Классификация дисперсных систем по степени дисперсности
Вариант 38
Контрольная работа № 1
Задание 18

49In
Электронная формула:
1s22s22p63s23p63d104s24p64d105s25p1
Электронно-графическая формула:
| ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ |
1s2 2s2 2p 6 3s2 3p6 3d10
| ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ |
4s2 4p6 4d10
| ↓↑ | ↑ |
5s2 5p1
Валентность равна I в основном состоянии
49In*
Электронная формула:
1s22s22p63s23p63d104s24p64d105s25p1
Электронно-графическая формула:
| ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ |
1s2 2s2 2p 6 3s2 3p6 3d10
| ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ |
4s2 4p6 4d10
|
|
|
| ↑ | ↑ | ↑ |
5s1 5p2
32Ge
Электронная формула:
1s22s22p63s23p63d104s24p2
Электронно-графическая формула:
| ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ |
1s2 2s2 2p 6 3s2 3p6 3d10
| ↓↑ | ↑ | ↑ |
4s2 4p 2
Валентные электроны 4s24p2,
Валентность равна II в основном состоянии
32Ge*
Электронная формула:
1s22s22p63s23p63d104s14p3
Электронно-графическая формула:
| ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ |
1s2 2s2 2p 6 3s2 3p6 3d10
| ↑ | ↑ | ↑ | ↑ |
4s1 4p 3
|
|
|
Валентность равна IV в возбужденном состоянии
22Ti
Электронная формула:
1s22s22p63s23p63d24s2
Электронно-графическая формула:
| ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↑ | ↑ |
1s2 2s2 2p 6 3s2 3p6 3d2
| ↓↑ |
4s2
Валентность равна II в основном состоянии
22Ti*
Электронно-графическая формула:
| ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↑ | ↑ |
1s2 2s2 2p 6 3s2 3p6 3d2
| ↑ | ↑ |
4s1 4p1
Валентность равна IV в возбужденном состоянии

H2CO3 – CO2
H3AsO4 – As2O5
HPO3 – P2O5
H2SeO4 – SeO3
HBrO3 – Br2O5

Дигидрофосфат кальция – Сa(H2PO4)2
|
|
|
Гидросульфид железа (III) - Fe(HS)3
Сульфат гидроксоалюминия – AlOHSO4
Сульфат бария BaSO4
Молибдат натрия – Na2MoO4
Пирофосфат алюминия Al2(P2O7)3
Бихромат калия K2Cr2O7
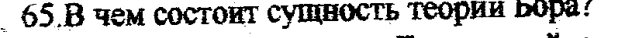
Бор разработал планетарную модель строения атома. Ее сущность:
1 Электрон двигается вокруг атома по орбитам, которым соответствует определенная энергия Е
2. Излучение энергии происходит при переходе электрона с орбиты на орбиту
Энергия излученного кванта равна разности энергий орбит

А)
Сl-Be-Cl
Б) O=O
В) O-N=O

NaI ∆ЭО=ЭО(I)-ЭО(Na)=2,7-0,9=1,8<2 ковалентная полярная связь
SO2 ∆ЭО=ЭО(O)-ЭО(S)=3,5-2,5=1,0<2 ковалентная полярная связь
KF ∆ЭО=ЭО(F)-ЭО(K)=4,0-0,8=3,2>2 ионная связь
СO2 ∆ЭО=ЭО(O)-ЭО(S)=3,5-2,5=1,0<2 ковалентная полярная связь
В общем случае образования ковалентной связи электронная пара сдвинута к более электроотрицательному атому. Ионная связь — крайний случай поляризации ковалентной полярной связи. Образуется между типичными металлом и неметаллом. При этом электроны у металла полностью переходят к неметаллу. Образуются ионы.
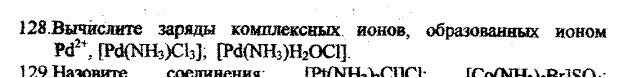
[Pd(NH3)Cl3]- Z=+2+0-3= - 1
[Pd(NH3)H2OCl]+ Z=+2+0+0-1= + 1

Fe3O4 + CO = 3FeO + CO2
Выполнение
1. Исходные данные для расчета записываем в таблицу 2.
|
|
|
Таблица 2. Исходные данные для расчета
| Реагенты реакции |
___кДж_ г-моль |
___Дж__ г-моль·К |
| ||

| 
| 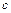
| |||
| Fe3O4 | -1117,71 | 151,46 | 167,03 | 78,91 | -41,82 |
| CO | -110,5 | 197,4 | 28,41 | 4,10 | -0,46 |
| FeO | -269,42 | 56,15 | 51,87 | 6,79 | -1,59 |
| CO2 | -393,51 | 213,6 | 44,14 | 9,04 | -8,53 |
2 Определим тепловой эффект реакции при 298К:

Так как 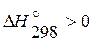 , при 298 К реакция эндотермическая (идет с поглощением теплоты).
, при 298 К реакция эндотермическая (идет с поглощением теплоты).
3 Определим приращение энтропии процесса:

4 Рассчитаем приращение изобарно-изотермического потенциала:
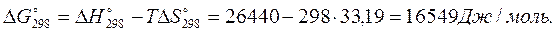
Так как 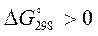 , при 298 К реакция имеет тенденцию к развитию в обратном направлении.
, при 298 К реакция имеет тенденцию к развитию в обратном направлении.

Направление смещения химического равновесия определяется с помощью принципа Ле-Шателье: «Если на систему, находящуюся в состоянии химического равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию одного или нескольких веществ, участвующих в реакции), то это приведет к увеличению скорости той реакции, протекание которой будет компенсировать (уменьшать) оказанное воздействие».
А) при увеличении концентрации SnCl2 равновесие сместится вправо
А) при увеличении концентрации SnCl4 равновесие сместится влево
Химическое равновесие называют динамическим равновесием. Этим подчеркивается, что при равновесии протекают и прямая, и обратная реакции, но нх скорости одинаковы, вследствие чего изменений в системе не заметно.

Направление смещения химического равновесия определяется с помощью принципа Ле-Шателье: «Если на систему, находящуюся в состоянии химического равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию одного или нескольких веществ, участвующих в реакции), то это приведет к увеличению скорости той реакции, протекание которой будет компенсировать (уменьшать) оказанное воздействие».
При увеличении температуры (т.е. при нагревании системы) равновесие смещается в сторону протекания эндотермической реакции, а при ее уменьшении (т.е. при охлаждении системы) – в сторону протекания экзотермической реакции. (Если прямая реакция является экзотермической, то обратная обязательно будет эндотермической, и наоборот).
Давление влияет на равновесие реакций, в которых принимают участие газы. Если внешнее давление повышается, то равновесие смещается в сторону той реакции, при протекании которой число молекул газа уменьшается (соответственно давление в системе уменьшается) согласно принципу Ле-Шателье.
6HF + N2 = 2NF3 + 3H2 ∆H>0
При понижении температуры равновесие сместится в сторону эндотермической реакции - вправо. При понижении давления равновесие сместится в сторону увеличения числа молекул – влево. Выход продуктов не увеличится.
I2 + 5CO2 = I2O + 5CO ∆H>0
При понижении температуры равновесие сместится в сторону эндотермической реакции - вправо. При понижении давления равновесие не изменится, так как число газовых молекул не изменяется. Выход продуктов увеличится.
С2 + 2O2 = 2CO2 ∆H<0
При понижении температуры равновесие сместится в сторону эндотермической реакции - влево. При понижении давления равновесие сместится в сторону увеличения числа молекул – влево. Выход продуктов не увеличится.

Масса раствора равна mр-ра=V р-раρр-ра
mр-ра=1000∙1,05=1050 г
Масса растворенного вещества равна mр.в.=mр-ра*ω/100
mр.в.=1050*10,17/100=106,79 г
106,79 г - 20,01 %
Х г - 100 % х=533,66 г
Объем раствора равен: Vр-ра=m/ρ
Vр-ра=533,66/1,1=485,14 cм3
Контрольная работа № 2

Ca(OH)2 + H2S = CaS + 2H2O
Ca2+ + 2OH- + H2S = Ca2+ + S2- + 2H2O
2OH- + H2S = S2- + 2H2O
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
2Na+ + CO3 2- + 2H+ + 2Cl- = 2Na+ + 2Cl- + CO2 + H2O
CO3 2- + 2H+ = CO2 + H2O

CaSO4 ПР = [Ca2+][SO42-]
As2S3 ПР=[As3+]3[S2-]3
AgCl ПР=[Ag+][Cl-]
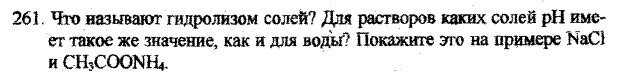
Под гидролизом солей понимают реакцию между ионами соли и ионами воды, в результате которой образуется кислота (или кислая соль) и основания (или основная соль). Гидролиз обусловлен взаимной электролитической диссоциацией солей и воды, а также образующихся в результате гидролиза кислот, оснований и солей. Гидролиз протекает с образованием малодиссоциирующих, летучих или малорастворимых веществ и избытком водородных или гидроксидных ионов. Таким образом, растворы различных солей имеют или кислую, или щелочную реакцию
NaCl гидролизу не подвергается, т.к. в составе нет «слабого иона»:
NaCl ↔ Na+ + Cl—.
Характер среды водного раствора – нейтральный.
СН3СООNH4 – соль слабой кислоты и слабого основания, гидролизуется по катиону и аниону
СН3СОО NH4 + H2O = CH3COOH + NH4OH
СН3СОО- + NH4+ + H2O = CH3COOH + NH4OH
Характер среды водного раствора – нейтральный.

Моляльность раствора равна:

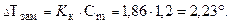 Понижение температуры замерзания равно:
Понижение температуры замерзания равно:
Тзам=ТзамH2O-∆T=0-2,23= - 2,23 ◦C
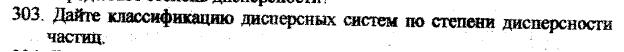
Классификация дисперсных систем по степени дисперсности
Свободнодисперсные :
1) ультрамикрогетерогенные (истинно-коллоидные) 10 –7 - 10 -5см (от 1 до 100 мкм) –– (т/т);
2) микрогетерогенные 10 –5 - 10 -3см. (от 0,1 до 10 мкм) т/ж, ж/ж, г/ж, т/г.
3) грубодисперсные >10 -3см; т/г.
Связнодисперсные системы:
1) микропористые: поры до 2 мм;
2) переходнопористые: от 2 до 200 мм;
3) макропористые: выше 200 мм.
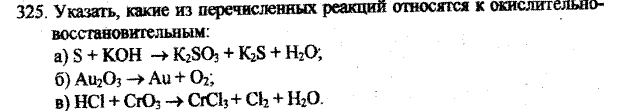
a) 3S0 + 6KOH = K2S+4O3 + 2K2S-2 + 3H2O - ОВР
S0 – 4 e = S+4│1 восстановитель
S0 +2 e = S-2 │2 окислитель
Б) 2Au2O3 = 4Au + 3O2- ОВР
Au+3 + 3e = Au0│4 окислитель
2O-2 – 4e = O2│3 восстановитель
В) 12HCl-1 + 2Cr+6O3 = 2Cr+3Cl3 + 3Cl20 + 6H2O- ОВР
2Cl-1 - 2e = Cl20│3 восстановитель
Сr+6 + 3e = Cr+3│2 окислитель

Выполнение
Схема гальванического элемента, в котором никель является катодом:
(-) Mg│Mg(NO3)2 (0,01 M)││Ni(NO3)2 (0,01 M)│Ni (+)
На электродах происходят процессы:
(–) А: Mg– 2e- = Mg2+;
(+) K: Ni2+ + 2e- = Ni.
Схема гальванического элемента, в котором никель является анодом:
(-) Ni│Ni(NO3)2 (0,01 M)││Cu(NO3)2 (0,01 M)│Cu (+)
На электродах происходят процессы:
(–) А: Ni– 2e- = Ni2+;
(+) K: Cu2+ + 2e- = Cu.

Решение
Электродные потенциалы металлов равны: E◦(Ni2+/Ni)=-0,250 В
E◦(Fe2+/Fe)=-0,440 В.
E◦( Fe2+/Fe)< E◦( Ni2+/Ni), поэтому железо будет анодом, никель – катодом.
Никелевое покрытие – катодное.
При коррозии во влажном воздухе происходят процессы:
Анодный процесс: Fe - 2e = Fe2+│2
Катодный процесс: O2 + 2H2O + 4e = 4 OH-│1
Суммарное уравнение: 2Fe + O2 + 2H2O =2Fe(OH)2
4Fe(OH)2+ O2 + 2H2O =4Fe(OH)3
Продукт коррозии - Fe(OH)3

В ряду Cr(OH)2 → Cr(OH)3 → H2CrO4 основные свойства ослабляются, кислотные свойства усиливаются
Cr(OH)2 – основание
Cr(OH)2 + 2HCl = CrCl2 + 2H2O
Cr(OH)3 – амфотерный гидроксид
Cr(OH)3 + 3HCl = CrCl3 + 3H2O
Cr(OH)3 + 3NaOH= Na3[Cr(OH)6 ]
H2CrO4 - кислота
H2CrO4 + 2KOH = K2CrO4 +2H2O

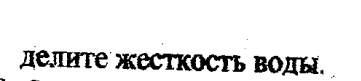
Полное обессоливание проводится следующими способами:
Дистилляция, термический способ.
Методом ионного обмена.
Методом электродиализа.
Мембранным обратным осмосом.
Частичное удаление соли достигается при применении таких способов: Известкование.
Баритовое умягчение.
Н-катионирование.
Вымораживание.
Дистилляция воды Обессоливание воды с помощью метода дистилляции - самый старый и распространенный на сегодняшний день способ. Плюсом является его всеобщая доступность, а минусом – дороговизна процесса. Для получения воды без примесей используют дистилляторы. Они представляют собой испарители нескольких типов, разница между которыми состоит в конструкции, виде используемой энергии. Наиболее распространенные – паровые и электрические аппараты, отличающиеся дороговизной и большим потреблением энергоресурсов. Аппарат представляет собой котел (или несколько котлов) низкого давления, где жидкость превращается в пар и отделяет концентрат солей. Чтобы вода получила максимальную очистку, в аппарате достигается температура медленного кипения. При таком режиме тяжелые примеси не попадают в конденсирующийся дистиллят. Одним из вариантов уменьшения стоимости является увеличение количества ступеней, но такая установка влечет крупные первоначальные инвестиции. Оборудование для дистилляции помимо потребления большого количества энергии обладает внушительной стоимостью всех частей. Обеспечить высокую степень чистоты могут дорогостоящие трубы, арматура, теплообменники, испарители, сделанные из кварца или платины.
Электрохимический метод Суть метода заключается в пропуске воды через электрическое поле, при этом происходит перенос ионов солей – катионы распределяются в сторону катода, а анионы - к аноду. Система имеет три отсека, которые образуются при помощи катодной и анодной диафрагм. В срединном отсеке находится вода, подготовленная к обессоливанию. Через поток пропускают постоянный электрический ток, при помощи которого происходит сортировка солей на катодную и анодную диафрагмы. Метод является очень дорогостоящим по затратам на оборудование и издержкам на электроэнергию, в связи с чем не получил распространения.
Ионный обмен Наиболее надежный способ, которым достигается обессоливание воды, – метод ионного обмена. Осаживание примесей таким способом позволяет получить более чистую жидкость за короткий срок, что важно при промышленном обессоливании. Способ является наиболее экономически выгодным и дает лучший результат очистки. Метод основывается на удалении из жидкости катионов и анионов солей, в результате очистки можно достичь разной степени деминерализации, вплоть до полного удаления солевых агентов. Обессоливание воды ионным обменом происходит при участии ионитов, которые представляют собой нерастворимые в воде полимеры, содержащие подвижный ион. При созданных условиях подготовленный полимер вступает в реакцию обмена с ионами солей того же знака. Помещенные в водную среду иониты набухают, увеличиваясь в размере в 1,5-2 раза. По мере прохождения времени иониты собирают растворенные в воде соли и уплотняются. Насыщенные иониты регенерируют, после чего проводят их очистку. Продукты, полученные из насыщенных ионитов, называются "элюаты", в их состав входят растворы солей и щелочей. Часть из них являются ценными веществами, поэтому их утилизируют как ценные компоненты.
Обратный осмос Технический прогресс и начавшая наблюдаться нехватка пресной воды рождают новые технологии опреснения и обессоливания. Популярным способом становится метод обработки обратным осмосом, надежность ему гарантирует развитие мембранных технологий. Промышленный интерес вызван сравнительно низкими энергозатратами. Большая часть аппаратов этого принципа используются для доочистки речной воды, где их эффективность многократно доказана.
Для бытового использования установки для обессоливания воды, основанные на принципе обратного осмоса, пригодны как в плане энергозатрат, так и по качеству получаемого продукта. В основе принципа обратного осмоса лежит пропускание воды под давлением через мембрану, которая непроницаема для растворенных солей и других примесей. Процесс обессоливания воды обеспечивают синтетические полупроницаемые мембраны, которые не могут задержать некоторые растворенные в воде газы (хлор, углекислота и пр.). Метод обратного осмоса очищает воду от всех примесей, происходит полная деминерализация, что вредно для человеческого организма. В большинстве случаев обывателю приходится выбирать между водопроводной водой или обработанной при помощи какого-либо фильтра. Меньшим злом является вода, лишенная всех природных компонентов.
Задача. Число молей эквивалентов Na2CO3 равно n=m/Mэ=424/53=8 моль
M(Na2CO3)=106 г/моль
Mэ(Na2CO3)=106/2=53 г/моль
Жесткость равна числу молей эквивалентов Na2CO3 , отнесенных к объему воды, по закону эквивалентов
Ж=n*1000/V=8*1000/1000 = 8 мэкв/л

В зависимости от химического состава и условий твердения известь подразделяют на воздушную, твердеющую в воздушно-сухих условиях, и гидравлическую, которая рая твердеет на воздухе и в воде.
Воздушную известь получают обжигом главным образом известняка с малым содержанием глины (до 8%) при 1100-1300 °С в шахтных или вращающихся обжиговых печах. При этом карбонаты, входящие в состав породы, разлагаются, например:
СаСО3 = СаО + СО2.
В зависимости от содержания в породе MgO различают следующие виды извести: кальциевую (содержит до 5% по массе MgO), магнезиальную (5-20%) и доломитовую (20-40%). В зависимости от способа обработки обожженного продукта получают негашеную комовую (кипелка), негашеную молотую и гашеную (гидратную) известь, или пушонку, а также известковое тесто. Первая представляет собой смесь кусков различной величины, образующихся после грубого помола продукта обжига. По химическому составу она состоит из СаО и MgO с небольшой примесью неразложившегося при обжиге СаСО3, а также из силикатов, алюминатов и ферратов Са. Негашеная молотая известь - продукт тонкого помола комовой извести. Гашеная известь - высокодисперсный сухой порошок, получаемый при взаимодействии комовой или молотой негашеной извести с небольшим количеством воды или пара (гашением); состоит преимущественно из Са(ОН)2 и Mg(OH)2 с примесью СаСО3. При гашении извести большим кол-вом воды образуется пластичная тестообразная масса, так называемое известковое тесто. Активность воздушной извести как вяжущего материала определяется общим содержанием оксидов Са и Mg. Наибольшей активностью обладает кальциевая известь, содержащая 93-97% оксидов. Высококачественного сорта известь ("жирная известь") характеризуются большим выходом известкового теста (больше 3,5 л на 1 кг негашеной И.); чем выше выход теста, тем оно пластичнее и может принять большее количество песка при приготовлении строительных растворов. Известь с низким выходом известкового теста называется "тощей".
По скорости гашения различают быстрогасящуюся (длительность процесса не более 8 мин), среднегасящуюся (не более 25 мин) и медленногасящуюся известь (более 25 мин). За скорость гашения принимается время от момента смешивания порошка извести с водой до момента достижения максимальной температуры смеси. Твердение воздушной извести происходит в результате испарения воды и кристаллизации Са(ОН)2 из насышенного водного раствора, а также при взаимодействии с СО2 воздуха с образованием кристаллов СаСО3. Воздушную известь применяют для изготовления вяжущих строительных растворов, предназначенных для наземной кладки кирпича, искусственных камней и штукатурки, а также при получении известково-шлаковых, известково-пуццолановых и др. смешанных вяжущих (см. Цементы). В смеси с красителями известь используется в качестве декоративного материала.
Гидравлическая известь - тонкомолотый порошок, получаемый обжигом при 900-1100 °С мергелистых известняков, содержащих 6-20% глинистых и тонкодисперсных песчаных примесей. Образующиеся при этом силикаты (2СаО*SiO2), алюминаты (СаО*Аl2О3*5СаО + 3Аl2О3) и ферраты (2CaO*Fe2O3) кальция придают этой извести способность длительно сохранять прочность в воде после предварительного твердения на воздухе. По содержанию свободных оксидов Са и Mg гидравлическую известь подразделяют на слабогидравлическую (15-60% оксидов) и сильногидравлическую (1-15%).
Гидравлическая известь, в отличие от воздушной, характеризуется большей прочностью при меньшей пластичности. Гидравлическую известь используют для изготовления штукатурных и кладочных растворов, пригодных для эксплуатации в сухих и влажных средах, легких и тяжелых бетонов низких марок, фундаментов и сооружений, подвергающихся действию воды.
Твердение гидравлической извести вызывается процессами гидратации силикатов и алюминатов кальция (эти соединения обусловливают гидравлические свойства вяжущего вещества)
При твердении гидравлической извести происходят процессы, характерные как для воздушного, так и гидравлического твердения. Первые обусловливаются твердением гидрата оксида кальция или оксида кальция аналогично воздушной извести. Вторые процессы вызываются твердением силикатов, алюминатов и ферритов кальция, в результате их взаимодействия с водой появляются гидросиликаты, гидроалюминаты, гидроферриты кальция.
Список использованной литературы
1. Коровин Н.В. Общая химия. – М.: Высшая школа, 2009. – 557 с.
2. Глинка Н.Л. Общая химия: учеб. пособие для вузов / Под ред.
А.И. Ермакова. – М.: Интеграл – Пресс, 2013. – 728 с.
3. Химия: учеб. пособие для вузов / Под ред. проф. В.В. Денисова. – М.: Ростов н/Д: Издат. центр «Март», 2008. – 358 с.
4. Глинка Н.Л. Задачи и упражнения по общей химии: учеб. пособие. - изд. стер. - М. : КНОРУС, 2012. - 240 с.
Дата добавления: 2020-01-07; просмотров: 117; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

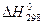 ,
,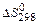 ,
,