Напишите уравнения электродных процессов, происходящих при коррозии сплава железа и меди во влажном воздухе.
Вариант 58
19.
1. Для атомов элементов, порядковые номера которых указаны в табл.1 укажите состав ядер (число протонов и нейтронов), составьте электронные формулы атомов. Укажите валентные электроны, распределите их по квантовым ячейкам в стационарном и возбуждённом состояниях, определите значения спиновой валентности. К какому электронному семейству принадлежит каждый элемент?
2. Исходя из положения элементов в периодической системе элементов Менделеева, выбранных в соответствии с шифром (см. табл.1), охарактеризуйте их свойства. Является ли каждый из них металлом или неметаллом, окислителем или восстановителем? Каковы высшая и низшая степени окисления их атомов? Составьте формулы оксидов и гидроксидов, отвечающих их высшей степени окисления? Какими кислотно-основными свойствами обладают эти соединения? Приведите уравнения соответствующих реакций. Образуют ли данные элементы водородные соединения? Сравните свойства соединений данного элемента со свойствами аналогичных соединений элементов той же подгруппы периодической системы.
19 40, 50
Решение
40Zr
Число протонов равно заряду ядра 40, число нейтронов равно разности атомной массы и числа протонов, т.е. 91-40=51
Электронная формула:
1s22s22p63s23p63d104s24p64d25s2
Электронно-графическая формула:
| ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ |
1s2 2s2 2p 6 3s2 3p6 3d10
|
|
|
| ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↑ | ↑ |
4s2 4p 6 4d2
| ↓↑ |
5s2
Валентные электроны 4d25s2,
Спиновая валентность равна 2 в основном состоянии.
40Zr*
| ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ |
1s2 2s2 2p 6 3s2 3p6 3d10
| ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↑ | ↑ |
4s2 4p 6 4d2
| ↑ | ↑ |
5s21 5p 1
|
|
|
Валентные электроны 4d25s15p 1,
Спиновая валентность равна 4 в возбужденном состоянии.
Цирконий относится к d-семейству.
Цирконий является металлом. Для него характерны восстановительные свойства. Низшая степень окисления – 0. Высшая - +4. Наиболее устойчивая степень окисления +4
ZrO2 - степень окисления циркония +4, амфотерный оксид, , поэтому взаимодействует с кислотами и щелочами:
ZrO2 +2H2SO4= Zr(SO4)2+ 2H2O
ZrO2 +2NaOH= Na2ZrO3+ H2O
Цирконий не образует водородное соединение
По сравнению с другими элементами IVB группы (Ti, Hf) cоединения циркония имеют промежуточные свойства. Его оксид и гидроксид более основные, по сравнению с соединениями титана, но менее основные по сравнению с соединениями гафния.
50Sn
Число протонов равно заряду ядра 50, число нейтронов равно разности атомной массы и числа протонов, т.е. 119-50=69
Электронная формула:
1s22s22p63s23p63d104s24p64d105s25p2
Электронно-графическая формула:
| ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ |
1s2 2s2 2p 6 3s2 3p6 3d10
|
|
|
| ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ |
4s2 4p6 4d10
| ↓↑ | ↑ | ↑ |
5s2 5p2
Валентные электроны - 5s25p2
Спиновая валентность равна 2 в основном состоянии. Олово относится к
p-семейству.
Возбужденное состояние олова:
Sn*
| ↑ | ↑ | ↑ | ↑ |
5s 5p
Спиновая валентность равна 4
Олово является металлом. Для него характерны восстановительные свойства. Низшая степень окисления – 0. Высшая - +4. Наиболее устойчивая степень окисления +4
SnO2 - степень окисления циркония +4, амфотерный оксид, , поэтому взаимодействует с кислотами и щелочами:
SnO2 +2H2SO4= Sn(SO4)2+ 2H2O
SnO2 +2NaOH= Na2SnO3+ H2O
Цирконий не образует водородное соединение
По сравнению с другими элементами IVА группы (C, Ge , Pb) cоединения олова имеют промежуточные свойства. Его оксид и гидроксид более основные, по сравнению с соединениями германия, но менее основные по сравнению с соединениями свинца.
|
|
|
21. Принимая во внимание значение относительных электроотрицательностей (приложение 1), определите, какой тип химической связи (ковалентная неполярная, ковалентная полярная или ионная) имеет место в указанных соединениях (табл. 3). В случае ковалентной полярной или ионной связи укажите направление смещения электронов. В случае ковалентной связи постройте электронные схемы молекул, схемы перекрывания электронных орбиталей и определите геометрическую форму молекулы.
21 CaCl2, H2O
Решение
CaCl2
∆ЭО = ЭO(Cl)-ЭО(Ca)
∆ЭО =3,0-1,0=2,0 - ионная связь, электронная плотность смещена к хлору
H2O
∆ЭО = ЭO(O)-ЭО(H)
∆ЭО =3,5-2,1=1,4<2 ковалентная полярная связь, электронная плотность смещена к кислороду
O 2s22p4
| ↓↑ | ↓↑ | ↑ | ↑ |
В=2
H 1s1
| ↑ |
В=1
H∙ + ∙O∙ + ∙H → H:O:H H−O−H

Угловая молекула
43. Используя данные приложения 2, вычислить стандартные изменения энтальпии ( D H ), энтропии ( D S ) и свободной энергии Гиббса ( D G ) для химических реакций, уравнения которых указаны ниже. Объясните характер изменения энтальпии (экзо- или эндотермическая реакция; выделяется или поглощается теплота) и энтропии ( D S > 0, D S < 0, D S = 0). Возможна ли данная реакция при стандартных условиях ? При какой температуре она начинается?
43. Cu2S( т ) + 2O2( г ) = 2CuO( т ) + SO2( г )
Решение
Определим тепловой эффект реакции при 298К:
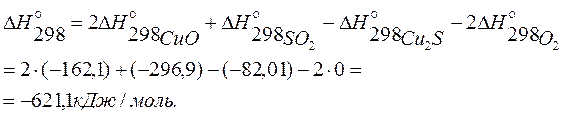
Так как 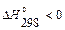 , при 298 К реакция экзотермическая (идет с выделением теплоты).
, при 298 К реакция экзотермическая (идет с выделением теплоты).
Определим приращение энтропии процесса:
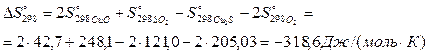
4 Рассчитаем приращение изобарно-изотермического потенциала:
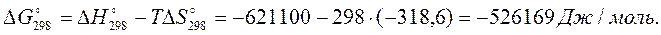
Так как 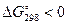 , при 298 К реакция имеет тенденцию к развитию в прямом направлении.
, при 298 К реакция имеет тенденцию к развитию в прямом направлении.
Определим температуру равновесного состояния:
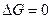
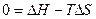
Т=∆H/∆S
Т=(-621100)/(-318,6)=1949 К
Реакция возможна при температуре < 1949 К
Задачи 61 - 80
Составьте выражения для скоростей прямой, обратной реакций (уравнение реакции то же, что в предыдущей задаче), константы равновесия. Вычислите, во сколько раз изменится скорость прямой реакции при заданном изменении температуры, концентрации и давлении (табл. 4). Как необходимо изменить внешние условия (температуру, давление, концентрации веществ) для смещения равновесия слева направо?
| Номер задачи | 61 62 63 64 65 66 67 68 69 70 |
| Уравнение в задании темы 3 | 41 42 43 44 45 46 47 48 49 50 |
          Темп.коэф-иент
t1
t2
n1 (концентрация
1-ого компонента увеличилась в n1 раз)
n2 (концентрация
2-ого компонента
увеличилась в n2 раз)
m (давление уве-
личилось в m раз) Темп.коэф-иент
t1
t2
n1 (концентрация
1-ого компонента увеличилась в n1 раз)
n2 (концентрация
2-ого компонента
увеличилась в n2 раз)
m (давление уве-
личилось в m раз)
| 2 3 3 2 2 3 2 2 4 2 110 90 100 20 30 40 80 130 90 90 120 110 130 50 70 90 70 140 100 100 3 3 4 5 6 7 2 4 8 3 8 8 4 5 1 100 1 5 6 15 2 3 2 10 2 3 2 3 2 10 |
Решение
1) Vпр= kпр [O2]2 Vобр= kобр[SO2]
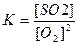
2) Согласно правилу Вант-Гоффа: при повышении температуры на 10 ◦С скорость большинства химических реакций увеличивается в 2-4 раза. Это правило математически выражается следующей формулой:
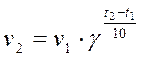
Подставим значения:
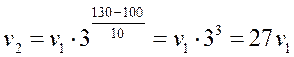
Отношение скоростей до и после изменения температуры равно:
v2/v1=27
Ответ: скорость реакции увеличится в 27 раз
3) Пусть y – концентрация O2. Тогда скорость реакции равна:
v=ky2
Тогда концентрация O2 станет равной 4у моль/л.
Скорость реакции после изменения концентраций станет равной:
v’=k∙(4y)2=16 ky2
Отношение скоростей равно: v’/v=16 ky2/ ky2=16
Ответ: скорость прямой реакции увеличится в 16 раз
4) Давление прямо пропорционально концентрации вещества согласно уравнению Менделеева-Клапейрона.
Тогда при увеличении давления в 2 раза концентрация газа увеличится в 2 раза. Концентрация O2 станет равной 2у моль/л.
Скорость реакции после увеличения давления станет равной:
v’=k∙(2y)2=4 kу2
Отношение скоростей равно: v’/v=4 kу2/ kу2 = 4
Ответ: скорость прямой реакции увеличится в 4 раза
5) Направление смещения химического равновесия определяется с помощью принципа Ле-Шателье: «Если на систему, находящуюся в состоянии химического равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию одного или нескольких веществ, участвующих в реакции), то это приведет к увеличению скорости той реакции, протекание которой будет компенсировать (уменьшать) оказанное воздействие».
Например, при увеличении концентрации исходных веществ возрастает скорость прямой реакции и равновесие смещается вправо. При уменьшении концентрации исходных веществ, наоборот, возрастает скорость обратной реакции, а химическое равновесие смещается влево.
При увеличении температуры (т.е. при нагревании системы) равновесие смещается в сторону протекания эндотермической реакции, а при ее уменьшении (т.е. при охлаждении системы) – в сторону протекания экзотермической реакции. (Если прямая реакция является экзотермической, то обратная обязательно будет эндотермической, и наоборот).
Cu2S( т ) + 2O2( г ) = 2CuO( т ) + SO2( г )
1) В этой системе сместить равновесие в сторону прямой реакции можно, увеличив концентрацию O2, уменьшив концентрацию SO2
2) При уменьшении температуры равновесие смещается в сторону прямой реакции – экзотермической Q >0
3) Так как в реакции участвуют газы, число молекул газа справа и слева в уравнении реакции не равно, то на смещение равновесия влияет давление. При увеличении давления равновесие смещается в сторону уменьшения числа молекул газа, т.е. в сторону прямой реакции.
Задача 87
По данным таблицы 4 рассчитайте массовую и мольную доли растворённого в 100 г воды(MА = 18 г/моль) вещества, молярную и моляльную концентрации соответствующего раствора, повышение температуры кипения и понижение температуры замерзания, а также величину осмотического давления, если мембрана пропускает только молекулы воды и температура опыта 25°С. Постоянные воды: Кэ = 0,52и Кк = 1,86.
Таблица 5
| Номер задачи | Растворённое вещество | Плотность раствора, r (г/моль)
| ||
| Название | Молярная масса, МВ (г/моль) | Масса на 100 г воды, mВ (г) | ||
| 87 | Уксусн. кислота | 60 | 4,17 | 1,004 |
Решение
Массовая доля равна:
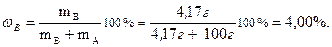
Мольная доля:
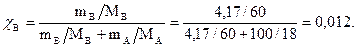
Моляльность:
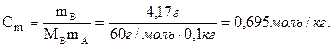
Молярность:
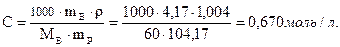
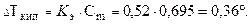 Повышение температуры кипения:
Повышение температуры кипения:
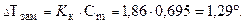 Понижение температуры замерзания:
Понижение температуры замерзания:
Осмотическое давление:
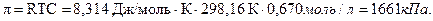
Задачи 103
Для реакций, схемы которых указаны ниже, составьте уравнения методом электронного баланса. Укажите типы реакций. Для каждой реакции укажите, какое вещество является окислителем, какое - восстановителем и почему.
103. 10FeCO3 + 2KMnO4 + 18H2SO4 ® 5Fe2(SO4)3 + CO2 + 2MnSO4 + K2SO4 + 18H2O
межмолекулярная ОВР
2Fe+2 – 1e = 2Fe+3│5 окисление, восстановитель
Mn+7 + 5e = Mn+2 │2 восстановление, окислитель
3Cl2 + 6KOH ® 5KCl + KClO3 + 3H2O реакция диспропорционирования
Сl20 + 2e = 2Cl-1│5 восстановление, окислитель
Сl20 - 10 e = 2Cl+5│1 окисление, восстановитель
Задача 128
Составьте полную схему гальванического элемента, напишите уравнения электродных процессов и вычислите ЭДС. Необходимые для решения данные приведены в табл. 6.
Т а б л и ц а 6
| N за- дачи | Ме- талл 1 | Ме- талл 2 | Элек- тролит 1 | Концентра- ция элек- тролита 1 | Элек- тролит 2 | Концентра- ция элек- тролита 2 |
| 121. 122. 123. 124. 125. 126. 127. 128. 129. 130. 131. 132. 133. | Ag. Cu. Zn. Zn. Cr. Mg. Zn. Cd. Ni. Cu. Zn. Mg. Fe. | Ag. Mg. Ni. Zn. Cu. Cu. Pb. Ni. Pb. Cu. Fe. Cd. Ag. | AgNO3 CuCl2 ZnSO4 ZnSO4 CrCl3 MgSO4 Zn(NO3)2 CdCl2 Ni(NO3)2 CuCl2 ZnCl2 MgCl2 Fe(NO3)2 | 1.0. 0.1. 0.1. 1.0. 0.1. 0.1. 0.01. 0.1. 0.1. 0.1. 0.1. 0.01. 0.1. | AgNO3 MgCl2 NiSO4 ZnSO4 CuCl2 CuSO4 Pb(NO3)2 NiCl2 Pb(NO3)2 CuCl2 FeCl2 CdCl2 AgNO3 | 0.001. 0.1. 0.1. 0.01. 0.1. 0.1. 0.01. 0.1. 1.0. 0.001. 0.1. 0.1. 0.1. |
Решение
Электродные потенциалы металлов равны: E◦(Ni2+/Ni)=-0,250 В
E◦(Cd2+/Cd)=-0,403 В.
E◦(Cd2+/Cd)< E◦(Ni2+/Ni), поэтому кадмий будет анодом, никель – катодом.
Схема гальванического элемента:
(-) Сd│CdCl2 (0,1 M)││NiCl2 (0,1 M)│Ni (+)
На электродах происходят процессы:
(–) А: Cd – 2e- = Cd2+;
(+) K: Ni2+ + 2e- = Ni.
Рассчитаем электродные потенциалы катода и анода:
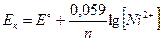
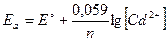
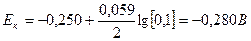
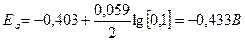
ЭДС = Eк - Eа
ЭДС = -0,280-(-0,433) = 0,153 В
Напишите уравнения электродных процессов, происходящих при коррозии сплава железа и меди во влажном воздухе.
Решение
E◦ (Fe2+/Fe) =-0,440 В
E◦ (Cu2+/Cu) = +0,337 В
Так как E◦ (Fe2+/Fe) < E◦ (Cu2+/Cu), то железный электрод является анодом, медный - катодом.
Схема коррозии во влажном воздухе
Fe│Fe2+││O2, H2O│Cu
На электродах происходят процессы:
(–) А: Fe – 2e- = Fe2+; окисление
(+) K: O2 + 2Н2O + 4e- = 4OH- восстановление
Поток электронов перемещается от железа к меди
Cуммарное уравнение:
2Fe + O2 + 2Н2O = 2Fe(OH)2
4Fe(OH)2 + O2 + 2Н2O = 4Fe(OH)3
Задача 178
Составьте уравнения реакций, с помощью которых можно осуществить ниже приведённые превращения. Реакции ионного обмена запишите в молекулярной и ионно-молекулярной форме. Для окислительно-восстановительных реакций составьте электронные уравнения процессов окисления и восстановления, укажите окислитель и восстановитель, подберите коэффициенты методом электронного баланса.
178. Cr ® CrCl2 ® Cr(OH)2 ® Cr(OH)3 ® Cr(NO3)3
1) Сr + 2HCl = CrCl2 + H2
Cr 0– 2e = Cr+2│ 1 восстановитель
2H+ + 2e = H2 │ 1 окислитель
2) CrCl2 + 2NaOH = Cr(OH)2 + 2NaCl
Cr2+ + 2Cl- + 2Na+ + 2OH- = Cr(OH)2 ↓ + 2Na+ + 2Cl-
Cr2+ + 2OH- = Cr(OH)2 ↓
3) 4Cr(OH)2 + O2 + 2H2O= 4Cr(OH)3
Cr+2 – 1e = Cr+3│ 4 восстановитель
O2 + 4e = 2O-2│ 1 окислитель
4) Cr(OH)3 + 3HNO3 = Cr(NO3)3 + 3H2O
Cr(OH)3 + 3H+ + 3NO3 - = Cr3+ + 3NO3- + 3H2O
Cr(OH)3 + 3H+ = Cr3+ + 3H2O
Дата добавления: 2020-01-07; просмотров: 264; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
