Гидролиз органических веществ.
Тема: Гидролиз неорганических и органических соединений.
(3 часа _11 класс)
Гидролиз (от лат. hydro – вода, lysis – разложение) – реакция обмена сложных веществ с водой.
Гидролиз солей – процесс взаимодействия ионов солей с молекулами воды, в результате, которого образуется слабый электролит.

 Виды гидролиза
Виды гидролиза
Обратимый Необратимый
 |
| |||||
| ||||||
ОСНОВАНИЯ
Сильные электролиты: растворимые основания, а также Са(ОН)2, Sr(OH)2, Слабые электролиты: малорастворимые и нерастворимые основания, а
также NH4ОН.
КИСЛОТЫ
Сильные электролиты: HCl, H2SO4, HNO3, HI, HBr и т.д.
Слабые: HF, H2SO3, HNO2, H2S, H2CO3, Н3РО4, органические кислоты и т.д.
Алгоритм составления уравнения гидролиза
|
|
|
1.
|

Соль - продукт реакции нейтрализации основания и кислоты.
Пример: соль Na 2 CO 3 образована сильным основанием NaOH и слабой угольной кислотой H2CO3.
2.
Записать уравнение диссоциации соли:
 Na 2 CO 3 2 Na + + CO 3 2-
Na 2 CO 3 2 Na + + CO 3 2-
3.
Выбрать слабый ион.
!!!Взаимодействовать с водой будет тот, кто слабый.
4.
Записать его взаимодействие с водой.
 CO 3 2- + H + OH - H CO 3 2-- + OH -
CO 3 2- + H + OH - H CO 3 2-- + OH -
Щелочная среда
5.
Определить среду раствора
(гидролиз по аниону, рН>7 щелочная реакция среды)
Четыре варианта взаимодействий кислот с основаниями.
| Соль образована | Сильная кислота | Слабая кислота |
| Сильное основание | Гидролиз не идет, среда нейтральная, рН=7 | Гидролиз по аниону, среда щелочная, рН>7 |
| Слабое основание | Гидролиз по катиону, среда кислая, рН<7 | Гидролиз по катиону и аниону, среда нейтральная, рН=7 |
Гидролизу подвергается тот, кто слабый,
а среду определяет сильный!
Особые случаи гидролиза
Ø AgNO 3 гидролизу не подвергается
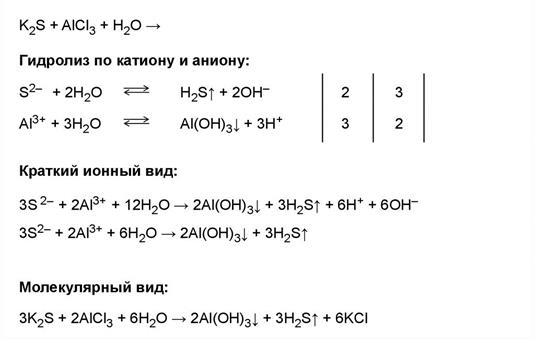
Ø Совместный гидролиз, взаимное усиление или двойной гидролиз.
Значение гидролиза
|
|
|
В живых организмах протекает гидролиз полисахаридов, белков и других органических соединений. В результате гидролиза минералов – алюмосиликатов – происходит разрушение горных пород. Гидролиз солей (например, Na 2 CO 3, Na 3 PO 4) применяется для очистки воды и уменьшения ее жесткости. В основе реакции получения мыла лежит реакция щелочного гидролиза жиров. В больших масштабах осуществляется гидролиз древесины. Гидролизная промышленность вырабатывает из непищевого сырья (древесины, хлопковой шелухи, подсолнечной лузги, соломы, кукурузной кочерыжки) ряд ценных продуктов: этиловый спирт, белковые дрожжи, глюкозу, фурфурол, метанол, лигнин и т.д.
Гидролиз органических веществ.
Задание: заполнить таблицу до конца, написав уравнения реакций
(см. 10 класс)
| Класс веществ, подвергающихся гидролизу | Продукты гидролиза | Пример реакции |
| 1. Алкоголяты, феноляты | Спирт, фенол и щелочь | |
| 2. Соли органических кислот | Кислота, щелочь | |
| 3. Моногалогеналканы | Спирт +гидрогалоген | |
| 4. Дигалогеналканы | Альдегид или кетон + гидрогалоген | |
| 5. Тригалогеналканы | Карбоновые кислоты + гидрогалоген | |
| 6. Сложные эфиры | Кислота +спирт | |
| 7. Галогенангидриды | Кислота +гидрогалоген | |
| 8. Ангидриды | Кислота | |
| 9. Амиды |  Кислота +аммиак
Соль аммония Кислота +аммиак
Соль аммония
| |
| 10. Жиры | Глицерин + высшие карбоновые кислоты | |
| 11. Олиго- и полисахариды | Моносахариды | |
| 12. Белки | Альфа-аминокислоты | |
| 13. Нуклеиновые кислоты |   Нуклеотиды нуклеозиды азотистые основания + моносахарид Нуклеотиды нуклеозиды азотистые основания + моносахарид
|
Домашнее задание:
|
|
|
1. Конспект с дополнениями из видеоролика
2. Заполнить таблицу
3. Прочитать & в учебнике
4. Какие из перечисленных веществ могут подвергаться гидролизу: бензол, хлорид алюминия, изопропилацетат, карбонат кальция, этанол, фосфат натрия, 1,1 – дибромэтан, карбид алюминия, серная кислота, фенолят калия, метиламин? Запишите уравнение реакций гидролиза.
Дата добавления: 2019-11-16; просмотров: 793; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
