Свойства паров, жидкостей и твердых тел
Давление насыщенного пара (p0) не зависит от объёма, а зависит от температуры (T) и концентрации молекул пара (n)
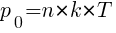 ,
,
где k – постоянная Больцмана
СИ: Па
Относительной влажностью воздуха (φ) называют отношение парциального давления (р) водяного пара, содержащегося в воздухе при данной температуре, к давлению (р0) насыщенного пара при той же температуре, выраженной в процентах.

СИ: %
Абсолютная влажность воздуха (ρ):
1) давление, оказываемое водяным паром при данных условиях:  ;
;
2) это масса (m) водяного пара в единице объёма (V = 1 м3) воздуха:  ;
;
СИ: Па, кг/м3
Коэффициент поверхностного натяжения (σ) жидкости равен отношению модуля силы поверхностного натяжения (F) к длине (l) границы поверхности натяжения, на которую действует эта сила.

СИ: Н/м
Высота (h) поднятия жидкости в капиллярной трубке (капилляре) прямопропорциональна коэффициенту поверхностного натяжения (σ) и обратно пропорциональна плотности жидкости (ρ) и радиусу (r) капиллярной трубки.

Капиллярное давление (p) жидкости в капилляре пропорционально коэффициенту поверхностного натяжения (σ) и обратно пропорционально радиусу капиллярной трубки (r).

СИ: Па
Основы термодинамики
Внутренняя энергия (U) идеального одноатомного газа прямо пропорциональна количеству вещества (m/М) и его абсолютной температуре (T)

СИ: Дж
|
|
|
Внутренняя энергия (U) идеального многоатомного газа прямо пропорциональна его абсолютной температуре (Т) и определяется числом степеней свободы (i) идеального газа. 
где i=3 – одноатомного;
i=5 – двухатомных;
i=6 – трехатомных и более.
СИ: Дж
Работа (А) внешних сил над газом , изменяющих объём газа при изобарном процессе, равна произведению давления (p) на изменение объёма (ΔV) газа.
A = p ∆ V
СИ: Дж
Первый закон термодинамики
1) Изменение внутренней энергии (ΔU) системы при переходе её из одного состояния в другое равно сумме работы внешних сил (А) и количества теплоты (Q), переданного системе:  ;
;
2) Количество теплоты (Q), переданное системе, идет на изменение её внутренней энергии (ΔU) и на совершение системой работы (А’) над внешними телами:  .
.
СИ: Дж
Применение первого закона термодинамики .
1) При изохорном процессе, изменение внутренней энергии (ΔU) равно количеству переданной теплоты (Q):  , (при V=const)
, (при V=const)
2) При изотермическом процессе, все переданное газу количество теплоты (Q) идет на совершение работы (А’):  , (при T=const)
, (при T=const)
3) При изобарном процессе, передаваемое газу количество теплоты (Q), идет на изменение его внутренней энергии (ΔU) и на совершение работы (А’):  (при p=const)
(при p=const)
4) При адиабатном процессе изменение внутренней энергии (ΔU) происходит только за счет совершение работы (А):  , (при Q=0)
, (при Q=0)
СИ: Дж
|
|
|
Работа теплового двигателя
Работа (А’), совершаемая тепловым двигателем, равна разности количества теплоты (Q1), полученного от нагревателя, и количества теплоты (Q2), отданного холодильнику

СИ: Дж
Коэффициентом (η) полезного действия (КПД) теплового двигателя называют отношение работы (А’), совершаемой двигателем, к количеству теплоты (Q1), полученному от нагревателя.
 ;
; 
СИ: Дж
КПД идеальной Тепловой машины
Реальная тепловая машина, работающая с нагревателем, имеющим температуру (T1), и холодильником с температурой (Т2), не может иметь КПД, превышающий КПД (7 тах) идеальной тепловой машины.
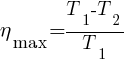
Дата добавления: 2019-11-16; просмотров: 222; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
