Новые аспекты развития и прогрессирования атеросклероза
В статье приведен обзор зарубеж ной литературы, дающей современ ное представление о механизмах развития атеросклероза. Рассмат риваются причины дисфункции эндотелия, воспалительные явления как запускающий механизм атеро генеза и в целом атеросклероз как воспалительное заболевание. Ключевые слова: атеросклероз, атерогенез, воспаление.
НОВЫЕ ВЗГЛЯДЫ НА МЕХАНИЗМ РАЗВИТИЯ АТЕРОСКЛЕРОЗА
Атеросклероз, по определению экспертов ВОЗ, — это «вариабельH ная комбинация изменений интимы артерий, включающая накопление липидов, липопротеидов, сложных углеводов, фиброзной ткани, компоH нентов крови, кальцификацию и сопутствующие изменения средней оболочки (медии) сосудистой стенки».

Существует несколько десятков гипотез развития атеросклероза, однако ни одна из них не является общепризнанной и окончательно доказанной. Атерогенез рассматривался как процесс, основанный на аккумуляции липидов на внутренней стенке артерий.
Несмотря на достижения современной медицины, прежде всего форH мирование учения о факторах риска и активную борьбу с ними, внедреH ние новых лекарственных средств и хирургических методов лечения, сердечноHсосудистые заболевания продолжают оставаться основной причиной смертности в США, Европе и странах бывшего СССР [1, 6, 53, 56].
На сегодняшний день известно, что в механизме развития атеросклеH роза большое значение имеют воспалительные явления (запускающий механизм), при которых выделяют ряд последовательных этапов: дисH функцию эндотелия, адгезию и диапедез моноцитов, формирование пенистых клеток, миграцию и пролиферацию гладкомышечных клеток сосудов. На самом деле атеросклероз представляет собой ряд высокоH специфических клеточных и молекулярных изменений, которые лучше всего в совокупности рассматривать как воспалительное заболевание [24, 50, 51].
Факторы атерогенеза
Патоморфологическим субстратом атеросклероза являются жировые полоски и фиброзные бляшки. Схема на рис. 1 отображает последоHвательность событий, в результате которых фиброзные бляшки ведут к клинической манифестации заболевания.
| Жировая полоска | ||||||||
| Фиброзная бляшка | ||||||||
| Осложненное поражение | ||||||||
| Кальцификация | Разрыв | Кровоизлияние | Фрагментация | Ослабление | ||||
| бляшки | в бляшку | сосудистой | ||||||
| стенки | ||||||||
| ↑ Ригидности со- | Сужение просвета | |||||||
| Тром- | Эмболия | Аневризма | ||||||
| судистой стенки | сосуда | |||||||
| боз | ||||||||


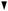

Рис. 1. Последовательность развития атеросклеротических поражений
2 4
| С раннего возраста у большинства лиц до 20 лет в | Независимо от причины дисфункции эндотелия | ||
| аорте и коронарных артериях обнаруживают изменеH | атеросклероз является характерной реакцией артерий. | ||
| ния в виде жировых пятен (менее 1 мм в диаметре) | Различные формы нарушений повышают проницаеH | ||
| или полосок (достигающих 1—2 мм в ширину и 1 см | мость и адгезивность эндотелия по отношению к лейкоH | ||
| в длину), которые характеризуются субэндотелиальH | цитам или тромбоцитам. Повреждение также являетH | ||
| ным накоплением крупных пенистых клеток, заполH | ся причиной того, что эндотелий обладает прокоагуH | ||
| ненных внутриклеточными липидами. Они бессимпH | лянтными вместо антикоагулянтных свойств и | ||
| томны, не выступают в просвет артерии и не мешают | формирует вазоактивные молекулы, цитокины и факH | ||
| кровотоку, а при некоторых локализациях могут со | торы роста. В том случае, если воспалительную реакH | ||
| временем претерпевать обратное развитие. Однако | цию не удается эффективно нейтрализовать, происхоH | ||
| при локализации, например, в коронарном русле | дит миграция и пролиферация гладкомышечных клеH | ||
| жировые полоски, видимо, являются предшественниH | ток, которые в области воспаления формируют | ||
| ками более опасных фиброзных бляшек [68]. БольH | промежуточное отложение [68]. | ||
| шинство пенистых клеток в жировых полосках проH | Продолжительное воспаление приводит к уплотнеH | ||
| изошли от макрофагов, а небольшая их часть — от | нию стенки артерии и ее расширению, а также к адH | ||
| гладкомышечных клеток, которые представляют соH | гезии макрофагов и лимфоцитов, их количество увеH | ||
| бой простое воспалительное повреждение, состоящее | личивается. Активация эндотелиальных клеток привоH | ||
| только из моноцитобразованных гистиоцитов (макроH | дит к чрезмерной экспрессии гидролитических | ||
| фагов) и ТHлимфоцитов [50, 59]. | ферментов, цитокинов, хемокинов и факторов роста, | ||
| Фиброзные бляшки — более далеко зашедшая | которые могут вызвать дальнейшее повреждение и в | ||
| стадия атеросклеротического процесса, обусловливаH | конечном итоге привести к фокальному некрозу [30]. | ||
| ющая развитие клинических проявлений болезни. | Таким образом, циклы накопления мононуклеарных | ||
| В отличие от жировых полосок, в фиброзных бляшках | клеток, миграция и пролиферация гладкомышечных | ||
| большинство пенистых клеток в них гладкомышечного | клеток и формирование фиброзной ткани приводят к | ||
| происхождения. Фиброзные бляшки часто содержат | дальнейшему развитию атеросклеротического процесH | ||
| некротическое ядро, состоящее из клеточного детрита, | са: образуется фиброзная капсула, покрывающая лиH | ||
| дегенерирующих пенистых клеток и кристаллов холеH | пидный слой и область фокального некроза и предH | ||
| стерина, они отделены от просвета артерии фиброзH | ставляющая собой так называемую атеросклеротичесH | ||
| ной покрышкой, в основном состоящей из экстрацелH | кую бляшку. Образующиеся бляшки вызывают сужение | ||
| люлярного соединительнотканного матрикса с вклюH | просвета сосуда и нарушение кровотока. | ||
| чениями в него гладкомышечных клеток. | Гиперхолестеринемия и модифицированные ли | ||
| Фиброзные бляшки чаще всего встречаются в брюшH | пиды и липопротеиды. ЛПНП могут модифицироH | ||
| ной аорте, затем по убывающей — в артериях короH | ваться посредством окисления, гликозилирования (при | ||
| нарных, подколенных, грудного и брюшного отделов | диабете), агрегации, взаимодействия с протеогликаH | ||
| аорты, а также в сонных. Области, кровоснабжаемые | нами или образуя иммунные комплексы [26, 61]. ТаH | ||
| этими артериями, наиболее часто страдают от последH | кие ЛПНП являются основной причиной повреждения | ||
| ствий атеросклероза, которые могут развиваться в | эндотелия и подлежащей гладкомышечной ткани [37]. | ||
| результате кальцификации фиброзной бляшки, разH | Проникая через мембрану клеток эндотелия, они подH | ||
| рыва и изъязвления, кровоизлияния в бляшку, эмбоH | вергаются прогрессивному окислению, способствуя | ||
| лизации и уменьшения прочности сосудистой стенки | аккумуляции эфиров холестерина, что, в свою очеH | ||
| с формированием аневризмы. | редь, приводит к образованию пенистых клеток. ДокаH | ||
| По мнению многих исследователей, событием, наH | зано, что только модифицированные частицы липоH | ||
| чинающим процесс атерогенеза, является повреждеH | протеинов оказывают провоспалительное действие. | ||
| ние эндотелия артерии. Ответвления, бифуркации и | Степень модифицирования ЛПНП изменяется. МодиH | ||
| изгибы артериального русла вызывают в кровотоке | фицированные ЛПНП захватываются макрофагами | ||
| такие изменения, как напряжение сдвига (shear stress) | посредством скевенджерHрецепторов [61]. Далее макH | ||
| и повышенная турбулентность. В указанных участках | рофаги накапливают в своей цитоплазме липиды и | ||
| на эндотелии повышена адгезия, миграция, накоплеH | превращаются в богатые липидами пенистые клетки. | ||
| ние моноцитов и ТHклеток [58]. | Удаление и секвестрирование модифицированных | ||
| Возможные причины дисфункции эндотелия: поH | ЛПНП являются важными этапами первоначальной | ||
| вышение уровня модифицированных липопротеидов | защитной роли макрофага в воспалительном ответе | ||
| низкой плотности (ЛПНП), свободные радикалы | [19]. Такие антиоксиданты, как витамин Е, могут | ||
| (вследствие курения), артериальная гипертензия, | уменьшать образование свободных радикалов, действуя | ||
| диабет, генетические альтерации, повышенные конH | на модифицированные ЛПНП [42]. Кроме своей споH | ||
| центрации гомоцистеинов в плазме, инфекционные | собности повреждать клетки, модифицированные | ||
| микроорганизмы, такие, как вирусы герпеса, легочH | ЛПНП являются хемотаксисными по отношению к | ||
| ные хламидии, а также сочетание этих и других | моноцитам и могут повысить экспрессию генов фактоH | ||
| факторов. | ра, стимулирующего образование колоний макрофаH | ||
2 5
гов (МHКСФ), а также моноцитарного хемоаттрактивH ного протеина [28], которые образуются в клетках эндотелия. Все это расширяет воспалительный ответ посредством стимуляции образования макрофагов из моноцитов и увеличивает поступление новых моноциH тов в место поражения .
Воспалительный ответ сам по себе сильно воздейH ствует на движение липопротеинов внутри артерии. Такие медиаторы воспаления, как фактор некроза опухоли α (ФНОHα), интерлейкинHl (ИЛH1) и МHКСФ, особенно увеличивают соединение ЛПНП с эндотелиH ем и гладкой мышечной тканью и повышают трансH крипцию ЛПНПHрецепторного гена [18]. После соH единения с поверхностными рецепторами in vitro моH дифицированные ЛПНП инициируют ряд внутриклеточных явлений [18], в т. ч. активацию уроH киназы и воспалительных цитокинов, таких, как ИЛHl [44]. Таким образом, порочный круг воспаления, модификации липопротеинов и дальнейшего воспалеH ния может сохраняться в артерии при наличии этих липидов.
Окисленный ЛПНП присутствует в атеросклероH тических отложениях у человека [73]. У животных с гиперхолестеринемией антиоксиданты могут уменьH шить размер отложений [8, 52], они же уменьшают жировые пятна у приматов [8]. Последние наблюдеH ния позволяют предположить, что антиоксиданты дают провоспалительный эффект, возможно, посредством снижения адгезии молекул к моноцитам. АнтиоксиH данты повышают сопротивляемость человеческих ЛПНП к окислению in vivo в количественном соотноH шении с содержанием витамина Е в плазме. Так, поH требление витамина Е обратно пропорционально чаH стоте встречаемости инфаркта миокарда. Витамин Е снижает развитие коронарных расстройств, что докаH зано клиническими испытаниями [48]. Другие антиокH сиданты, такие, как βHкаротин, не имеют такого свойH ства.
Гипергомоцистеинемия. Гомоцистеин — сульфгидHрильная аминокислота, образующаяся в результате метаболизма метионина при помощи ферментативных процессов. Некоторые врожденные или приобретенH ные состояния могут нарушать эти процессы [38], в результате чего возникает та или иная степень гиперH гомоцистеинемии: тяжелая (более 100 мкмоль/л), умеренная (от 30 до 100 кмоль/л) и мягкая (15—30 мкмоль/л). Тяжелая гипергомоцистеинемия крайне редка и возникает в результате либо гомозиготного дефицита цистатионинHβHсинтетазы (CBS) (90—95 % случаев), либо врожденного дефекта путей реметилиH рования (5—10 %). У таких пациентов возникают различные неврологические аномалии и нарушения развития, преждевременные сосудистые нарушения и тромбоэмболизм.
Мягкая и умеренная гипергомоцистеинемия также обусловлена множеством генетических дефектов. ГеH терозиготный дефект CBS в популяции встречается с частотой от 0,4 до 1,5 % [51], гомозиготы с мутацией
гена метилентетрагидрофолат редуктазы — с частоH той 5 % [52]; обе аномалии сочетаются с 50 % снижеH нием ферментативной активности. На фенотипичесH кую экспрессию влияют иные факторы; напротив, генетически «нормальные» индивидуумы могут иметь умеренно повышенный уровень гомоцистеина при различных приобретенных нарушениях (дефицит виH таминов, почечная недостаточность, влияние препараH тов и др.). Фолиевая кислота, витамин В6 и/или виH тамин В12 играют ключевую роль в ферментативных процессах, ответственных за метаболизм гомоцистеиH на [43]; даже при наличии врожденной мутации этих процессов нормализация уровня гомоцистеина может быть скоррегирована назначением витаминов.

В последние 10 лет эпидемиологические исследоH вания идентифицировали гипергомоцистеинемию как независимый фактор риска заболеваний перифериH ческих артерий, стенозов экстракраниальных каротидH ных артерий, поражений коронарных артерий и остH рого инфаркта миокарда [70]. Уровень гомоцистеина более 16 мкмоль/л был предиктором 3—4Hкратного увеличения возникновения инфаркта миокарда в US Physicians Health Study.
Артериальная гипертензия. Концентрация ангиHотензина II, основного продукта ренинHангиотензиноH вой системы, часто повышена у пациентов с артериH альной гипертензией. Ангиотензин II является сильH ным сосудосужающим средством. Кроме способности повышать артериальное давление он может способH ствовать атерогенезу, стимулируя рост гладкой мыH шечной ткани. Ангиотензин II соединяется со специH фическими рецепторами на гладкой мышечной ткани, что приводит к активации фосфолипазы С, которая, в свою очередь, может привести к повышению внутриH клеточной концентрации ионов кальция и гладкомыH шечному сокращению, к повышенному синтезу протеH ина и гипертрофии гладкомышечной ткани [15]. Он также повышает активность гладкомышечной липоH ксигеназы, что может вызвать увеличение воспалиH тельного процесса и окисление ЛПНП. Повышенное артериальное давление также обладает противовоспаH лительным действием, что приводит к образованию перекиси водорода и формированию свободных радиH калов, таких, как супероксид аниона и гидроксилрадиH калы в плазме [63]. Эти вещества снижают образоваH ние оксида азота при помощи эндотелия [69], повышаH ют адгезию лейкоцитов [63] и увеличивают сопротивление периферических сосудов. Таким обраH зом, образование свободных радикалов является проH межуточным звеном как при артериальной гипертенH зии, так и при гиперхолестеринемии.
Природа воспалительного ответа (взаимодей ствия между клетками эндотелия, моноцитами и Т клетками). В поврежденных участках на эндотеHлии повышена адгезия, миграция, накопление моноH цитов и ТHклеток. Адгезия молекул выступает в роли рецепторов к гликоконъюгатам и интегринам, находяH щимся на моноцитах и ТHклетках, включая тромбоциH
2 6
тоHэндотелиальноHадгезионные молекулы, отвечающие за миграцию лейкоцитов через эндотелий [58]. Она действует в соединении с хемоаттрактантами, котоH рые вырабатываются эндотелием, гладкими мышцами
и моноцитами и представлены моноцитарным хемоатH трактивным протеиномH1 (MCPH1), остеопонтином [14]
и модифицированным ЛПНП, притягивают моноциты
и ТHклетки к артерии (рис. 2. Рис. 2—5 на 3Hй полосе обложки).
Характер кровотока — повышение или снижение напряжения сдвига и турбулентности — играет важH ную роль при выявлении поражения сосудистых учаH стков. Изменения в кровотоке изменяют экспрессию генов, отвечающих за напряжение сдвига. Например, повышение экспрессии генов, ответственных за синH тез молекул межклеточной адгезииH1 [39], тромбоциH тарный фактор роста [47] и тканевой фактор [31], в эндотелиальных клетках происходит за счет снижеH ния напряжения сдвига [36]. Таким образом, изменеH ния в кровотоке имеют важное значение при опредеH лении, какие артериальные участки чаще всего подH вергаются поражениям [40]. Контакт и агрегация моноцитов и ТHклеток происходит на данных участках в результате действия молекул адгезии как на эндотеH лии, так и на лейкоцитах.
Хемокины могут вызвать хемотаксис и накопление макрофагов в жировых пятнах [5]. Активация моноциH тов и ТHклеток приводит к включению на их поверхноH стях таких рецепторов, как: 1) муциноподобные молеH кулы, которые соединяются селектинами; 2) интегриH ны, которые, в свою очередь, соединяются с молекулами адгезии иммуноглобулинового семейства, и 3) рецепH торы, которые соединяются с молекулами хемоаттракH тантов [58]. Эти лиганды (рецепторные взаимодейH ствия) в дальнейшем вызывают активацию мононукH леарных клеток, клеточную пролиферацию и помогают определить и локализовать воспалительную реакцию на поврежденных участках (рис. 3).
Недавно в эндотелии, гладких мышцах и макрофаH гах был выявлен класс молекулHдисинтегринов (иногH да их еще называют металлопротеиназподобными, дисинтегринподобными, цистеинобогощенными проH теинами) [21]. Молекулы адгезии, такие, как LHселекH тин, могут проникать через поверхность лейкоцитов под действием металлопротеиназы. Это наводит на мысль, что в случаях хронического воспаления, вероH ятно, можно обнаружить молекулы адгезии в плазме в качестве маркеров воспалительного ответа [23]. Дисинтегрины могут принимать участие в процессах «сброса» этих молекул. Данный процесс можно опреH делить по различным типам воспалительного ответа. Повышенные концентрации «сброшенных» молекул могут быть использованы для определения пациентов, входящих в группу риска развития атеросклероза или других воспалительных заболеваний.
Моноциты и иммунитет. Моноцит, предшественHник макрофагов, присутствует во всех тканях на всех этапах атерогенеза. Моноцитобразованные макрофаH
ги — это антигенпредставленные клетки, включаюH щие цитокины, хемокины, рострегулирующие молекуH лы, металлопротеиназы и другие гидролитические энзимы. Продолжительное поступление, выживание

и репликация мононуклеарных клеток в повреждениях частично зависят от МHКСФ и фактора, стимулируюH щего образование колоний гранулоцитHмакрофагов (ГМHКСФ) для моноцитов и ИЛH2 для лимфоцитов. Продолжительное воздействие МHКСФ дает возможH ность макрофагам выживать in vitro и размножаться внутри повреждений. И наоборот, воспалительные цитокины, такие, как интерферонHγ, активируют макH рофаги, которые при определенных обстоятельствах вызывают у них запрограммированную смерть клетки (апоптоз). Если это происходит in vivo, макрофаги могут попасть в некротическое ядро, что является характерной особенностью для запущенной формы атеросклероза (рис. 4).
Первоначально предполагалось, что при распростH ранении атеросклеротических отложений могут проH лиферировать только гладкомышечные клетки. ОднаH ко репликация моноцитобразованных макрофагов и ТHклеток, вероятнее всего, имеет такое же значение [49]. Способность макрофагов продуцировать цитокиH ны, протеолитические ферменты и факторы роста может оказаться критической при определении роли этих клеток при повреждении и репликации, которая наступает с дальнейшим атеросклеротическим отлоH жением (см. рис. 3).
Активированные макрофаги выделяют гистосовH местимые антигены класса II, такие, как HLA — DR, которые преобразуют их в антигены к ТHлимH фоцитам [45]. Таким образом, клеточноHрегуляторH ные иммунные ответы могут быть вовлечены в атеH рогенез, так как CD4 и CD8 ТHклетки присутствуют в отложениях на всех этапах процесса [20]. ТHклетH ки активируются в тот период, когда они присоедиH няют преобразованный и представленный макрофаH гами антиген, усиливают воспалительные реакH ции [20]. Гладкомышечные клетки в атеросклеротиH ческих отложениях, на поверхности которых имеютH ся молекулы класса II HLA, предположительно обH разованные под действием интерферонаHγ, также могут являться антигенами по отношению к ТHклетH кам [20]. Антиген может быть подвержен окислеH нию ЛПНП [62], который может быть продуцироH ван макрофагами. «Хит протеин 60» (heat protein 60) может также привести к аутоиммунному ответу. Этот и другие «хит протеины» выполняют различH ные функции, включая сбор, внутриклеточный трансH порт, распад белков и предотвращение их денатураH ции. Количество этих протеинов может увеличиH ваться на эндотелиальных клетках, и они могут участвовать в иммунных ответах [72].
Иммунорегуляторная молекула, лиганд CD40 [22], может вырабатываться макрофагами, ТHклетками, эндотелием и гладкой мускулатурой в атеросклеротиH ческих отложениях in vivo, а ее рецептор CD40 выраH
2 7
батывается на тех же самых клетках. И молекула, и рецептор подвергаются повышенной регуляции в атеH росклеротических повреждениях, тем самым обеспеH чивая дальнейшую иммунную активацию в атеросклеH ротических поражениях [32]. Более того, лиганд CD40 вызывает выделение ИЛH1β посредством сосудистых клеток, потенциально увеличивая воспалительную реакцию [54]. Ингибирование CD40 при помощи блоH кирующих антител снижает формирование атероH склеротических отложений у мышей с дефицитом апоH липопротеина Е [33].
Тромбоциты. Адгезия тромбоцитов и пристеночHный тромбоз выявляются повсеместно при образоваH нии атеросклеротических отложений у животных и людей (см. рис. 3) [24]. Тромбоциты могут присоедиH няться к эндотелию с функциональными нарушенияH ми, выделять коллаген и способствовать агрегации макH рофагов. При активации тромбоциты выделяют граH нулы, содержащие цитокины и факторы роста. Наряду
с тромбином они могут способствовать миграции и пролиферации гладкомышечных клеток и моноцитов [4]. Активация тромбоцитов приводит к образованию свободной арахидоновой кислоты, которая может трансH формироваться в простагландины, такие, как тромH боксан А2 (является одним из сильных сосудосуживаH ющих средств) и тромбоцитагрегирующее вещество, или в лейкотриены (они могут увеличивать воспалиH тельную реакцию).
Разрыв бляшки или тромбоз представляют собой значительные осложнения запущенных атеросклероH тических отложений, что приводит к нестабильным коронарным синдромам или развитию инфаркта миоH карда [24] (рис. 5).
Тромбоциты играют важную роль при сохранении сосудистой целостности и при защите от спонтанного кровотечения, активно участвуя в процессах тромбоH образования. Важным компонентом тромбоцитов явH ляется гликопротеин IIb/IIIaHрецептор, который приH надлежит к семейству интегринрецепторов адгезионH ных молекул. Он появляется на поверхности тромбоцитов во время активации тромбоцитов и в период образования тромба. Данные рецепторы выH полняют важную гемостатическую функцию, а их анH тагонисты предотвращают образование тромба у паH циентов с инфарктом миокарда [2].
Нестабильность и разрыв бляшки. Хроническиевоспалительные реакции часто связаны со специфиH ческими типами повреждающих или гранулемостиH мулирующих агентов. У большинства пациентов инH фаркт миокарда развивается в результате эрозии или шероховатого истончения и разрыва фиброзной капH сулы, часто у края бляшки, куда поступают макрофаH ги, накапливаются и активируются и где может проH изойти апоптоз [12, 27]. Деградация фиброзной капH сулы может быть следствием выработки металлопротеиназ, таких, как коллагеназа, эластаза и стромелизина (см. рис. 5). Активированные ТHклетки могут вызвать стимуляцию выработки меH
таллопротеиназ посредством макрофагов в поврежH дениях, которые содействуют нестабильности бляшH ки и в дальнейшем приводят к иммунному ответу. Эти изменения могут также сопровождаться выраH боткой прокоагулянта тканевого и других гемостатиH ческих факторов [32], в дальнейшем увеличивая веH роятность развития тромбоза.

Стабильные тяжелые формы атеросклеротическоH го отложения обычно обладают однородными, плотH ными фиброзными капсулами. Потенциально опасH ные бляшки чаще всего являются неокклюзионными и тем самым вызывают определенные затруднения при ангиографической диагностике. При аутопсии активH ное воспаление явно выражается в накоплении макроH фагов на участках разрыва бляшки [32]. Накопление макрофагов может быть связано с повышенными конH центрациями как фибриногена, так и СHреактивного белка в плазме [67]. Существует предположение, что эти два маркера воспаления являются ранними приH знаками атеросклероза. Разрыв бляшки и тромбоз могут являться причинами 50 % случаев коронарных синдромов и инфарктов миокарда [11].
Новые аспекты развития и прогрессирования атеросклероза
Гладкие миоциты. Важную роль в пролиферативHных и мигрирующих реакциях, приводящих к развиH тию атеросклеротических поражений на различных участках артериального русла, играет эмбриональное происхождение гладких миоцитов, входящих в состав артерии различной локализации. У некоторых позвоH ночных гладкие миоциты в верхнем отделе грудной аорты образуются из нейроэктодермального листка, в брюшной аорте — из мезенхимального [65]. (Хотя у людей это и не было выявлено). Гладкие миоциты коронарных артерий берут свое начало из третьего листка внутрисердечной мезенхимы. Различное проH исхождение гладких мышц наводит на мысль, что в различных частях артериального дерева они могут поH разному реагировать на стимулы, которые вызывают атеросклеротические поражения на каждом из этих участков.
Различия в происхождении гладких миоцитов заH ставляют задуматься: реагируют ли эти клетки, в заH висимости от происхождения, поHразному на различH ные цитокины, митогены, хемотаксисные факторы или внеклеточные матриксы [7]. Существует ли селекция какогоHто определенного происхождения, основанного на клеточных реакциях, на эти различные вещества? Помогает ли происхождение клетки объяснить, почеH му атеросклеротические поражения в периферичесH ких артериях отличаются от поражений в каротидных и коронарных?
Роль матрикса. Гладкие миоциты в медии артеHрий, так же, как и в атеросклеротических поражениH ях, окружены различными типами соединительной ткаH ни. Матрикс в медии состоит главным образом из типа I и III фибриллярного коллагена, в то время как
2 8
в атеросклеротических поражениях — в основном из протеогликанов, смешанных со свободно рассредотоH ченными коллагеновыми волокнами.
Культивированные человеческие артериальные гладH кие миоциты размещаются на коллагене в фибрилH лярной форме. Коллаген ингибирует клеточную проH лиферацию посредством повышенной регуляции спеH цифических ингибиторов клеточного цикла. In vivo разрешение и миграция коллагена (при помощи колH лагеназы) позволяет гладким миоцитам реагировать на митогенетические стимулы и воспроизводиться, что происходит при культивации на нефибриллярном моH номерном коллагене. Другие матриксные молекулы, такие, как фибронектин и гепаринсульфат, могут быть вовлечены в процесс, так как они ингибируют клеточH ный цикл и клеточноHматриксные взаимодействия. Это приводит к выработке хемокинов макрофагами [35, 71]. Если бы эти взаимодействия имели место в артеH риях, то они смогли бы значительно повлиять на восH палительную и фибропролиферативную реакцию. ТаH ким образом, матрикс, окружающий клетки, не являH ется нейтральным, и может определять, остаются ли клетки неподвижными или они размножаются в ответ на факторы роста.
Заключение
Клетки могут вырабатывать различные виды генов
и поэтому различаются фенотипически, в зависимосH ти от своей среды. Для определения ДНК разработаH ны новые методики, могущие предоставить огромное количество сведений о том, какие гены вырабатываH ются и в каких случаях, а также какую они несут информацию, которая должна помочь разгадать компH лексную природу атерогенеза [46, 55]. Поскольку атеH росклероз — мультигенное заболевание, понимание механизма формирования генотипа может помочь объяснить различия в восприимчивости к агентам, вызывающим заболевание. Более того, особенности генотипа могут влиять на атеросклеротические пораH жения у разных людей и при различной локализации. Это поможет пролить свет на генетические различия в восприимчивости лечения и реакции на него.
Достижения в молекулярной генетике сделали возH можным удалять или вставлять участки генов и опреH делять их роль в заболевании [9]. Многочисленные модели на животных оказались полезными при изучеH нии генетики атеросклероза.
Гиперхолестеринемия является важным фактором атерогенеза примерно у 50 % пациентов с сердечноH сосудистым заболеванием [6], необходимо принимать во внимание и другие известные факторы риска. АтеH росклероз, безусловно, представляет собой воспалиH тельное заболевание и не является простым следствиH ем накопления липидов. Если представится возможH ным выборочно нейтрализовать компоненты воспаления в артериях и сохранить факторы защиты, то станет реальным создание новых средств диагносH тики и лечения атеросклероза у пациентов, не страдаH ющих гиперхолестеринемией.
Дата добавления: 2019-11-25; просмотров: 179; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
