Тема 4. Растворы. Дисперсные системы
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ
ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ОБРАЗОВАНИЯ
«БРАТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
Естественнонаучный факультет
Кафедра «ЭБЖиХ»
Дисциплина «Химия»
КОНТРОЛЬНАЯ РАБОТА
ВАРИАНТ 18
| Выполнил: | группа | ||
| ФИО |
| ||
|
| |||
| Принял: | доцент | С.Ф. Лапина | |
|
| |||
| Проверил | доцент | С.Ф. Лапина | |
Тема 1. Строение вещества
Задание
1. Напишите электронные формулы атомов, образующих молекулы GeCl2; AlF3
Электронная формула Ge: 1s22s22p63s23p64s23d104p2
Электронная формула Cl: s22s22p63s23p5
Электронная формула Al: 1s22s22p63s23p1
Электронная формула F: 1s22s22p5
2. Определите механизм образования связи и ее вид
GeCl2 – ионная, механизм образования связи – обменный
AlF3 – ионная, механизм образования связи – обменный
3. Определите полярность молекулы
GeCl2 – полярная, ввиду угловой геометрии молекулы
AlF3 – неполярная, ввиду симметрии молекулы
4. Укажите, имеет ли место гибридизация, ее тип
GeCl2 – sp3– гибридизация, две орбитали отданы на связь, две – неподеленные электронные пары
AlF3 – sp2– гибридизация
5. Покажите геометрическую структуру молекулы
GeCl2 – - угловая молекула:

AlF3 – плоский треугольник

Тема 2. Основные понятия химической термодинамики
|
|
|
Задание
1. Запишите уравнение реакции 4HCl(г)+O2(г)=2Cl2(г)+2H2O(ж)
2. Рассчитайте стандартную энтальпию и стандартную энтропию химической реакции
1. Определим по таблицам ΔНобр всех продуктов и реагентов:
| ΔНобр(HCl(г)), кДж/моль | ΔНобр(O2(г)), кДж/моль | ΔНобр(Cl2(г)), кДж/моль | ΔНобр(H2O(ж)), кДж/моль |
| – 92,30 | 0 | 0 | – 285,84 |
2. Запишем закон Гесса для данной реакции:
ΔНр = 2ΔНобр(Cl2(г)) + 2ΔНобр(H2O(ж)) - ΔНобр(O2(г)) – 4ΔНобр(HCl(г)) = 2 · (0) + 2 · (– 285,84) – 4 · (– 92,30) = -202,48 кДж/моль
3. Определим энтропию данной реакции:
| Sобр(HCl(г)), Дж/моль·K | S(O2(г)), Дж/моль·K | S(Cl2(г)), Дж/моль·K | S(H2O(ж)), Дж/моль·K |
| 186,7 | 205,03 | 223,0 | 69,96 |
Sр = 2Sобр(Cl2(г)) + 2Sобр(H2O(ж)) - Sобр(O2(г)) – 4Sобр(HCl(г)) = 2 · 69,96 + 2 · 233 – 205,03 – 4 · 186,7 = –345,91 Дж/моль·K
3. Определите, в каком направлении при 298 К (прямом или обратном) будет протекать реакция, если все ее участники находятся в стандартном состоянии
Рассчитаем энергию Гиббса для данной реакции:
ΔGp = ΔH – TΔS = -202480 – 298 · (–345,91) = -99,399 кДж/моль
Так как энергия Гиббса для данной реакции отрицательна:
ΔGp = -99,399 кДж/моль < 0, следовательно, реакция проходит в прямом направлении
Тема 3. Химическая кинетика и катализ
|
|
|
Задание
1. Напишите выражение константы гетерогенного химического равновесия для равновесной химической реакции2Mg(к)+CО2(г)=2MgO(к)+C(к)

2. Оцените, в какую сторону сместится равновесие данной системы при повышении температуры
Для определения, в какую сторону сместится равновесие данной системы при повышении температуры, необходимо рассчитать, экзотермическая или эндотермическая эта реакция.
Как в прошлом примере, определим энтропию реакции:
1. Определим по таблицам ΔНобр всех продуктов и реагентов:
| ΔНобр(Mg(к)), кДж/моль | ΔНобр(CО2(г)), кДж/моль | ΔНобр(MgO(к)), кДж/моль | ΔНобр(C(к)), кДж/моль |
| 0 | – 393,5 | – 601,24 | 0 |
2. Запишем закон Гесса для данной реакции:
ΔНр = ΔНобр(Mg(к)) + ΔНобр(CО2(г)) – ΔНобр(MgO(к)) – ΔНобр(C(к))
ΔНр = 2 · (– 601,24) – (– 393,5) = – 808,98 кДж/моль
Следовательно, данная реакция экзотермическая, и соответственно, при повышении температуры равновесие сместится в сторону обратной реакции.
3. Нарушится ли равновесие в данной системе, если уменьшить давление в два раза.
Так как константа имеет вид:

То при увеличении давления в 2 раза равновесие сместится в сторону прямой реакции:

Тема 4. Растворы. Дисперсные системы
|
|
|
Задание
1. Из приведенных в табл. веществ (см. столбцы 1-3) выберите сильные и слабые электролиты и составьте уравнение их диссоциации в водном растворе.
2. В столбце 1а даны значения молярных концентраций для растворов электролитов из столбца 1. Зная молярную концентрацию своего раствора, определите молярную концентрацию эквивалента, массовую долю вещества, принимая его плотность равной 1 г/см3.
3. Рассчитайте рН раствора сильного электролита из столбцов 1 и 2 для соответствующей концентраций, данных в столбцах 1а и 2а.
4. Напишите уравнение гидролиза соли, данной в столбце 3, по всем возможным ступеням и выражение констант гидролиза по этим ступеням.
Таблица исходных данных
| Вариант | Наименование вещества | Концентрация вещества | |||
| 1 | 2 | 3 | 1а | 2а | |
| 18 | H2SO4 | HF | K2CO3 | 0,03 | 0,04 |
1. Из представленных веществ выберите сильные и слабые электролиты и составьте уравнение их диссоциации в водном растворе.
Решение
В зависимости от степени диссоциации различают электролиты сильные и слабые. Электролиты со степенью диссоциации больше 30% обычно называют сильными, со степенью диссоциации от 3 до 30% — средними, менее 3% — слабыми электролитами.
|
|
|
H2SO4– сильная кислота, степень диссоциации >30% - сильный электролит
H2SO4 « H+ + HSO4- - первая ступень диссоциации, диссоциация ступенчатая, равновесие сильно смещено вправо.
HSO4- « H+ + SO42- - вторая ступень диссоциации
HF – слабая кислота, Ka = 6,8·10 – 4– слабый электролит. Диссоциация проходит полностью:
HF « H+ + F-, равновесия заметно смещено влево
K2CO3 – хорошо растворимая соль, потому диссоциирует полностью – сильный электролит:
K2CO3 « 2K+ + CO32-
K2CO3 подвергается гидролизу у водном растворе:
K2CO3 + H2O « KHCO3 + KOH
CO32- + H2O « HCO3- + OH-
2. В столбце 1а даны значения молярных концентраций для растворов электролитов из столбца 1. Зная молярную концентрацию своего раствора, определите молярную концентрацию эквивалента, массовую долю вещества, принимая его плотность равной 1 г/см3.
Решение
Молярная концентрация эквивалентов вещества B CЭ(B) (нормальность – устаревш.) определяется числом эквивалентов растворенного вещества в единице объема раствора, моль∙литр–1:
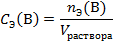
Определим количество вещества эквивалента в 1 литра раствора.
n(H2SO4) = c(H2SO4) · V = 0,03 · 1 = 0.03 моль
Число эквивалентности Z = 2 (число эквивалентности для основания равно количеству гидроксильных групп в формульной единице)
nЭ(H2SO4) = c(H2SO4) · 2 = 0.03 · 2 = 0.06 моль-экв
Тогда молярная концентрация эквивалентов будет:
 моль-экв/л.
моль-экв/л.
Определим массовую долю вещества.
1. Рассчитаем массу 1 л раствора:
ρ(раствора) = 1 г/см3 = 1000 г/л.
m(раствора) = V · ρ = 1 л · 1000 г/л = 1000 г.
2. Рассчитаем массу основания в 1 л раствора
n(H2SO4) = 0.03 моль
m(H2SO4) = M(H2SO4) · n(H2SO4) = (2 + 32 +16·4) · 0.03 = 98 г/моль · 0.03 моль = 2.94 г.
3. Определим массовую долю гидроксида стронция:
w(H2SO4) = m(H2SO4)/m(раствора) = 2.94 / 1000 = 0,294%.
3. Рассчитайте рН раствора сильного электролита из столбцов 1 и 2 для соответствующих концентраций, данных в столбцах 1а и 2а.
Решение
1. Рассчитаем рН раствора серной кислоты H2SO4.
Диссоциация селенистой кислоты проходит ступенчато:
H2SO4 « H+ + HSO4- Kдисс = 1,5∙10-2
HSO4- « H+ + SO42- Kдисс = 1∙10-3
В данном случае для удобства можно считать, что вторая ступень диссоциации незначительно влияет на рН раствора кислоты.
Будем проводить расчет по первой ступени диссоциации.
Константа равновесия этого процесса (она же константа диссоциации) имеет вид:

Из стехиометрического уравнения следует, что
[HSO4-] = [H+],
а равновесная концентрация селенистой кислоты будет равна:
[H2SO4] = c0(H2SO4) – [H+].
Подставив значения равновесных концентраций в выражение для Kдисс, получим:
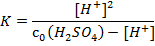

1.5∙10-2 · (0.03 – [H+]) = [H+]2
[H+]2 + 1.5∙10-2 · [H+] – 3 · 10-4 = 0
Решив квадратное уравнение, получаем значение [H+]:
[H+] = 0.0264 моль/л
pH = – lg[H+],
pH = 1.58
Ответ: pH = 1.58.
2. Рассчитаем рН раствора селенистой кислоты HF.
Диссоциация селенистой кислоты проходит ступенчато:
HF « H+ +F- Kдисс = 6,8·10–4
Очевидно, что вторая ступень диссоциации незначительно влияет на рН раствора кислоты.
Будем проводить расчет по первой ступени диссоциации.
Константа равновесия этого процесса (она же константа диссоциации) имеет вид:

Из стехиометрического уравнения следует, что
[F-] = [H+],
а равновесная концентрация селенистой кислоты будет равна:
[HF] = c0(HF) – [H+].
Подставив значения равновесных концентраций в выражение для Kдисс, получим:
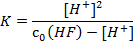

6.8 · 10-4 · (0.04 – [H+]) = [H+]2
[H+]2 + 6.8 · 10-4 · [H+] – 2.72 · 10-5 = 0
Решив квадратное уравнение, получаем значение [H+]:
[H+] = 0.01 моль/л
pH = – lg[H+],
pH = 2
Ответ: pH = 2.4.
3. Напишите уравнение гидролиза соли, данной в столбце 3, по всем возможным ступеням и выражение констант гидролиза по этим ступеням.
Первая ступень гидролиза:
K2CO3 + H2O « KHCO3 + KOH – молекулярный вид уравнения
CO32- + H2O « HCO3- + OH- – сокращенный ионный вид уравнения
Выражение для константы гидролиза:

Вторая ступень
KHCO3 + H2O « KOH + [H2CO3] – молекулярный вид уравнения
HCO3- + H2O « OH- + [H2CO3] – сокращенный ионный вид уравнения
Выражение для константы гидролиза:
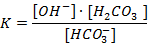
Дата добавления: 2019-11-25; просмотров: 840; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
