Взаимосвязь диэлектрической проницаемости и полярности
Поищи ещё
Адгезия, её виды. Работа адгезии.
Если жидкость или твердое тело имеет поверхность раздела фаз с другой жидкостью или твердым телом, то между ними проявляется в той или иной степени адгезия (прилипание). Адгезия жидкости к твердому телу сопровождается смачиванием его поверхности, т.е. адгезия и смачивание - это две стороны одного и того явления. Адгезия обуславливает взаимодействие между твердым телом и контактирующей жидкостью, а смачивание - явление, которое имеет место в результате этого взаимодействия.
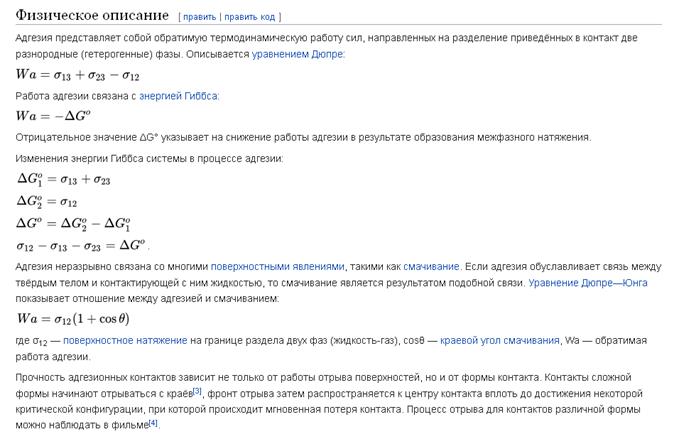
Количественно адгезия характеризуется работой адгезии, которая равна работе обратимого изотермического отрыва жидкости от твердой поверхности единичной площади. При таком отрыве образуются новые поверхности раздела фаз: ж/г и т/г, и исчезает поверхность раздела т/ж. Работа адгезии определяется по уравнению Дюпре, из которого следует, что чем больше работа адгезии, тем меньше поверхностное натяжение на границе т/ж. Действительно, чем сильнее межмолекулярные взаимодействия жидкости и твердого тела, тем меньше нескомпенсированность сил в поверхностном слое и тем меньше межфазное натяжение.
***********************************************************************
Работа адгезии – это работа, затрачиваемая на отрыв молекул одной фазы от молекул другой фазы
Wa = σА + σВ + σАВ
σА – поверхностное натяжение на границе вещества А с воздухом
σВ – поверхностное натяжение на границе вещества В с воздухом
σАВ - поверхностное натяжение на границе веществ А и В
Из уравнения видно, что работа адгезии тем больше, чем больше поверхностное натяжение каждой из фаз на границе с воздухом и чем меньше поверхностное натяжение на границе раздела между фазами А и В.
Рассматриваемые явления играют большую роль в таких процессах, как смачивание материалов, нанесение лакокрасочных и гальванических покрытий, получение материалов на основе связующих и наполнителей (бетон, резина, стеклопластики и др.), крашение, печатание, сварка и металлов.
Учитываются и используются адгезия и когезия в технологии лекарств, поскольку они влияют на взаимодействие компонентов в сложных лекарственных формах, на распадаемость таблеток, прочность покрытия их оболочками, на процессы растворения и в конечном итоге на эффективность терапевтического действия.
К явлениям адсорбции близки явления смачивания и адгезии, определяющиеся интенсивностью взаимодействия между молекулами разных веществ. Количественными характеристиками смачивания являются краевой угол и теплота смачивания. По способности поверхностей избирательно смачиваться водой, их классифицируют на гидрофильные (θ < 90 0) и гидрофобные (θ > 90 0). Используя ПАВ, можно провести инверсию смачивания.
Когезию и адгезию количественно оценивают работой, необходимой для разрыва связей между молекулами данной фазы или разных фаз.
*********************************************************************************
Адге ́ зия (от лат. adhaesio — прилипание) в физике — сцепление поверхностей разнородных твёрдых и/или жидких тел. Адгезия обусловлена межмолекулярными взаимодействиями (Ван-дер-Ваальсовыми, полярными, иногда — взаимной диффузией) в поверхностном слое и характеризуется удельной работой, необходимой для разделения поверхностей. В некоторых случаях адгезия может оказаться сильнее, чем когезия, то есть сцепление внутри однородного материала, в таких случаях при приложении разрывающего усилия происходит когезионный разрыв, то есть разрыв в объёме менее прочного из соприкасающихся материалов.
Частным случаем адгезии является аутогезия — связь между однородными конденсированными телами при их молекулярном контакте[1]. При аутогезии сохраняется граница раздела между телами; этим аутогезия отличается от когезии, относящейся к связи между частицами внутри тела в пределах одной фазы и характеризующей прочность конденсированных тел, то есть их способность противодействовать внешнему усилию[1].
Адгезия существенно влияет на природу трения соприкасающихся поверхностей: так, при взаимодействии поверхностей с низкой адгезией трение минимально. В качестве примера можно привести политетрафторэтилен (тефлон), который в силу низкого значения адгезии в сочетании с большинством материалов обладает низким коэффициентом трения. Некоторые вещества со слоистой кристаллической решёткой (графит, дисульфид молибдена), характеризующиеся одновременно низкими значениями адгезии и когезии, применяются в качестве твёрдых смазок.
Наиболее известные адгезионные эффекты — капиллярность, смачиваемость/несмачиваемость, поверхностное натяжение, мениск жидкости в узком капилляре, трение покоя двух абсолютно гладких поверхностей. Критерием адгезии в некоторых случаях может быть время отрыва слоя материала определенного размера от другого материала в ламинарном потоке жидкости.
Адгезия имеет место в процессах склеивания, пайки, сварки, нанесения покрытий. Адгезия матрицы и наполнителя композитов (композиционных материалов) является также одним из важнейших факторов, влияющих на их прочность.
В биологии клеточная адгезия — не просто соединение клеток между собой, а такое их соединение, которое приводит к формированию определённых правильных типов гистологических структур, специфичных для данных типов клеток. Специфичность клеточной адгезии определяется наличием на поверхности клеток белков клеточной адгезии — интегринов, кадгеринов и др. Например, адгезия тромбоцитов на базальной мембране и на коллагеновых волокнах повреждённой сосудистой стенки.
В антикоррозионной защите адгезия лакокрасочного материала к поверхности — наиболее важный параметр, влияющий на долговечность покрытия. Адгезия – прилипание лакокрасочного материала к окрашиваемой поверхности, одна из основных характеристик промышленных ЛКМ. Адгезия лакокрасочных материалов может иметь механическую, химическую или электромагнитную природу и измеряется силой отрыва лакокрасочного покрытия на единицу площади подложки. Хорошая адгезия лакокрасочного материала к окрашиваемой поверхности может быть обеспечена лишь при тщательной очистке поверхности от грязи, жира, ржавчины и прочих загрязнений. Также для обеспечения адгезии необходимо достичь заданной толщины покрытия, для чего используются толщиномеры мокрого слоя. Для оценки адгезии/когезии приняты и утверждены критерии[2].

Теории адгезии
Адгезия представляет собой крайне сложное явление, с чем связано существование множества теорий, трактующих это явление с различных позиций. В настоящее время известны следующие теории адгезии:
- Адсорбционная теория, согласно которой явление осуществляется в результате адсорбции адгезива на порах и трещинах поверхности субстрата.
- Механическая теория рассматривает адгезию как результат проявления сил межмолекулярного взаимодействия между контактирующими молекулами адгезива и субстрата.
- Электрическая теория отождествляет систему «адгезив — субстрат» с конденсатором, а двойной электрический слой, возникающий при контакте двух разнородных поверхностей, — с обкладкой конденсатора.
- Электронная теория рассматривает адгезию как результат молекулярного взаимодействия поверхностей, различных по своей природе.
- Диффузионная теория сводит явление к взаимной или односторонней диффузии молекул адгезива и субстрата.
- Химическая теория объясняет адгезию не физическим, а химическим взаимодействием.
Когезия
Межмолекулярные взаимодействия (за счёт сил Ван-дер-Ваальса) внутри фазы обуславливают другое явление - когезию. Когезия количественно характеризуется работой когезии, которая равна работе обратимого изотермического разрыва столбика исследуемого тела с сечением единичной площади.
Явления смачивания и растекания тесно связаны с действием сил когезии и адгезии.
Когезией называют сцепление однородных молекул, атомов или ионов, которое включает все виды межмолекулярного и межатомного притяжения внутри одной фазы.
Когезия определяет существование веществ в конденсированном (твердом и жидком) состоянии. Такие состояния характеризуются высокой когезией. Газообразные вещества обладают малой когезией.
Количественно когезию и адгезию характеризуют величиной работы когезии Wc и работы адгезии Wa.
Работа когезии равна энергии, которую нужно затратить на разрыв сил сцепления между молекулами данной фазы. Численно работа когезии равна удвоенному значению поверхностного натяжения.
Wc = 2 · σ
******************************************************


******************************************************

*****************************************************
КОГEЗИЯ (от лат. cohaesus - связанный, сцепленный), сцепление частей одного и того же однородного тела (жидкого или твердого). Обусловлена хим. связью между составляющими тело частицами (атомами, ионами) и межмол. взаимодействием. Работой когезии наз. свободную энергию разделения тела на части и удаления их на такое расстояние, когда нарушается целостность тела. Работу когезии Wc определяют как работу обратимого изотермич. разрушения тела: Wc=2g, где g - уд. поверхностная энергия (для твердых тел) или поверхностное натяжение (для жидкостей). Соотношение Wc и работы адгезии Wa, характеризующей сцепление разнородных тел (см. Адгезия), служит для определения способности жидкостей смачивать твердые тела: при Wa < 1/2Wc имеет место несмачивание, при 1/2Wc<Wa<Wc - смачивание, при Wa>Wc растекание жидкости по пов-сти твердого тела. Широко используется также понятие плотности энергии когезии Eс, к-рую отождествляют с внутр. энергией испарения (или сублимации) Uисп, отнесенной к молярному объему в-ва Vт:Fc=Uисп/Vm. По значениям Ес можно рассчитать параметр р-римости Гильдебранда 6: Ec=d2 (см. Растворимость). Для низкомол. соед. энергию когезии рассматривают как избыток потенц. энергии жидкости над потенц. энергией пара, численно равный внутр. энергии испарения Е при давлении р и т-ре Т:
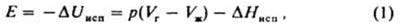
где DHисп энтальпия испарения, индексы "г" и "ж" означают газообразное и жидкое состояния в-ва соответственно. При Vг>>Vж и при условиях, когда пар ведет себя как идеальный газ, справедливо соотношение:

(R газовая постоянная). Значения Е и Ес определяют экспериментально по данным калориметрии; используют также эмпирич. соотношение Гильдебранда DHисп=0,02 Т2ксп+27,3Ткип — 2950. Приближенные расчеты Ес основаны на предположении об аддитивности вкладов в плотность энергии когезии энергий хим. связей, соединяющих атомы (инкрементов) DЕi: когезия низкомол. в-в связана с их агрегатным состоянием 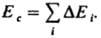 и служит для оценки св-в (термодинамич., мех. и др.). Когезионные характеристики низкомол. жидкостей и твердых тел чувствительны к их хим. природе. Так, введение в молекулы углеводородов атомов галогенов приводит к увеличению Ес от 8-25 до 10-44 кДж/моль, азота - до 14-42 кДж/моль, серы - до 12-52 кДж/моль. При введении гидроксильных, карбонильных и карбоксильных групп Ес увеличивается соотв. до 20-60, 11-30 и 22-35 кДж/моль. При этом аналогично изменяются св-ва в-в (т-ры кипения, плавления и сублимации, вязкость, диэлектрич. проницаемость, поверхностное натяжение и др.). Для высокомол. соед. понятие DHисп лишено физ. смысла и соотношение (2) не применимо. На практике обычно параметр р-римости полимера dВМС принимают равным параметру р-римости низкомол. жидкости, к-рая является для полимера лучшим р-рителем из всех имеющихся (о р-римости полимера судят по объемному набуханию или характеристич. вязкости р-ра). В случаях, если известна структурная ф-ла повторяющегося составного (или мономерного) звена макромолекулы, можно рассчитать Ес, используя метод инкрементов. Известно ок. 10 наборов значений DEi позволяющих обеспечить хорошее совпадение с эксперим. данными (расхождение не превышает 5-10%). Точность расчета увеличивается, если учесть своб. объем полимера. Такой подход справедлив и для энергии когезии Еsc сегментов макромолекул. Найденные когезионные характеристики используют для корреляции с мех. прочностью, т-рами плавления и стеклования, характеристиками р-римости, набухания, смачиваемости, совместимости и др. св-в полимерных материалов, важных при их переработке и практич. использовании. Эксперим. данные подтверждают связь когезионньгх характеристик полимеров с их хим. природой и строением. Так, в ряду полиолефины, полиамиды, полиакрилаты, полиарилаты, полигетероарилены Ес увеличивается от 9-25 до 40-100, 16-130, 100-160 и 90-200 кДж/моль соотв., Еsc изменяется от 15-500 до 200-700, 90-2100, 250-10000 и 550-15000 кДж/моль. Для полипептидов, отличающихся большой мол. массой и регулярным строением молекул, Ес достигает 350, а Еsc - 50000-70000 кДж/моль. Дальнейшее углубление представлений о когезии предполагает рассмотрение отдельных составляющих плотности энергии когезии (параметра р-римости), обусловленных разл. межмол. взаимодействиями. Обычно выделяют составляющие, связанные с диполь-дипольным (полярным) взаимод. (dр), дисперсионным взаимодействием (dd) и водородной связью (dН). Общее (суммарное) значение параметра р-римости dS определяется соотношением:
и служит для оценки св-в (термодинамич., мех. и др.). Когезионные характеристики низкомол. жидкостей и твердых тел чувствительны к их хим. природе. Так, введение в молекулы углеводородов атомов галогенов приводит к увеличению Ес от 8-25 до 10-44 кДж/моль, азота - до 14-42 кДж/моль, серы - до 12-52 кДж/моль. При введении гидроксильных, карбонильных и карбоксильных групп Ес увеличивается соотв. до 20-60, 11-30 и 22-35 кДж/моль. При этом аналогично изменяются св-ва в-в (т-ры кипения, плавления и сублимации, вязкость, диэлектрич. проницаемость, поверхностное натяжение и др.). Для высокомол. соед. понятие DHисп лишено физ. смысла и соотношение (2) не применимо. На практике обычно параметр р-римости полимера dВМС принимают равным параметру р-римости низкомол. жидкости, к-рая является для полимера лучшим р-рителем из всех имеющихся (о р-римости полимера судят по объемному набуханию или характеристич. вязкости р-ра). В случаях, если известна структурная ф-ла повторяющегося составного (или мономерного) звена макромолекулы, можно рассчитать Ес, используя метод инкрементов. Известно ок. 10 наборов значений DEi позволяющих обеспечить хорошее совпадение с эксперим. данными (расхождение не превышает 5-10%). Точность расчета увеличивается, если учесть своб. объем полимера. Такой подход справедлив и для энергии когезии Еsc сегментов макромолекул. Найденные когезионные характеристики используют для корреляции с мех. прочностью, т-рами плавления и стеклования, характеристиками р-римости, набухания, смачиваемости, совместимости и др. св-в полимерных материалов, важных при их переработке и практич. использовании. Эксперим. данные подтверждают связь когезионньгх характеристик полимеров с их хим. природой и строением. Так, в ряду полиолефины, полиамиды, полиакрилаты, полиарилаты, полигетероарилены Ес увеличивается от 9-25 до 40-100, 16-130, 100-160 и 90-200 кДж/моль соотв., Еsc изменяется от 15-500 до 200-700, 90-2100, 250-10000 и 550-15000 кДж/моль. Для полипептидов, отличающихся большой мол. массой и регулярным строением молекул, Ес достигает 350, а Еsc - 50000-70000 кДж/моль. Дальнейшее углубление представлений о когезии предполагает рассмотрение отдельных составляющих плотности энергии когезии (параметра р-римости), обусловленных разл. межмол. взаимодействиями. Обычно выделяют составляющие, связанные с диполь-дипольным (полярным) взаимод. (dр), дисперсионным взаимодействием (dd) и водородной связью (dН). Общее (суммарное) значение параметра р-римости dS определяется соотношением:
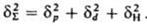
Для воды значение dS определяется в осн. наличием водородной связи и диполь-дипольным взаимод. (dН=34,2, dр=31,3,dd=12,3 МДж0,5/м1,5). Для углеводородных жидкостей с полярными галогени азотсодержащими молекулами dр соотв. в 2 и 5-10 раз больше, чем для незамещенных углеводородов. Для техн. углерода dd=21,1, dр=12,3, dН=11,2 МДж0,5/м1,5. Для полимеров отдельные составляющие dS выделить труднее; по-видимому, из-за больших размеров макромолекул нивелируются различия в межмол. взаимод. функц. групп.
Смачивание
Смачивание количественно характеризуется краевым углом смачивания 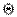 или соs
или соs 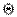 . Краевой угол - это угол между твердой поверхностью и касательной, проведенной в точке соприкосновения фаз к поверхности капли. Отсчет угла проводят в сторону жидкости. Если
. Краевой угол - это угол между твердой поверхностью и касательной, проведенной в точке соприкосновения фаз к поверхности капли. Отсчет угла проводят в сторону жидкости. Если 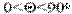 , то поверхность смачивается жидкостью. Твёрдую поверхность называют лиофильной (при смачивании водой - гидрофильной, при смачивании неполярными жидкостями - олеофильной). Если
, то поверхность смачивается жидкостью. Твёрдую поверхность называют лиофильной (при смачивании водой - гидрофильной, при смачивании неполярными жидкостями - олеофильной). Если 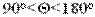 , то поверхность не смачивается жидкостью. Поверхность твёрдого тела называют лиофобной (в случае воды - гидрофобной, в случае неполярной жидкости - олеофобной).
, то поверхность не смачивается жидкостью. Поверхность твёрдого тела называют лиофобной (в случае воды - гидрофобной, в случае неполярной жидкости - олеофобной).
Равновесные краевые углы 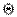 определяются только значениями поверхностных натяжений на границах раздела всех трех фаз. Равновесию отвечает минимум поверхностной энергии, поэтому для каждой системы при данных внешних условиях угол
определяются только значениями поверхностных натяжений на границах раздела всех трех фаз. Равновесию отвечает минимум поверхностной энергии, поэтому для каждой системы при данных внешних условиях угол 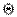 имеет только одно значение, определяемое уравнением Юнга.
имеет только одно значение, определяемое уравнением Юнга.
В зависимости от условий (шероховатость поверхности, наличие электролитов или ПАВ в смачивающей жидкости) краевой угол может существенно изменяться. Это означает, что одни и те же поверхности в различных условиях могут быть гидрофильными и гидрофобными. Поэтому понятия «гидрофильность» и «гидрофобность» обычно применяют для характеристики процессов изменения смачивающей способности. Под гидрофилизацией понимают меры по снижению краевого угла. Напротив, гидрофобизация предполагает процесс увеличения краевого угла смачивания при взаимодействии поверхности с водой.
Явления адгезии и смачивания тесно связаны между собой. Связь между работой адгезии и краевым углом смачивания дает уравнение Дюпре - Юнга, позволяющее по экспериментально измеренному значению соs 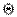 рассчитать работу адгезии Wa:
рассчитать работу адгезии Wa: 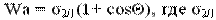 - поверхностное натяжение на границе ж/г.
- поверхностное натяжение на границе ж/г.
Жидкости с малым поверхностным натяжением (это обычно неполярные жидкости), например, непредельные углеводороды или бензол, смачивают практически все поверхности - полярные и неполярные, поскольку их когезионные силы сопоставимы с силами, вызывающими адгезию. Жидкости с большим поверхностным натяжением, такие как вода или ртуть, смачивают лишь те поверхности, к которым их адгезия велика. Например, вода хорошо смачивает полярные поверхности - кварц, бумагу, оксиды металлов; ртуть не смачивает любые поверхности (кроме поверхности металлов, лишённой оксидной плёнки).
Природу поверхности твердого тела, а значит, и характер её смачивания можно изменить путем модифицирования, например, проведя химическую обработку. Один из широко распространенных способов изменения состава поверхности основан на адсорбции поверхностно-активных веществ. В результате адсорбции ПАВ изменяется не только значение краевого угла смачивания, но и скорость растекания смачивающей жидкости.
Влияние ПАВ на смачивание зависит от того, на какой поверхности раздела фаз они адсорбируются - на твердой поверхности или границе жидкость - газ. Если поверхность твердого тела гидрофобная, то из водных растворов молекулы ПАВ адсорбируются и на твердой поверхности, и на границе ж/г, ориентируясь при этом в соответствии с правилом выравнивания полярностей Ребиндера. В результате твердая поверхность становится менее гидрофобной, происходит гидрофилизация поверхности. Может вообще произойти переход от несмачивания к смачиванию, т.е. инверсия смачивания.
Возможность изменить природу поверхности твердого тела, изменяя ее смачиваемость, широко используют в полиграфической технологии при изготовлении форм плоской печати. Для получения на поверхности формы печатающих элементов, которые хорошо смачиваются неполярной краской и плохо смачиваются водой, используют вещества, ориентирующиеся при адсорбции так, чтобы в сторону жидкости были обращены неполярные группы. Для большей устойчивости полученной гидрофобной пленки необходимо, чтобы адсорбция указанных веществ была химической. Так, для гидрофобизации печатающих элементов биметаллических форм используют бутилксантогенат калия (БКК), молекулы которого хемосорбируются на поверхности меди с ориентацией полярной группы в сторону меди и неполярной группы в сторону воды. Взаимодействие молекул воды с углеводородными радикалами ПАВ слабее, чем с металлом, и поверхность формы гидрофобизуется. Наиболее гидрофобная поверхность меди получается при полном покрытии поверхности формы адсорбатом (БКК или жирной кислотой), т.е. при адсорбции, равной  .
.
Образование на формах плоской печати пробельных элементов, хорошо смачиваемых водой (или увлажняющим раствором), сводится к получению устойчивой гидрофильной пленки на поверхности металла. Для этого поверхность формы обрабатывают растворами электролитов (обычно ортофосфорной кислоты и её солей) или растворами полярных полимеров (крахмала, декстрина, КМЦ натрия и т.д.). Гидрофилизация поверхности происходит вследствие адсорбции указанных веществ и ориентации их молекул полярными группами в сторону воды.
Ортофосфорная кислота химически взаимодействует с оксидной пленкой на поверхности металла, в результате на пробельных элементах формы образуется тонкая солевая микропленка фосфата алюминия, практически нерастворимая в воде, которая улучшает смачивание поверхности увлажняющим раствором (водой).
********************************************************************
Смачивание – это поверхностное явление, заключающееся во взаимодействии жидкости с твердым телом при наличии одновременного контакта трех несмешивающихся фаз. Смачивание часто рассматривают как результат межмолекулярного (вандерваальсова) взаимодействия, однако во многих случаях (например, при соприкосновении жидких металлов с твердыми металлами) смачивание обусловлено скорее, образованием химических соединений, твердых и жидких растворов и диффузионными процессами в поверхностном слое смачиваемого тела.
Смачивание – самопроизвольный процесс, идущий с уменьшением поверхностной энергии. Поэтому при смачивании выделяется теплота. Чем лучше твердое тело смачивается жидкостью, тем выше теплота смачивания. Тепловой эффект, сопровождающий соприкосновение жидкости со смачиваемой поверхностью, называется теплотой смачивания.
Мерой смачивания является краевой угол смачивания Θ между смачиваемой поверхностью и поверхностью жидкости на периметре. Угол Θ отсчитывают со стороны жидкости. Точка, соответствующая краевому углу смачивания 90°, называется точкой инверсии. При статическом (равновесном) смачивании угол Θ связан с поверхностным натяжением жидкости (σж), поверхностным натяжением твердого тела (σ) и межфазным натяжением на границе «твердое тело – жидкость» (σтж) уравнением Юнга:
cosΘ = (σт – σ тж) / σ ж.
Величиной угла Θ оценивают лиофильность и лиофобность поверхностей по отношению к различным жидкостям. На лиофильной поверхности жидкость растекается, т. е. имеет место частичное (0° < Θ < < 90°) или полное смачивание, на лиофобной поверхности растекания не происходит (Θ > 90°). Краевой угол зависит от соотношения сил сцепления молекул жидкости с молекулами или атомами смачиваемого тела (адгезии) и сил сцепления молекул жидкости между собой (когезии). Обратимую работу адгезии и когезии вычисляют, соответственно, по уравнениям:
Wa = σж (1 + cosΘ) и Wk = 2σж.
При Wa < WK всегда Θ > 0°, причем с увеличением отношения Wa < Wk улучшается С.
Работа адгезии характеризует работу по отрыву от твердой поверхности. Оценивается она по уравнению Дюпре-Юнга: Wа=σ(1 + cos х).
Разность S = Wa – Wk называется коэффициентом растекания. Часто наблюдаемая задержка в установлении равновесных краевых углов называется гистерезисом смачивания. Различают кинетический (динамический) и статический гистерезис смачивания.
Причинами гистерезиса могут быть шероховатость поверхности, особенности структуры поверхностного слоя, релаксационные процессы в жидкой фазе и др.
Если твердое тело соприкасается одновременно с двумя несмешивающимися жидкостями, происходит избирательное смачивание. Эффективные регуляторы смачивания – поверхностно-активные вещества, которые могут как улучшать, так и ухудшать его.
В узких каналах, цилиндрических капиллярах образуется вогнутый мениск – полностью искривленная поверхность жидкости
*******************************************************************

**************************************************

Растекание

****************************************************
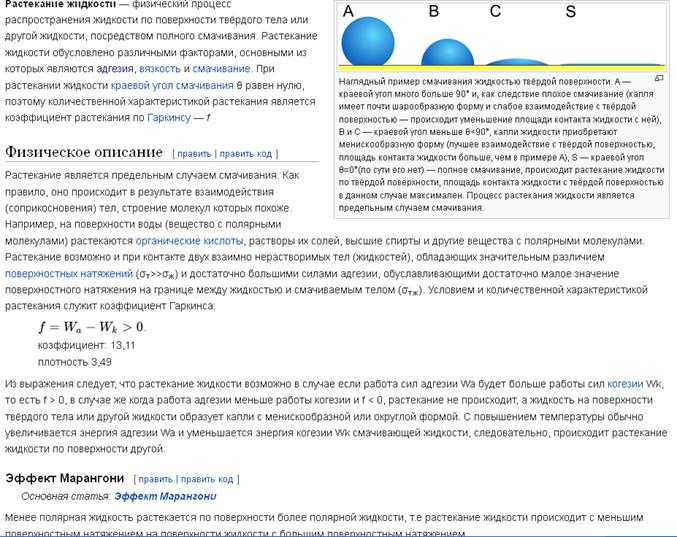
*******************************************************
Поищи ещё
Дата добавления: 2019-11-25; просмотров: 563; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
