Виды учебной деятельности на занятии
Тема 1. А минокислоты: строение, стереохимия, биологически важные реакции a -аминокислот. Пептиды, особенности пептидной связи. Классификация и строение белков
Строение и свойства аминокислот и белков
 a -Аминокислоты – гетерофункциональные соединения, молекулы которых содержат две функциональные группы: карбоксильную группу (–СООН) и аминогруппу (–NH2), причём обе группы связаны с одним и тем же атомом углерода. Называют a-аминокислоты по Международной номенклатуре, при этом атом углерода, с которым связана аминогруппа имеет второй порядковый номер. Для многих a- аминокислот, особенно тех, которые входят в состав белков, чаще используются названия по тривиальной номенклатуре.
a -Аминокислоты – гетерофункциональные соединения, молекулы которых содержат две функциональные группы: карбоксильную группу (–СООН) и аминогруппу (–NH2), причём обе группы связаны с одним и тем же атомом углерода. Называют a-аминокислоты по Международной номенклатуре, при этом атом углерода, с которым связана аминогруппа имеет второй порядковый номер. Для многих a- аминокислот, особенно тех, которые входят в состав белков, чаще используются названия по тривиальной номенклатуре.
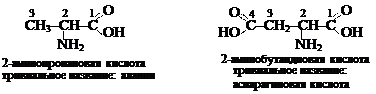 |
Различают аминокислоты, содержащие следующие радикалы: неполярные (гидрофобные); полярные (гидрофильные) заряженные и незаряженные; ароматические (Приложение 3).
a-Аминокислоты – бесцветные кристаллические вещества, растворимые в воде.
Основным источником a-аминокислот для живого организма служат пищевые белки. Некоторые a-аминокислоты могут синтезироваться в организме (из других аминокислот или иных продуктов метаболизма), но часть a-аминокислот в организме человека не синтезируются и могут поступать только с пищей, такие a-аминокислоты называют незаменимыми: валин, лейцин, изолейцин, лизин, треонин, метионин, фенилаланин, триптофан. Поэтому так важно сбалансированное белковое питание человека.
|
|
|
При некоторых заболеваниях заменимые аминокислоты могут перейти в разряд незаменимых. Например, при фенилкетонурии организм перестаёт синтезировать аминокислоту тирозин.
Многие a-аминокислоты используются в медицине. Так, глицин улучшает обменные процессы в тканях мозга и мышц. Глутаминовая кислота применяется при лечении заболеваний центральной нервной системы, метионин и гистидин для лечения заболеваний печени и т.д.
Реакции аминокислот: образование солей, сложных эфиров, амидов, ангидридов, галегенангидридов, ацилирование, декарбоксилирование, деазаминирование, трансаминирование, алкилирование, образование дикетопиперазинов.
Белки – это высокомолекулярные азотсодержащие органические вещества, молекулы которых построены из остатков аминокислот, соединенных пептидными связями. Белки составляют основу и структуры, и функций живых организмов. Для высокомолекулярных полипептидов и белков наряду с первичной структурой (последовательность аминокислот) характерны более высокие уровни организации, которые принято называть вторичной (спиралевидная и складчатая), третичной (глобулярная и фибриллярная) и четвертичной структурами.
|
|
|
Белки можно классифицировать:
– по форме молекул (глобулярные и фибриллярные);
– по молекулярной массе (низко- и высокомолекулярные);
– по составу или химическому строению (простые и сложные);
– по выполняемым функциям;
– по локализации в клетке (ядерные, цитоплазматические и др.);
– по локализации в организме (белки крови, печени и др.);
– по возможности адаптивно регулировать количество данных белков: белки, синтезирующиеся с постоянной скоростью (конститутивные), и белки, синтез которых может усиливаться при воздействии факторов среды (индуцибельные);
– по продолжительности жизни в клетке (от очень быстро обновляющихся белков, с периодом полупревращения менее 1 ч, до очень медленно обновляющихся белков, период полупревращения которых исчисляют неделями и месяцами);
– по схожим участкам первичной структуры и родственным функциям (семейства белков).
Таблица 3. Функции белков
| Функция белка | Сущность действия | Примеры |
| Каталитическая (ферментативная) | Ускорение химических реакций в организме | Пепсин, трипсин, каталаза, цитохромоксидаза, амилаза, липаза |
| Транспортная | Транспорт (перенос) химических соединений в организме | Гемоглобин, альбумин, трансферрин |
| Структурная (пластическая) | Обеспечение прочности и эластичности тканей | Коллаген, эластин, кератин, гистоны |
| Сократительная | Укорочение саркомеров мышцы (сокращение) | Актин, миозин |
| Регуляторная (гормональная) | Регуляция обмена веществ в клетках и тканях | инсулин, соматотропин, глюкагон, кортикотропин |
| Защитная | Защита организма от повреждающих факторов | Интерфероны, иммуноглобулины, фибриноген, тромбин |
| Энергетическая | Высвобождение энергии за счёт распада аминокислот | Белки пищи и тканей |
|
|
|
Классификация простых белков
Альбумины. Примерно 75-80% онкотического давления белков сыворотки крови приходится на альбумины; еще одна функция – транспорт жирных кислот.
Глобулины. a-Глобулины содержатся в крови в комплексе с билирубином и с липопротеинами высокой плотности. Фракция β-глобулинов включает протромбин, являющийся предшественником тромбина – белка, ответственного за превращение фибриногена крови в фибрин при свертывании крови. g-Глобулины выполняют защитную функцию.
Протамины – низкомолекулярные белки, обладающие выраженными основными свойствами, обусловленными наличием в их составе от 60 до 85% аргинина. В ядрах клеток ассоциируются с ДНК.
|
|
|
Гистоны также являются небольшими белками основного характера. В их состав входят лизин и аргинин (20…30%). Гистоны играют важную роль в регуляции экспрессии генов.
Проламины – белки растительного происхождения, содержатся в основном в семенах злаков. Все белки этой группы при гидролизе дают значительное количество пролина. Проламины содержат 20…25% глутаминовой кислоты и 10…15% пролина. Наиболее изучены оризенин (из риса), глютенин (из пшеницы), зеин (из кукурузы) и др.
Глютелины – простые белки, содержатся в семенах злаков, в зелёных частях растений. Для глютелинов характерно сравнительно высокое содержание глутаминовой кислоты и наличие лизина. Глютелины – запасные белки.
Таблица 4. Классификация сложных белков
| Название класса | Простетическая группа | Представители класса |
| Хромопротеины | Окрашенные соединения (гемопротеины, флавопротеины) | Гемоглобин, миоглобин, цитохромы, каталаза, пероксидаза |
| Нуклеопротеины | Нуклеиновые кислоты | Вирусы, рибосомы, хроматин |
| Фосфопротеины | Фосфорная кислота | Казеин молока, овальбумин, вителлин, ихтулин |
| Металлопротеины | Ионы металлов | Ферритин, трансферрин, церулоплазмин, гемосидерин |
| Гликопротеины | Углеводы и их производные | Гликофорин, интерферон, иммуноглобулины, муцин |
| Липопротеины | Липиды и их производные | Хиломикроны, липопротеины плазмы крови, липовителин |
Для определения состава белка его подвергают гидролизу в горячей соляной кислоте, анализируют смесь аминокислот и устанавливают качественный и количественный состав белка. Для определения последовательности, в которой связаны аминокислотные остатки используют комбинацию двух методов: определение концевых групп и частичный гидролиз.
Для идентификации N-концевого остатка используют метод Ф. Сенджера, основанный на реакции свободной аминогруппы с динитрофторбензолом. После гидролиза N-концевой остаток, связанный с динитрофенильной группой, выделяют и идентифицируют. Можно также удалить N-концевую аминокислоту с помощью фенилизотиоцианата (метод Эдмана). Избирательное удаление С-концевой аминокислоты осуществляется при помощи фермента карбоксипептидазы.
Денатурация белков – нарушение структуры нативной молекулы белка, приводящее к потере характерных для белка свойств (растворимость, биологическая активность и т.д.). Денатурация может происходить под влиянием как физических (нагревание), так и химических факторов (добавление кислот и щелочей, солей тяжёлых металлов, спирта, фенола). Внешне она проявляется как потеря растворимости, особенно в изоэлектрической точке.
Виды учебной деятельности на занятии
1. Напишите структурную формулу любой аминокислоты, назовите её по Международной номенклатуре. Напишите для этой кислоты (если это возможно) один изомер положения функциональной группы, один изомер функциональной группы и один изомер строения углеродного скелета. Является ли эта аминокислота оптически активной аминокислотой? Если да, изобразите и назовите соответствующие энантиомеры.
2. Какую среду покажет раствор глутаминовой кислоты (или др. аминокислоты) в дистиллированной воде? В какой ионной форме существует эта аминокислота в желудочном соке (рН = 1)? В какой ионной форме существует эта аминокислота при рН = 11?
3. Напишите формулу трипептида ала-глу-тир, определите для него значение заряда и изоэлектрической точки.
 4. Написать пары аминокислот, радикалы которых могут образовать водородные (или ионные или дисульфидные) связи или способны к гидрофобному взаимодействию.
4. Написать пары аминокислот, радикалы которых могут образовать водородные (или ионные или дисульфидные) связи или способны к гидрофобному взаимодействию.
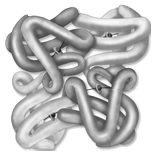

 5. Определить, какие структуры белка представлены на рисунках:
5. Определить, какие структуры белка представлены на рисунках:
а) б) в) г)
Дата добавления: 2019-09-13; просмотров: 193; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
