Свойства веществ с ионной связью: твердые, тугоплавкие, не имеют запаха, часто хорошо растворимые в воде.
Эквивалент. Эквивалентная масса. Эквивалентный объём (привести примеры). Закон эквивалентов.
Эквивалент вещества – такое его количество, которое присоединяет 1 моль атомов водорода или полмоля атомов кислорода.
Эквивалентная масса – масса одного эквивалента элемента или вещества, которая выражается в г/моль
Ээл-та= М/В
Ээ – эквивалентная масса
М – атомная масса элемента
В – валентность элементов
Эоксида=Ээл-та+Эо=Ээл-та+8(o-кислород)
Эсоли=Мсоли/( n (Ме)• B (Ме))
Эосн=Мосн/ n ( OH ) (n(OH)-кол-во защищенных OH групп)
Экисл=Мк/ n ( H) (n(H)- число замещенных ионов H+)
Эокислителя=Мокисл/ n (℮)
Эвосстановителя=Мвостанов/ n (℮)
n(e)-кол-во отданных/принятых электронов одной молекулы вещества
У элементов с постоянной валентностью эквивалентная масса постоянна. У элементов с переменной валентностью несколько эквивалентных масс.
Эквивалентный объём показывает, какой объем (н.у.) заполняет один эквивалент вещества (используется, если вещество находится в газообразном или жидком состоянии)
Эобъем=Ээл-та•22,4/Мвещ-ва
Эобъем(О)=8•22.4/М(О2)=5.6л/моль
Закон эквивалентов:
· Вещества реагируют между собой в эквивалентном соотношении
· Массы 2ух реагирующих веществ относятся друг к другу, как их эквивалентные массы m1/m2=Э1/Э2
Закон эквивалентов, если известен объём газов
m1 Э1
–– = –––
v2 Эv2
2. Примеры расчёта эквивалента элемента, оксида, основания, кислоты, соли, окислителя, восстановителя.
|
|
|
Э(S)=М(S)/В=32/6=5,33г/моль
Э(SO2)=Ээл-та+Эо=Ээл-та+8=8+8=16г/моль
Э(NaOH)=Mосн/n(OH)=(23+1+16)/1=40г/моль
Э(HCl)=M(HCl)/n(H)=(1+35.5)/1=36,5
Э(Na2SO4)=M(Na2SO4)/ (B(Na)•n(Na))=(46+32+4•16)/(1•2)=142/2=71г/моль
Э(KMnO4)=M(KMnO4)/5=158/5=31,6г/моль (MnO4-+ 8H++5℮→Mn2++4H2O)
Э(Cl2)=M(Cl2)/2=71/2=35,5г/моль (Сl20+4OH--2℮→2ClO-+2H2O)
3. Основные термодинамические характеристики. 1-й, 2-й и 3-й законы химической термодинамики.
Основных термодинамические характеристики.
1)Внутренняя энергия( 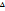 U)-энергия, которая заключена внутри веществ, за исключением кинетической и потенциальной. Это энергия притяжения электронов к ядру двух атомов в молекуле, отталкивание 2ух ядер соседних атомов.
U)-энергия, которая заключена внутри веществ, за исключением кинетической и потенциальной. Это энергия притяжения электронов к ядру двух атомов в молекуле, отталкивание 2ух ядер соседних атомов.  U = U 2- U 1 (
U = U 2- U 1 ( 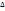 U-изменение внутренней энергии. U2-конечное составляющее системы. U1-начальное составляющее системы)
U-изменение внутренней энергии. U2-конечное составляющее системы. U1-начальное составляющее системы)
2)Энтальпия(теплосодержание)( 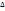 H). В экзотермических реакциях
H). В экзотермических реакциях 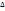 Н
Н 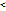 0(выделение тепла в окружающую среду).В эндотермических реакциях
0(выделение тепла в окружающую среду).В эндотермических реакциях  (тепло забрали из окружающей среды).
(тепло забрали из окружающей среды). 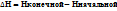
3)Энтропия-мера беспорядка системы. 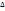 S =
S = 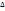 Q / T (можно измерить только изменение энтропии)Q-теплота процесса, Т-температура.
Q / T (можно измерить только изменение энтропии)Q-теплота процесса, Т-температура.
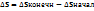
4)Энергия Гиббса- та энергия, которую тепло может затратить на совершение максимальной работы. 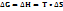 (Самопроизвольно протекают процессы, у которых
(Самопроизвольно протекают процессы, у которых 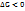 )
)
1закон химической термодинамики: Энергия, сообщаемая термодинамической системе, расходуется на изменение внутренней энергии системы и на совершение этой системой работы. p • 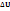 -работа системы, р- давление,
-работа системы, р- давление,  -изменение объема.
-изменение объема. 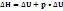
|
|
|
2 закон термодинамики: Самопроизвольно протекают химические реакции, если энтропия их увеличивается
3 закон термодинамики: В конденсированных системах при абсолютном нуле и вблизи него процесс протекает без изменения энтропии.
4. Энергия Гиббса. Направленность протекания самопроизвольных химических процессов.
Энергия Гиббса- та энергия, которую тепло может затратить на совершение максимальной работы. 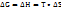 Критерий: 1)Самопроизвольно протекают процессы, у которых
Критерий: 1)Самопроизвольно протекают процессы, у которых  (принцип Бертлоо) или если увеличивается энтропия (беспорядок)
(принцип Бертлоо) или если увеличивается энтропия (беспорядок) 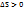
2)Объединяет два фактора( 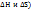 энергия Гиббса.
энергия Гиббса. 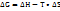
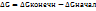 T-температура,
T-температура,  -энтальпийный фактор, Т•
-энтальпийный фактор, Т• 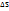 -энтропильный фактор Т(К)=С0+273
-энтропильный фактор Т(К)=С0+273
Таким образом, системы, не находящиеся в равновесии претерпевают самопроизвольные изменения, только если при этом свободная энергия уменьшается. Когда равновесие достигнуто, никакого дальнейшего самопроизвольного изменения свободной энергии системы происходить не может. Если система находится в равновесии, количество достигнутой свободной энергии равно нулю. Систему можно вывести из состояния равновесия, если ей станет доступна свободная энергия. Такое использование свободной энергии представляет собой выполнение работы.
|
|
|
5. Термохимический закон Гесса. Тепловой эффект реакции. Закон Гесса: Тепловой эффект химической реакции не зависит от пути ее протекания, а зависит от природы и состояния исходных веществ и продуктов реакции.
Пример: С→СО2 (1путь: С+О2→СО2,  ; 2путь: С+1/2•О2→СО,
; 2путь: С+1/2•О2→СО,  ; СО+1/2•О2→СО2,
; СО+1/2•О2→СО2, 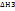 )
) 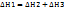
Тепловой эффект реакции: выделение или поглощение кол-ва теплоты Q, которое сопровождает протекания любой химической реакции в случае постоянного объема или постоянного давления системы. Q = 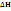 (тепловой эффект реакции =изменение энтальпии системы) Q[кДж, ккал] 1кал=4,184Дж
(тепловой эффект реакции =изменение энтальпии системы) Q[кДж, ккал] 1кал=4,184Дж
Экзотермические реакции идут с выделение тепла( 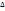 Н
Н 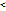 0). Выделившееся количество теплоты расходуется на нагрев химических систем и окружающей среды. Температура реакционной смеси и сосуда, в котором протекает реакция, увеличивается.
0). Выделившееся количество теплоты расходуется на нагрев химических систем и окружающей среды. Температура реакционной смеси и сосуда, в котором протекает реакция, увеличивается.
Эндотермические реакции идут с поглощением тепла(  ). Происходит охлаждение системы и окружающей среды.
). Происходит охлаждение системы и окружающей среды.
Теплота образования вещества- тепловой эффект реакции получения одного моля вещества из простого вещества.
|
|
|
6. Скорость химической реакции. Закон действия масс (кинетический).
Скорость химической реакции изучает кинетика. Скорость химической реакции- изменение концентрации реагирующих веществ в единицу времени. 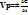
Закон действия масс: Скорость реакции прямопропорциональна произведению концентрации реагирующих веществ к степени коэффициентов, взятых из уравнения реакции. Реакция: аА+вВ→сС+ dD(а- коэффициент, А –вещество) V р=К•[ A ]а•[ B ]в []-концентрация, К-коэффициент пропорциональности Примечание: на скорость реакции не влияет концентрация твердых веществ.
7. Зависимость скорости химической реакции от температуры. Температурный коэффициент. Закон Вант-Гоффа. Теория активации
Зависимость скорости реакции от температуры более точно выражает уравнение Аррениуса: Ае-Е/ RT (К-константа скорости, А- постоянная, не зависящая от температура, е-основание натурального log(e=2,71828), Е-энергия активации,R- газовая постоянная, Т-абсолютная температура)
Температурный коэффициент скорости реакции- отношение, показывающее, во сколько раз увеличилась константа скорости при увеличении температуры на 100.
Закон Вант-Гоффа: при повышении температуры на каждые 10 градусов, скорость реакции увеличивается в 2-4 раза. Vt 2/ Vt 1= j ( t 2- t 1)/10( j- температурный коэффициент(=2-4), t2-конечная температура, t1- начальная температура).
Теория активации объясняет сильное увеличение скорости реакции с возрастанием температуры. В химическое взаимодействие вступают только активные молекулы(частицы), обладающие энергией, достаточной для осуществления данной реакции.
Активация-процесс, при котором неактивные частицы делаются активными, сообщая им необходимую дополнительную энергию. Одним из способов активации- увеличение температуры: при увеличении температуры число активных частиц сильно возрастает, благодаря чему резко увеличивается скорость реакции.
10. Смещение химического равновесия. Принцип Jle Шателье.
Предсказать направление смещения равновесия при изменении одного из параметров (температура, давление, концентрация) позволяет принцип Ле Шателье: если на систему, находящуюся в равновесии, оказано воздействие из вне, то химическое равновесие смещается в сторону ослабления этого воздействия, то есть обратимая реакция оказывает противодействие.
Вывод: 1)При увеличении температуры химическое равновесие смещается в направлении эндотермической реакции, а при уменьшении температуры- в сторону экзотермической реакции.
2)Увеличение давления сдвигает равновесие в сторону образования веществ, обладающих меньшим объемом.
3)В гомогенной системе при увеличении концентрации одного из исходных веществ равновесие сдвигается в направлении одного из продуктов реакции, а при увеличении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
8. Явление катализа. Катализаторы, принцип действия. Теория переходного состояния и образования активированных комплексов. Биокатализаторы.
Катализ- процесс ускорения реакции с помощью катализаторов. По агрегатному состоянию, в котором находятся катализатор и реагирующие вещества, различают гомогенный или гетерогенный катализы. При гомогенном катализе катализатор и реагирующие вещества находятся в одной фазе, например газовая смесь или раствор. При гетерогенном катализе катализатор и реагирующие вещества находятся в разных фазах. При катализе положение химического равновесия не смещается, а только ускоряет достижение системного равновесного состояния.
Катализаторы- вещества, увеличивающие скорость химической реакции, но сами при этом не изменяются. В животном организме реакции ускоряются ферментами. Вещества, замедляющие реакцию, называются ингибиторами, а процесс замедления реакции- ингибированием. Механизмы действия катализатора многообразны. Катализаторы могут образовывать промежуточные продукты с реагентами, а по окончании всех стадий реакции такие катализаторы полностью возвращаются в исходную форму. А+К→АК;АК+В→АВ+К
Теория: Разработана Э. Вигнером, М. Поляни, Г. Эйрингом, М. Эвансом в 30-х гг. 20 в. Позволяет приближенно рассчитывать скорость элементарных термических хим. реакций, исходя из электронного строения и свойств молекул реагентов. В основе теории лежит фундаментальное для химии понятие многомерной поверхности потенциальной энергии (ППЭ) реакции.
Биокатализаторы- тоже что и ферменты. Большинство биохимических превращений в организме животного являются ферментативными. По химической природе ферменты- бели.
Свойства биокатализаторов:
1)Специфичность катализа
2) Способность ускорять реакции
Каждый из различных ферментов в живом организме катализирует превращение определённых субстратов или единственного вещества.
1)Пероксидаза катализирует реакции окисления с Н2О2
2)Каталаза- разложение Н2О2 на воду и кислород
3)Пепсин- расщепление пептидов в желудке
4)Амилазы- гидролиз крахмала
5)Химотрипсин- гидролиз сложных эфиров
9. Химическое равновесие с точки зрения термодинамики. Константа равновесия.
Химическое равновесие- такое состояние обратимой реакции, при котором с точки зрения термодинамики равны энтальпийный и энтропийный факторы, а энергия G=0.На химическое равновесие влияют: температура, давление, концентрация вещества.
Обратимые те реакции, которые протекают в прямом и в обратном направлении.
Константа равновесия химической реакции- величина К, равная отношению констант скоростей прямой К1 и обратной К2 реакцией. К=К1/К2
Если реакция протекает при постоянном давлении, константа равновесия обозначается Кр.
Концентрации исходных веществ и продуктов реакции, соответствующие установившемуся химическому равновесию, называются равновесными.
Константа равновесия химической реакции не зависит от начальных концентраций исходных веществ. Она определяется природой реагирующих веществ и температурой.
11. Агрегатные состояния. Растворы: Понятие, теория. Растворы насыщенные, ненасыщенные, пересыщенные.
Агрегатные состояния- состояния одного и того же вещества, переходы между которым сопровождаются скачкообразными изменениями объема и физических свойств вещества. (Твердое, жидкое. газообразное, плазма)
Переходы от одного состояния к другому обусловлены изменением характера теплового движения частиц и их взаимодействия.
Растворы- многокомпонентные гомогенные системы, состоящие из растворителя, растворенного вещества и продуктов их взаимодействия.
Физико-химическая теория растворов: С физической точки зрения процесс растворения заключается в диффузии растворенного вещества в растворителе. Для того, чтобы вещество могло раствориться, должна разрушиться его структура, а затем образующиеся ионы, атомы или молекулы распределяются между молекулами растворителя. Д.И. Менделеев доказал, что процесс растворения имеет химическую природу. Это подтверждают 3 признака химической реакции, обнаруживающиеся при растворении: 1)тепловые эффекты;2)Изменение объёма;3)Изменение окраски системы.
При образовании раствора разрушается структура как растворимого вещества, так и растворителя.
По содержанию растворенного вещества раствор разделяют на:1)Насыщенный- раствор, находящийся в динамическом равновесии с избытком растворяемого твердого вещества.
2)Ненасыщенный- раствор, содержание растворенного вещества в котором ниже растворимости этого вещества при данных условиях.
3)Перенасыщенный- раствор, в котором концентрация растворенного вещества выше, чем концентрация данного вещества в насыщенном растворе при тех же условиях.
12. Способы выражения концентрации растворов.
Концентрация- отношение количества растворенного вещества или его массы к объему раствора.(молярная концентрация моль/л)(массовая концентрация г/л).Молярная концентрация
м(В)
с(В) = ––––––– 1000
М(В) V
м (В) – масса растворенного вещества В, г
М (В) – молярная масса вещества В, г/моль
V – объем раствора, мл
1000 – коэффициент перевода миллилитров в литры
Массовая доля- отношение массы растворенного вещества к массе раствора. (W=m вещества/m раствора)
Массовый процент- массовая доля, выраженная в процентах, показывает сколько грамм вещества содержится в 100 грамм раствора. (С=m вещества/m раствора•100 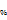 )
)
Массовая доля- отношение количества вещества, то есть числа молей растворенного вещества n2 к суммарному количеству растворенного вещества и растворителя n1. (N 2= n 2/( n 1+ n 2)- для растворенного вещества) (N 1= n 1/( n 1+ n 2)-для растворителя)
Нормальная концентрация- показывает сколько эквивалентных масс растворенное вещество содержит в 1 литре раствора. ( Cn = m /э•υраствора) э- эквивалентная масса растворенного вещества.
Титр раствора- показывает массу растворенного вещества в 1 мм раствора. (Т=m/υр) Т=Э•Сн/1000
13. Осмос. Закон Вант-Гоффа. Роль осмоса в биологических явлениях.
Осмос-«толчок»- односторонняя диффузия молекул растворителя через полупроницаемую мембрану из растворителя в раствор или из разбавленного раствора в концентрированный.
Осмотическое давление- давление, которое оказывают молекулы раствора на полупроницаемую мембрану, переходя из растворителя в раствор или из разбавленного раствора в концентрированный. Осмотическое давление больше, чем больше температура и концентрация.
Закон Вант-Гоффа: Осмотическое давление прямопропорциональноконцентрации раствора и температуре. (Росм=С m • R • T , где R-универсальная газовая постоянная(8,31); Т= t+273 ; Cm=mраствора вещества/М раствора вещества)
Роль осмоса: Стенки растительных и животных клеток представляют собой полупроницаемые мембраны, через которых свободно проходят молекулы воды и почти полностью задерживаются вещества, растворенные в клеточном соке. Осмос- причина плазмолиза (сжатия) клеток и тургора- – напряженного состояния клеток, тканей и органов вследствие давления содержимого клеток на их эластичные оболочки и обратного давления оболочек на содержимое. Давление тургора у животных достигает 50-100 кПа, у растений – в 10 раз больше.
14. Давление пара растворителя над раствором. Закон Рауля.
Известно, что если стакан с водой не закрыть, то вся вода постепенно испариться. Если стакан закрыт крышкой, то над поверхностью воды образуется насыщенный пар. Его давление – это давление насыщенного пара над чистым растворителем p0.
Закон Рауля: При постоянной температуре относительное понижение давления насыщенного пара над раствором равно молярной доле растворенного вещества N: N =( p 0 - p )/ p 0
15. Кипение и замерзание растворов.
Кипение: Условие закипания жидкости: жидкость закипает, когда давление насыщенного пара ней становится равным атмосферному( у Н2О- при 100С). Если в воде растворено любое вещество, то кривая испарения пройдет, ниже, чем у воды. 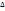 T кипен= T кип.раствора— T кип.Н2О
T кипен= T кип.раствора— T кип.Н2О
1 Закон Рауля:  кип.=Е•См (Е-эбулископическая постоянная; Сm- молярная концентрация. С m = m вещества•1000/(М вещества• mH 2 O )
кип.=Е•См (Е-эбулископическая постоянная; Сm- молярная концентрация. С m = m вещества•1000/(М вещества• mH 2 O )
Замерзание: Условие замерзание жидкости: жидкость замерзает, когда давление пара над ней становится равным давлению пара над твердой фазой.
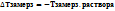 (показывает на сколько градусов ниже нуля замерз раствор)
(показывает на сколько градусов ниже нуля замерз раствор)
2 закон Рауля: понижение Т замерзания прямопропорционально концентрации раствора. 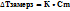 (К- приоскопическая постоянная- понижение Т замерзания любого одномоляльного раствора)
(К- приоскопическая постоянная- понижение Т замерзания любого одномоляльного раствора)
16. Отклонение поведения растворов электролитов от неэлектролитов . Изотонический коэффициент.
Растворы электролитов не подчинены закону Вант-Гоффа и законам Рауля. Росм, Ткип и Тзамерз у электролитов больше, чем у неэлектролитов. Для того, чтобы эти законы можно было бы применять к электролитам, ввели поправочный коэффициент-ί (  .
.
ί=Росм.эл/Росм.неэл= 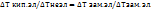
Неэлектролиты: Росм=С m•R 
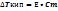
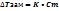
N =( p 0 - p )/ p 0
Электролиты:Росм= ί •С m • R • T
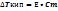 • ί
• ί
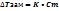 • ί
• ί
ί • N =( p 0 - p )/ p 0
17. Слабые электролиты. Степень диссоциации. Константа диссоциации.
Электролиты делятся на сильные и слабые по степени диссоциации.  (n-число молекул, распавшихся на ионы; N- общее число молекул в растворе) ( если
(n-число молекул, распавшихся на ионы; N- общее число молекул в растворе) ( если 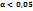 , то это слабый электролит. Если
, то это слабый электролит. Если  2,05
2,05 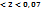 , то электролит средней силы. Если
, то электролит средней силы. Если 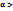 0,07, то электролит сильный.
0,07, то электролит сильный.
Слабые электролиты - электролиты, степень электролитической диссоциации которых в растворах значительно меньше единицы и сильно меняется с изменением концентрации раствора. Слабые электролиты плохо проводят электрический ток в растворе в основном виде. При растворении в воде они диссоциируют на ионы частично.
1)Все амфотерные гидроксиды
2)Кислоты(CH3COOH, H2CO3,H2S, )
3)H2O
4)Органические вещества(кроме карбоновой кислоты и их солей)
5)NH4OH
6)Соли
Степень диссоциации — это отношение числа молекул, распавшихся на ионы, к общему числу растворившихся молекул.
Константа диссоциации- она характеризует способность электролита диссоциировать на ионы. Чем больше константа, тем больше ионов в растворе.Она не зависит от концентрации электролита, поэтому является более полной характеристикой электролита, чем степень диссоциации. Не зависит от природы электролита, природы растворителя и от Т.
18.Зависимость степени диссоциации слабого электролита от концентрации раствора. Закон разбавления Оствальда.
Степень диссоциации как сильных, так и слабых электролитов зависит от концентрации раствора (степень диссоциации тем выше, чем более разбавлен раствор).
Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:
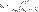 Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении.
Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении.
Из закона следует, что при разбавлении раствора слабого электролита степень его диссоциации увеличивается.
19. Равновесие в растворах слабых электролитов. Влияние одноимённого и связывающего ионов.
Слабые электролиты диссоциируют обратимо, следовательно в их растворах химическое равновесие.
1)Если увеличивается концентрация иона[H+] или увеличивается [R-], то химическое равновесие смещается влево.
2)Если уменьшается [H+] или уменьшается [R-], то смещается вправо.
Влияние одноименного иона на диссоциацию слабых электролитов: СH3COOH↔CH3COO-+H+ MO-красный, сл. есть Н+ CH3COONa↔CH3COO- +Na+ MO- оранжевый, сл нет Н+
При добавлении ацетата Na в растворе увеличилась концентрация ацетата ионов и химическое равновесие по принципу Ле Шателье сместилось влево, диссоциация CH3COOH уменьшилась.
Вывод: одноименный ион уменьшает диссоциацию слабого электролита.
Влияние связывающего иона на диссоциацию слабого электролита: Связываются ионы в осадок или слабый электролит (Н2О)
Н++ОН-→Н2О
СН3СООН↔СН3СОО-+Н+
NaOH→Na++OH-
При добавлении NaOH, в растворе СН3СООН уменьшается [Н+] (они связываются в воду). Химическое равновесие в растворе СН3СООН смещается вправо. Диссоциация СН3СООН увеличивается.
Вывод: связывающий ион усиливает диссоциацию слабого электролита.
20.Амфотерные гидроксиды с точки зрения теории электролитической диссоциации.
Особым случаем является смещение равновесия диссоциации амфотерных гидроксидов. Такие электролиты могут находиться в осадке и в растворе в виде молекул и диссоциировать по типу кислоты и основания.
Пример:
Zn(OH)2(осадок)↔2Н++ZnO22- ↔H2ZnO2↔(р-р)Zn(OH)2↔Zn2++2OH-
Добавление кислоты или щелочи вызывает растворение осадка, так как связываются ионы ОН- или Н+, что приводит к образованию слабого электролита Н2О. В 1ом случае равновесие диссоциации смещается в сторону ионной формы основания( вправо), во втором- в сторону ионной формы кислоты(влево).
21.Сильные электролиты. Активная концентрация. Ионная сила раствора.
Сильные электролиты при растворении в воде почти полностью диссоциируют на ионы. Хорошо проводят электрический ток, в растворе существуют в основном в виде ионов. 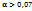 (степень диссоциации)
(степень диссоциации)
1)растворимые соли
2)сильные кислоты(H2SO4, HNO3,HCl,HBr…)
3)основание щелочных и щелочно-земельных металлов (NaOH,KOH,Ba(OH)2)
Активная концентрация ионов: В водном растворе ионы электролитов окружены полярными молекулами. а= f • Cm (f- коэффициент активности, f 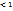 , а
, а 
В водных реакциях ионы при движении сталкиваются. Взаимодействие ионов в растворе учитывает ионная сила. μ= 1/2(c1z1² + c2z2² + ... + cnzn²) = 1/2 Σсizi²
сi-молярная концентрация i- ого иона
zi-заряд иона
22.Диссоциация воды. Ионное произведение воды. Водородный показатель рH.
Н2О-слабый электролит
Н2О↔Н++ОН-
Установлено, что в воде и разбавленных водных растворах произведение концентрации растворов –постоянная величина. При 23с она равна 10-14
[H+]• [OH-]=10-14 ионное произведение воды
Водородный показатель рН: Для обозначения кислотности среды был введен pH. Это отрицательный десятичный логарифм концентрации ионов [H+]/
pH=-lg[H+]
pH 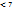 -среда кислая
-среда кислая
pH=7- среда нейтральная
pH 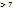 - среда щелочная
- среда щелочная
23.Гидролиз солей. Роль в живом организме.
Гидролиз- ионная реакция соли с водой.
4 случая гидролиза:
1)Гидролиз не идет: если соль образованна сильной кислотой и сильным основанием. Среда нейтральная, pH=7. Сильная кислота:HCl, HBr,HNO3,H2SO4,HClO4.
2)Гидролиз по катиону: слабое основание+ сильная кислота. pH 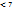 -среда кислая
-среда кислая
Гидролиз по катиону идет обратимо и по 1ой ступени (с одним слабым ионом реагирует одна молекула воды). Часто образуются основные соли.
3)Гидролиз по аниону: Анион слабой кислоты+ катион сильного основания.
Идет обратимо и по 1ой ступени( с одним слабым анионом реагирует 1 молекула воды). Часто образуются кислые соли, среда щелочная.
4)Гидролиз по катиону и аниону: слабая кислота+слабое основание. Полный гидролиз идёт до конца- до образования молекул слабой кислоты и молекул слабого основания. Среда нейтральная.
Роль в живом организме: возможность протекания реакции гидролиза солей во внутренней среде организма следует учитывать при терапии животных.
Щелочная среда крови способствует гидролизу солей, в состав которых входят слабые основания многовалентных металлов. Основные соли и гидроксиды таких металлов труднорастворимы. Образование осадков, например при случайном введении в кровь растворов таких солей может привести к закупорке сосудов, что приводит к летальному исходу.
24.Современная модель состояния электрона в атоме. Квантовые числа. Принцип Паули.
Электрон обладает корпускулярно- волновым дуалезмом.
Электронное облако- квантово- механическая модель движения электрона в атоме.
Совокупность различных положений быстро движущегося электрона в любой части пространства, окружающего ядро, рассматривается как электрическое облако. Максимальная плотность соответствует наибольшей вероятности пребывания электрона в данной части пространства.
Квантовые числа определяют состояние электрона в атоме.
Главное квантовое число( n )- характеризует энергию электрона и размер электронного облака.
n-целое число, практически от 1 до 7 соответственно номеру периода, в котором находится элемент.
Орбитальное (побочное или азимутальное) квантовое число(l) - характеризует энергетическое состояние электрона в подуровне и форму облака. Принимает значения на единицу меньше, чем n.
Магнитное квантовое число(m) - характеризует орбитали в пространстве и связано с числом l.
m = 2l + 1
Спиновое квантовое число (s) - характеризует собственное вращение электрона вокруг своей оси. Это вращение называется спин и принимает только два значения +1/2, -1/2.
Принцип Паули: В атомене может быть двух электронов с одинаковыми значениями всех 4ёх квантовых чисел
25.Распределение электронов в атоме. Правило Хунда.
Распределение электронов в атоме: распределение электронов по уровням обусловлено требованием минимума энергии: электрон должен обладать наименьшей энергией, что отвечает его наибольшей связи с ядром.(чем меньше энергия, тем ближе электрон к ядру)
Правило Хунда: при заполнении подуровня невозбужденного атома электроны располагаются так, что абсолютная величина их суммарного спина имеет максимальное значение.
26.Периодический закон с точки зрения строения атома. Причины периодичности.
Периодический закон: Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины заряда ядра атома (порядкового номера).
Основным признаком, по которому элементы больших периодов разделены на два ряда, является их степень окисления. Проследить периодичность свойств элементов можно и исходя из рассмотрения электронных конфигураций атомов.
Теория строения атомов объясняет периодическое изменение свойств элементов. Возрастание положительных зарядов атомных ядер от 1 до 107 обусловливает периодическое повторение строения внешнего энергетического уровня, а поскольку свойства элементов в основном зависят от числа электронов на внешнем уровне, то и они периодически повторяются.
В малых периодах с ростом положительного заряда ядер атомов возрастает число электронов на внешнем уровне, что объясняет изменение свойств элементов: в начале периода (кроме первого периода) находится щелочной металл, затем металлические свойства постепенно ослабевают и усиливаются свойства неметаллические. В больших периодах с ростом заряда ядер заполнение уровней электронами происходит сложнее, что объясняет и более сложное изменение свойств элементов по сравнению с элементами малых периодов. Так, в четных рядах больших периодов с ростом заряда число электронов на внешнем уровне остается постоянным и равно 2 или 1. Поэтому, пока идет заполнение электронами следующего за внешним (второго снаружи) уровня, свойства элементов в этих рядах изменяются крайне медленно. Лишь в нечетных рядах, когда с ростом заряда ядра увеличивается число электронов на внешнем уровне (от 1 до 8), свойства элементов начинают изменяться так же, как у типических.
Причина периодичности свойств элементов, как показал Бор, заключалась в периодическом повторении строения внешнего электронного уровня атома.
27. s,p,d,f-элементы, положение в периодической системе. Основные химические свойства.
В зависимости от того, какой подуровень последним заполняется электронами, все элементы делят на четыре типа (семейства):1) s-Элементы: заполняется электронами s-подуровень внешнего уровня. К ним относятся первые два элемента каждого периода. 2) р-Элементы: заполняется электронами р-подуровень внешнего уровня. Это последние 6 элементов каждого периода (кроме первого и седьмого). 3) d-Элементы: заполняется электронами d-подуровень второго снаружи уровня, а на внешнем уровне остается один или два эле трона (у Pd — нуль). К ним относятся элементы вставных декад больших периодов, расположенных между s- и р-элементами (их также называют переходными элементами). 4) f-Элементы: заполняется электронами f-подуровень третьего снаружи уровня, а на внешнем уровне остается два электрона. Это лантаноиды и актиноиды.
В периодической системе s-элементов 14, р-элементов 30, d-элементов 35, f-элементов 28. Элементы одного типа имеют ряд общих химических свойств.
Свойства: энергия ионизации атомов;
энергия сродства атомов к электрону;
электроотрицательность;
атомные (и ионные) радиусы;
энергия атомизации простых веществ степени окисления;
окислительные потенциалы простых веществ
28. Природа химической связи. Метод валентных связей.
Под химической связью понимают электрические силы притяжения, удерживающие частицы друг около друга (два или несколько атомов, ионов, молекул или любую комбинацию из них). Каждая химическая связь в структурных формулах представляется валентной чертой, например: H−H (связь между двумя атомами водорода), H3N−H+ (связь между атомом азота молекулы аммиака и катионом водорода),(K+)−(I−) (связь между катионом калия и иодид-ионом). Химическая связь образуется за счет притяжения ядер атомов к паре электронов (обозначаются точками ··), которую в электронных формулах сложных частиц (молекул, сложных ионов) изображают валентной чертой −, в отличие от собственных, неподеленных пар электронов каждого атома.
Ковалентной химической связью (образуется путем обобществления пары электронов обоими атомами); Ионной связью (если атомы теряют либо приобретают электроны, образуя ионы); Металлическая связь (относится к металлам, в твердом состоянии металлы состоят из положительно заряженных ионов, плотно упакованных в кристаллическую решетку и удерживаемых вместе свободными электронами, которые «плавают» вокруг ионов в «электронном море»); Водородная связь (существенное участие принимает атом водорода (Н), уже связанный ковалентной связью с другим атомом). Представления о механизме образования молекулы водорода были распространены на более сложные молекулы. Разработанная на этой основе теория химической связи получила название метода валентных связей (метод ВС). В основе метода ВС лежат следующие положения:1) Ковалентная связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атома. 2) Ковалентная связь тем прочнее, чем в большей степени перекрываются электронные облака.
29. Обменный и донорно-акцепторный механизмы образования ковалентной связи.
Обменный за счёт перекрывания одноэлектронных облаков с противоположными спинами; донорно-акцепторный за счет двухэлектронного облака одного атома и свободной орбитали другого. Обменный механизм - это когда каждый из взаимодействующих атомов поставляет по одному электрону, донорно-акцепторный механизм - это когда электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору).
К обменному механизму относят случаи, когда в образовании электронной пары от каждого атома участвует по одному электрону. Связь возникает благодаря образованию общей электронной пары за счет объединения неспаренных электронов.
По донорно-акцепторному механизму происходит образование иона аммония. Донор (азот) имеет электронную пару, акцептор – (Н+) свободную орбиталь, которую пара электронная азота может занять. В ионе аммония три связи азота с водородом образованы по обменному механизму, а одна по донорно-акцепторному. Все 4 связи равноценны.
30. Ковалентная связь. Её разновидности и свойства.
Ковалентная связь – химическая связь, образованная перекрытием пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой. Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений. Ковалентные связи подразделяются на неполярные и полярные.
Виды: 1. Простая ковалентная связь. Для ее образования каждый из атомов предоставляет по одному неспаренному электрону. При образовании простой ковалентной связи формальные заряды атомов остаются неизменными.
1)Если атомы, образующие простую ковалентную связь, одинаковы, то истинные заряды атомов в молекуле также одинаковы, то такая связь называется неполярной ковалентной связью.
2) Если атомы различны, то степень владения обобществленной парой электронов определяется различием в электроотрицательностях атомов. Если соединение образуется между двумя различными неметаллами, то такое соединение называется ковалентной полярной связью.
2. Донорно-акцепторная связь. Для образования этого вида ковалентной связи оба электрона предоставляет один из атомов — донор. Второй из атомов, участвующий в образовании связи, называется акцептором. В образовавшейся молекуле формальный заряд донора увеличивается на единицу, а формальный заряд акцептора уменьшается на единицу.
3. Семиполярная связь.Её можно рассматривать как полярную донорно-акцепторную связь. Этот вид ковалентной связи образуется между атомом, обладающим неподелённой парой электронов (азот, фосфор, сера, галогены и т. п.) и атомом с двумя неспаренными электронами (кислород, сера).
31.Валентность атомов в стационарном и возбуждённом состояниях. Кратность связи. сигма и пи связь.
Валентность характеризует способность атомов элементов к образованию соединений. Валентность определяется как число химических связей, которыми атом соединен с другими. Валентность атома химического элемента не может быть выше полного числа орбиталей на внешнем уровне этого элемента. У Атома в возбуженном состояии электроны перескакивают на другие свободные орбитали и он проявляет валентность равную числу неспаренных электронов.Например, в стационарном состоянии атом углерода проявляет валентность равную 2(имеет 2 неспаренных электрона), а в возбужденном равную 4.(имеет 4 неспаренных электрона).В стационарном состоянии 2s(2)2p(2) ---->2s(1)2p(3).
Химическая связь, осуществляемая более чем одной электронной парой, называется кратной связью. Кратность (порядок) связи — это число общих электронных пар, участвующих в образовании связи. Кратная связь может быть двойной, тройной, иметь более высокую кратность и даже дробную кратность. Кратная связь состоит из одной s-связи, p-связи и иногда d-связи.
Сигма- и пи-связи (s- и p-связи), ковалентные химические связи, характеризующиеся определенней, но различной пространственной симметрией распределения электронной плотности.
35.Водородная связь, её биологическая роль.
Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом.Такая связь возникает между молекулами, в состав которых входят атомы водорода и элементов с высокойэлектроотрицательностью(F,Cl,O2,N). Внутримолекулярные водородные связи играют важнейшую биологическую роль, так как определяют, например, спиральную структуру полимерных молекул белков.С помощью межмолекулярных водородных связей соединены цепи нуклеиновых кислот, образующих двойную спираль. Посредством этой связи взаимодействуют спирали ДНК и РНК, белки, формируются мембраны биологических клеток.
32.Гибридизация атомных орбиталей. Примеры. Пространственная конфигурация молекул с sp, sp², sp3- гибридизацией (примеры).
Гибридизация - это выравнивание атомных орбиталей по энергии с последующим их смешиванием. ΣАО = Σгибр.орб., например s + 3p + d = 5sp3d , s + 3d = 4sd3
Очень часто электроны, участвующие в образовании ковалентной связи, находятся в различных состояниях, например, один в s-, другой в p-орбиталях. Но связи в молекуле по прочности остаются равнозначны. Это объясняет представление о гибридизации атомных орбиталей, введенное в химию Л.Полингом. Гибридизацию валентных орбиталей рассмотрим на примере образования молекул хлорида бериллия BeCl2 хлорида бора BeCl3 и метана CH4.
В молекуле BeCl2 есть две связи Be—Cl. Форма этой молекулы должна быть такой, чтобы обе эти связи и атомы хлора на их концах располагались как можно дальше друг от друга:
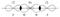
Это возможно только при линейной форме молекулы, когда угол между связями (угол ClBeCl) равен 180о.Другой пример: в молекуле BCl3 имеется 3 связи B—F. Они располагаются как можно дальше друг от друга и молекула имеет форму плоского треугольника, где все углы между связями (углы FBF) равны 120о :
 Еще один пример: в молекуле CH4 имеется 4 связи C—H. Все эти 4 связи расположатся максимально далеко друг от друга только тогда, когда молекула примет форму тетраэдра, у которого в центре находится атом C, а в вершинах - атомы H. Кстати, в "квадратной" молекуле расстояние между атомами водорода было бы меньше, поэтому реальная молекула CH4 имеет форму тетраэдра:
Еще один пример: в молекуле CH4 имеется 4 связи C—H. Все эти 4 связи расположатся максимально далеко друг от друга только тогда, когда молекула примет форму тетраэдра, у которого в центре находится атом C, а в вершинах - атомы H. Кстати, в "квадратной" молекуле расстояние между атомами водорода было бы меньше, поэтому реальная молекула CH4 имеет форму тетраэдра:
В молекуле CH4 угол НСН такой же, как в математическом тетраэдре: 109о28’
 Геометрическая фигура, состоящая из 1 вершины - точка (.) если 2(.) - отрезок, 3(.) - плоский треугольник, 4 (.) - либо плоский квадрат и его производные, либо тетраэдр или тригональная пирамида (искаженный тетраэдр).
Геометрическая фигура, состоящая из 1 вершины - точка (.) если 2(.) - отрезок, 3(.) - плоский треугольник, 4 (.) - либо плоский квадрат и его производные, либо тетраэдр или тригональная пирамида (искаженный тетраэдр).
33.Ионная связь. Ненаправленность и ненасыщаемость ионной связи. Свойства веществ с ионным типом связи.
Ионная связь – это связь, которая образуется при взаимодействии атомов, резко отличающихся друг от друга по значениям электроотрицательности. В результате взаимодействия образуются ионы.
Ионной связи характерны:
1) ненасыщаемость (каждый ион, взаимодействуя с противоположным во всех направлениях, не компенсирует силовые поля)
2) ненаправленность (любой ион в любом направлении способен притягивать к себе ион противоположного заряда)
Свойства веществ с ионной связью: твердые, тугоплавкие, не имеют запаха, часто хорошо растворимые в воде.
34.Виды межмолекулярного взаимодействия.
1) ориентационные (полярные молекулы вследствие электростатического взаимодействия разноименных концов диполей ориентируются с пространстве так, что отрицательные концы диполей одних молекул повернуты к положительным концам диполей других молекул )
2) индукционные (наблюдаются также и у веществ с полярными молекулами, но при этом оно обычно значительно слабее ориентационного. Полярная молекула может увеличивать полярность соседней молекулы. Иными словами, под влиянием диполя одной молекулы может увеличиваться диполь другой молекулы, а неполярная молекула может стать полярной)
3) дисперсионные (эти силы взаимодействуют между любыми атомами и молекулами независимо от их строения. Они вызываются мгновенными дипольными моментами, согласованно возникающими в большой группе атомов)
36. Комплексные соединения. Теория Вернера. Роль в живом организме.
Компл е ксные соедин е ния, координационные соединения, химические соединения, состав которых не укладывается в рамки представлений об образовании химических связей за счет неспаренных электронов. Обычно более сложные К. с. образуются при взаимодействии простых химических соединений.
Теория: Комплексные соединения мало диссоциируют в растворе (в отличие от двойных солей). Комплексные соединения могут содержать комплексный малодиссоциирующий анион ([Fe(CN)6]3−), комплексный катион ([Ag(NH3)2]+) либо вообще не диссоциировать на ионы (соединения типа неэлектролитов, например карбонилы металлов). Комплексные соединения разнообразны и многочисленны.Комплексные соединения имеют важное значение для живых организмов, так гемоглобин крови образует комплекс с кислородом для доставки его к клеткам, хлорофилл находящийся в растениях является комплексом.
37. Диссоциация комплексных соединений. Константа нестойкости комплексных ионов.
При растворении в воде комплексных соединений, обычно они распадаются на ионы внешней и внутренней сфер подобно cильным электролитам, так как эти ионы связаны ионогенно, в основном, электростатическими силами. Это оценивается как первичная диссоциация комплексных соединений. Вторичная диссоциация комплексного соединения – это распад внутренней сферы на составляющие ее компоненты. Этот процесс протекает по типу слабых электролитов, так как частицы внутренней сферы связаны неионогенно (ковалентной связью).
Константы нестойкости для различных комплексных ионов различны и могут служить мерой устойчивости комплекса. Наиболее устойчивые в растворах комплексные ионы имеют наименьшие константы нестойкости.
38. Химическая связь в комплексных соединениях (примеры).
Во внутренней сфере между комплексообразователем и лигандами формируются полярные ковалентные связи. Частицы внешней сферы удерживаются около комплекса за счет электростатического ионного взаимодействия, т.е. характер связи преимущественно ионный.
Рассмотрим строение комплекса [Ag(NH3)2]+. Электронная конфигурация иона серебра .
Свободные орбитали иона серебра являются акцепторами электронных пар атомов азота молекул аммиака.
5s- и 5p- орбитали иона Ag+ образуют две гибридные sp- орбитали, т.е. находятся с состоянии sp L q - гибридизации.
Комплекс имеет линейное строение.
Таким образом, электронное строение и тип гибридизации АО комплексообразователя определяют к.ч. и геометрическую форму комплекса.
39. Окислительно- восстановительные реакции. Виды окислительно- восстановительных реакций.
Окисли́тельно-восстанови́тельные реа́кции (ОВР) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Виды: 1) Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
Н2S + Cl2 → S + 2HCl
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
2H2O → 2H2 + O2
2) Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
Cl2 + H2O → HClO + HCl
3) Репропорционирование (конпропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления, например:
NH4NO3 → N2O + 2H2O
40. Важнейшие окислители и восстановители. Окислительно- восстановительная двойственность.
Восстановители
Металлы,
водород,
уголь.
Окись углерода (II) (CO).
Сероводород (H2S);
оксид серы (IV) (SO2);
сернистая кислота H2SO3 и ее соли.
Галогеноводородные кислоты и их соли.
Катионы металлов в низших степенях окисления: SnCl2, FeCl2, MnSO4, Cr2(SO4)3.
Азотистая кислота HNO2;
аммиак NH3;
гидразин NH2NH2;
оксид азота(II) (NO).
Катод при электролизе.
Окислители
Галогены.
Перманганат калия(KMnO4);
манганат калия (K2MnO4);
оксид марганца (IV) (MnO2).
Дихромат калия (K2Cr2O7);
хромат калия (K2CrO4).
Азотная кислота (HNO3).
Серная кислота (H2SO4) конц.
Оксид меди(II) (CuO);
оксид свинца(IV) (PbO2);
оксид серебра (Ag2O);
пероксид водорода (H2O2).
Хлорид железа(III) (FeCl3).
Бертоллетова соль (KClO3).
Анод при электролизе.
Окислительно-восстановительная двойственность – это способность атома, находящегося в промежуточной степени окисления, быть как восстановителем, так и окислителем, в зависимости от того, с каким веществом он реагирует.
41. Стандартные электродные потенциалы. Направление протекания окислительно восстановительных реакций.
Стандартный электродный потенциал-это потенциал электрода при стандартных условиях, его обозначают символом Е°.
Окислительно-восстановительная реакция будет самопроизвольно протекать в таком направлении, при котором полуреакция с более высоким значением окислительно-восстановительного потенциала выступает в качестве окислителя по отношению к полуреакции с более низким потенциалом.
Стандартные электродные потенциалы
| Уравнение электродного процесса | Стандартный потенциалЕ при 25С, В |
| Li+ + eLi | –3,045 |
| Rb+ + eRb | –2,925 |
| K+ + e K | –2,924 |
| Cs+ + e Cs | –2,923 |
| Ca+2 + 2e Ca | –2,866 |
| Na+ + eNa | –2,714 |
| Mg2+ + 2eMg | –2,363 |
| Al3+ + 3eAl | –1,663 |
| Ti2+ + 2eTi | –1,630 |
| Mn2+ + 2eMn | –1,179 |
| Zn2+ + 2eZn | –0,763 |
| Cr3+ + 3eCr | –0,744 |
| Fe2+ + 2eFe | –0,440 |
| Cd2+ + 2eCd | –0,403 |
| Co2+ + 2eCo | –0,277 |
| Ni2+ + 2eNi | –0,250 |
| Sn2+ + 2eSn | –0,136 |
| Pb2+ + 2ePb | –0,126 |
| Fe3+ + 3eFe | –0,037 |
| 2H+ + 2e H2 | 0,000 |
| Bi3+ + 3eBi | 0,215 |
| Cu2+ + 2eCu | 0,337 |
| Ag+ + eAg | 0,799 |
| Hg2+ + 2eHg | 0,850 |
| Pt2+ + 2ePt | 1,188 |
| Au+ + eAu | 1,692 |
Направление ОВР можно определять по электродвижущей силе реакции(ΔЕ), которая связана с изменением энергии Гиббса реакции ΔG соотношением:
-ΔG=nFΔE
n–число электронов;F – постоянная Фарадея(9,65 * 104 Кл/моль)
1.Общая характеристика подгруппы галогенов.
Галоге́ны— химические элементы 17-й группы периодической таблицы химических элементов Реагируют почти со всеми простыми веществами, кроме некоторых неметаллов. Все галогены — энергичные окислители, поэтому встречаются в природе только в виде соединений. С увеличением порядкового номера химическая активность галогенов уменьшается, химическая активность галогенид-ионов F−, Cl−, Br−, I− уменьшается. К галогенам относятся фтор F, хлор Cl, бром Br, иод I, астат At.
2. Способы получения галогенов. Применение.
Хлор. Хлор можно получить в лабораторных условиях окислением концентрированной соляной кислоты манганатом(VII) калия.
Бром. Для получения брома в лабораторных условиях добавляют оксид марган-Ha(IV) к смеси концентрированной серной кислоты с бромидом калия.
Иод. Иод получают тем же способом, что и бром, только вместо бромида калия используется иодид калия. Полученный иод отделяют от реакционной смеси возгонкой.
Для этого в промышленности используют постоянный электрический ток.
Фтор вводят в состав зубной пасты, а хлором дезинфицируют воду в плавательных бассейнах. Бром применяют в качестве успокоительного средства, а спиртовой раствор йода как антисептическое средство.
3. Водородные соединения галогенов. Свойства, применение.
Галогеноводороды, галогеноводородные кислоты и галогениды. Все галогеноводороды при обычных условиях газообразны. Химическая связь, осуществляемая в их молекулах, — ковалентная полярная, причем полярность связи в ряду НF - НСl - НВr - НI падает. Прочность связи также уменьшается в этом ряду. Вследствие своей полярности, все галогеноводороды, в отличие от галогенов, хорошо растворимы в воде.
4. Хлорная вода. Получение, свойства, применение.
Хлорная вода — водный раствор хлора. Содержит молекулы хлора (Cl2), хлорноватистую кислоту (HClO) и хлороводород (HCl).
Получение: в хлораторе, путем насыщения воды газообразным хлором
Применение: Используется для обеззараживания воды в бассейнах способом хлорирования, очень слабый раствор хлора в питьевой воде обеспечивает ее обеззараживания без нанесения большого ущерба здоровью.
Химические свойства: Сильный окислитель, прежде всего благодаря образованию атомарного кислорода в момент выделения.
5.Хлорная известь. Получение, свойства, применение.
Хло́рная и́звесть Ca(Cl)OCl — смесь гипохлорита, хлорида и гидроксида кальция. Относится к так называемым смешанным солям.
Получение:Получают взаимодействием хлора с гашеной известью (гидроксидом кальция):
Дата добавления: 2019-09-13; просмотров: 193; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
