Закономерности роста чистых культур при периодическом
Культивирование аэробных и анаэробных микроорганизмов.
Поскольку микроорганизмы по-разному относятся к молекулярному кислороду, это определяет и различия в способах их культивирования.
Культивирование аэробных микроорганизмов проводят следующим образом:
• на поверхности плотных сред или в тонком слое жидких сред, когда микроорганизмы получают кислород непосредственно из воздуха;
• в жидких средах (глубинное культивирование). В этом случае микроорганизмы используют растворенный в среде кислород. В связи с низкой растворимостью кислорода, для обеспечения роста аэробных бактерий в толще среды, требуется постоянное аэрирование.
Культивирование анаэробных микроорганизмов более сложно, чем выращивание аэробов, так как здесь должен быть сведен до минимума контакт микроорганизмов с молекулярным кислородом. Для создания анаэробных условий используют различные приемы. Их подразделяют на физические, химические и биологические. Все они основаны на том, что микроорганизмы культивируют в каком-то замкнутом пространстве.
К физическим методам создания анаэробных условий относится культивирование в микроанаэростате – вакуумном аппарате для выращивания микроорганизмов, в котором воздух замещен газовой смесью. Наиболее часто используемая смесь имеет следующий состав: азот с 5 % СО2 и 10 % Н2.
К химическим методам относится:
1) Использование химических веществ, поглощающих молекулярный кислород. В качестве поглотителей молекулярного кислорода в лабораторной практике используют щелочной раствор пирогаллола, дитионит натрия (Na2S2O4), металлическое железо, хлорид одновалентной меди и некоторые другие реактивы.
|
|
|
2) Использование восстанавливающих агентов, которые добавляют в большинство сред для снижения окислительно-восстановительного потенциала среды: тиогликолат натрия, цистеин, аскорбиновая кислота.
Как пример биологического способа создания анаэробных условий - выращивание совместно с аэробными или факультативно-анаэробными бактериями. Например, питательную среду в чашке Петри разделяют желобком на две половины, на одну половину засевают какой-либо аэробный микроорганизм, на другой – анаэроб. Края чашки заливают парафином. Рост анаэробного микроорганизма начнется только после полного использования кислорода аэробом.
Для культивирования анаэробных бактерий используют и другие методы, ограничивающие доступ воздуха к растущей культуре:
• выращивание в высоком слое среды;
• выращивание в толще плотной среды;
• культивирование в вязких средах, в которых диффузия молекулярного кислорода в жидкость уменьшается с увеличением ее плотности;
|
|
|
• заливка среды с посевом высоким слоем стерильного вазелинового масла или парафина.
12
Культивирование микроорганизмов можно поводить поверхностным или глубинным, периодическим или непрерывным методами, в аэробных или анаэробных условиях. Большое значение при выборе способа культивирования имеет отношение выбранного для культивирования микроорганизма к молекулярному кислороду и конечная цель культивирования: накопление биомассы или получение определенного метаболита (спирта, кислорода, фермента и т.д.).
При культивировании поверхностным способоммикроорганизмы выращивают на поверхности плотной, сыпучей среды или в тонком слое жидкой среды, при этом микроорганизмы получают кислород непосредственно из воздуха. В жидких средах аэробные микроорганизмы часто растут, образуя на поверхности пленку. Факультативные анаэробы развиваются не только на поверхности, но и в толще жидкой среды, вызывая более или менее равномерное ее помутнение. На сыпучих средах поверхностным методом получают ферментные препараты. Поверхностное культивирование микроорганизмов применяется как в лабораторных условиях, так и в промышленности
|
|
|
Все способы культивирования аэробных микроорганизмов сводятся к увеличению поверхности соприкосновения питательной среды с кислородом воздуха. При глубинном культивировании в жидких средах микроорганизмы используют растворенный кислород. Вместе с тем растворимость кислорода в воде невелика, поэтому, чтобы обеспечить рост аэробных микроорганизмов в толще среды, ее необходимо постоянно аэрировать (подводить кислород в глубь жидкой среды). Сочетание питательной среды и растущих в ней микроорганизмов называют культуральной жидкостью.
Наиболее широко распространенный в лабораторной практике способ глубинного культивирования - выращивание на качалках, обеспечивающих встряхивание или вращение колб или пробирок, обеспечивая большее соприкосновение среды с воздухом и насыщение ее кислородом. Аэрировать культуру микроорганизмов можно продуванием (барботированием) через толщу среды стерильного воздуха. Этот способ используется в лабораторных исследованиях, но особенно широкое применение он нашел в промышленной микробиологии при получении биомассы, в производстве антибиотиков, ферментов, кислот.
Преимущества глубинного культивирования заключаются в том, что этот способ не требует больших площадей и громоздкого оборудования, объем ферментаторов можно увеличить за счет увеличения высоты, простота обслуживания, возможность автоматизации, удобство выделения целевого продукта из культуральной жидкости.
|
|
|
Глубинное культивирование микроорганизмов может быть периодическим и непрерывным. При периодическом методе культивирования весь объем питательной среды засевают чистой культурой, и выращивание ведут в оптимальных условиях определенный период времени до накопления нужного количества целевого продукта. Поскольку культивирование ведется на невозобновляемой питательной среде (в стационарных условиях), клетки все время находятся в меняющихся условиях. Сначала они имеют в избытке все питательные вещества, затем постепенно наступает недостаток питания и отравление вредными продуктами обмена.
13
Количественный учет микрофлоры воздуха. Для исследования общего количества микроорганизмов в воздухе применяют наиболее простой, хотя и недостаточно точный, метод «оседания» (седиментационный метод), предложенный Кохом (1881). Стерильные чашки Петри с питательной средой (МПА (мясо-пептонный агар) – для бактерий, СА (сусловый агар) – для грибов) открывают в исследуемом помещении на 5 минут (чашки располагают на высоте, соответствующей уровню дыхания сидящего или стоящего человека). Следят за тем, чтобы при открывании крышки чашки Петри не было движения воздуха. После этого чашки закрывают и помещают на сутки в термостат при 37 °С, что дает возможность развиться бактериальной флоре. Затем чашки переставляют в термостат и выдерживают при температуре 25 °С. В таких условиях прорастают бактерии, требующие для своего развития более низкие температуры, а также плесневые грибы. Обычно опыт ставится в двух повторностях. Затем подсчитывают выросшие колонии микроорганизмов. Счет колоний на чашках производят с помощью прибора для счета колоний бактерий или лупы. Для лучшей видимости считают колонии на темном фоне (под чашку кладут темную бумагу), чашки помещают дном кверху. Каждую колонию отмечают на две чашки чернилами или тушью.
Седиментационный метод – самый простой метод для суждения о зараженности воздуха микроорганизмами, но он позволяет иметь лишь ориентированное представления о содержании микрофлоры в воздухе. С его помощью определяется только 35-60% микроорганизмов в воздухе. Хотя этот метод и не дает полного представления ни о количестве микроорганизмов, находящихся в воздухе, ни об их видовом разнообразии, однако с его помощью можно учесть микрофлору тяжелой оседающей пыли, которая не захватывается и не учитывается другими аспирационными методами. Метод не точен и абсолютно не пригоден для изучения атмосферного воздуха, где имеют место большие колебания в скорости его движения. Этот метод может быть использован для анализа микрофлоры воздуха в закрытых помещениях в тех случаях, когда отсутствуют более совершенные приборы или нет электроэнергии.
Используя данный метод можно рассчитать количество микроорганизмов в 1 м3 воздуха. Обычно производят перерасчет по Омелянскому: допускают, что на площадь в 100 см2 за 5 мин осаждается примерно столько бактерий, сколько их содержится в 10 л воздуха (0,01 м3). Зная площадь чашки Петри, определяют количество микроорганизмов в 1 м3 воздуха. Для этого: 1) определяют площадь агаровой пластинки в чашке Петри по формуле S= π х r2 = 3,14 х r2 (радиус чашки Петри равен 0,5 дм, соответственно, площадь агаровой пластинки равна 0,785 дм2); 2) вычисляют количество колоний на площади 1 дм2; 3) пересчитывают количество бактерий на 1 м3воздуха, умножая найденное количество колоний на площади 1 дм2 на 100; 4) результаты определения микробного числа воздуха оценивают по суммарному числу колоний, выросших на обеих чашках; 5) обязательно учитывают, что полученные показатели занижены примерно в 3 раза.
После проведенного подсчета, при наличии в 1 м3 воздуха менее 250 клеток воздух считается чистым, 250–500 клеток – загрязненным в средней степени, при количестве клеток более 500 – загрязненным. По данным А. Ф. Войткевича, в 1 м3 морского воздуха содержится 1–2 клетки, в таком же объеме воздуха в городском парке – 200, городской улице – 5 тыс., жилом помещении – 20 тыс., скотном дворе – более 1 млн. клеток.
Для исследования микрофлоры воздуха можно использовать различные аспирационные методы, например, аппарат Кротова, работа которого основана на принципе ударно-прибивного действия воздушной струи. Подобные методы наиболее надежны и точны.
При качественном анализе микрофлоры воздуха отмечают культуральные особенности роста микроорганизмов на плотных питательных средах, общее количество типов колоний, их морфологические особенности и количественное соотношение. Отдельные колонии микроскопируют с иммерсионной системой либо пересевают на дифференциально-диагностические питательные среды для выделения чистых культур микроорганизмов, видовой состав которых можно определить, используя специальные определители.
14 Под ростом понимают согласованное увеличение количества всех химических компонентов, формирующих клеточные структуры. Рост клеток обычно сопровождается увеличением их массы и размеров. Однако эта закономерность наблюдается не всегда, так как в некоторых условиях клетки способны просто накапливать запасные или резервные вещества, т. е. масса может увеличиваться, но роста при этом не наблюдается. В подходящей же среде, к которой бактерии полностью адаптированы, они находятся в состоянии сбалансированного роста. В период сбалансированного роста удвоение биомассы сопровождается удвоением всех других учитываемых параметров популяции, например количества белка, ДНК, РНК и внутриклеточной воды. Иными словами, культуры, растущие сбалансированно, сохраняют постоянный химический состав. В культуре, растущей сбалансированно, скорость прироста вещества клеток в любой данный момент пропорциональна числу или массе имеющихся в это время бактерий. Коэффициент пропорциональности называют удельной скоростью роста (μ).
В лабораторных и промышленных условиях используют два основных способа культивирования микроорганизмов: периодическое (статическое) и непрерывное (проточное).
Рост бактерий в периодической культуре происходит до тех пор, пока содержание какого-нибудь из необходимых им компонентов питательной среды не достигнет минимума, после чего рост прекращается.
Лаг-фаза, или фаза задержанного роста, охватывает промежуток времени между посевом бактерий и достижением ими максимальной скорости деления. В клетках бактерий в этот период идут в основном процессы, связанные с приспособлением их к условиям культивирования (составу среды, температуре, рН и т. п.). происходит быстрое увеличение количества РНК (в 8–12 раз).
Docs.gsu.bu
деления клеток не происходит, отмечаются лишь процессы, подготавливающие клетку к размножению.
Начальная фаза размножения, или фаза ускорения роста, когда клетки начинают делиться с постепенно увеличивающейся скоростью.
Фаза экспоненциального (логарифмического) роста характеризуется постоянной максимальной скоростью деления клеток и скоростью роста. Для различных видов бактерий эти величины могут варьировать в значительных пределах. Например, бактерии E. coli при 37 ºС делятся примерно каждые 20 мин, а бактерии родов Nitrosomonas и Nitrobacter –5–10 ч. Культуры бактерии E. coli вступают в стационарную фазу при концентрации клеток 2–5 . 109/мл.
Во время экспонециальной фазы все клетки в популяции имеют приблизительно одинаковый размер, содержат максимальное количество РНК, количество белка в них также максимально и постоянно. Во время экспоненциальной фазы клетки наиболее жизнеспособны и обладают
высокой биохимической активностью.
Стационарная фаза наступает тогда, когда число жизнеспособных клеток достигает максимума и не увеличивается, так как скорость размножения бактерий равна скорости их отмирания.
период несбалансированного роста, когда компоненты клеток синтезируются с различными скоростями, соответственно и содержание отдельных химических веществ в клетках на разных стадиях отличается.
Клетки в стационарной фазе меньше по размеру, содержат меньше РНК, более устойчивы к различного рода воздействиям (физи-ческим и химическим), чем в экспоненциальной фазе роста культур. В этот период в клетках или в среде культивирования нередко накапливаются продукты
вторичного метаболизма (антибиотики, пигменты, бактериоцины и др.).
при исчерпании питательного субстрата голодающая популяция бактерий разделяется на две субпопуляции, одна из которых погибает и подвергается автолизу, клетки же другой популяции, используя продукты автолиза как субстрат, продолжают размножаться. Установлен механизм генетического контроля апоптоза у бактерий E. coli.
В фазе отмирания происходит экспоненциальное снижение числа живых клеток
Энтеробактерии отмирают медленно в отличие от некоторых видов бактерий рода Bacillus, скорость гибели которых происходит быстро. Причины отмирания клеток могут быть разными. Это и накопление органических кислот (Escherichia, Lactobacillus), автолиз (лизис над действием собственных ферментов), накопление антибиотиков, бактериоцинов и др.
В условиях непрерывного (проточного) культивирования в сосуд, содержащий популяцию бактерий, подается свежая питательная среда и из него одновременно удаляется часть среды с клетками микроорганизмов. Это позволяет на длительное время задержать культуру в состоянии
экспоненциального роста.
15 1. Рост клетки и бактериальной популяции
Рост – это согласованное увеличение количества всех химических компонентов, формирующих клеточные структуры. Рост клеток обычно сопровождается увеличением их массы и размеров. Однако эта закономерность наблюдается не всегда, так как в некоторых условиях клетки способны просто накапливать запасные или резервные вещества, т. е. масса может увеличиваться, но рост при этом не наблюдается.
В подходящей среде, к которой бактерии полностью адаптированы, они находятся в состоянии сбалансированного роста. В период сбалансированного роста удвоение биомассы сопровождается удвоением всех других учитываемых параметров популяции, например, количества белка, ДНК, РНК и внутриклеточной воды. Иными словами, культуры, растущие сбалансированно, сохраняют постоянный химический состав.
Скорость роста может снижаться по следующим причинам: из-за недостатка субстрата, вследствие высокой плотности бактериальной популяции, при низком парциальном давлении кислорода или по причине накопления токсичных продуктов обмена. Все эти факторы обусловливают переход к стационарной фазе. Переход в стационарную фазу включает период несбалансированного роста, когда компоненты клеток синтезируются с различными скоростями. Соответственно, и содержание отдельных химических веществ в клетках на разных стадиях отличается.
2. Основные параметры роста культур
В условиях сбалансированного роста легко определить величину скорости роста бактериальной популяции в каждый момент времени, если измерить прирост любого компонента клетки по отношению к его исходному количеству. Таким образом, в культуре, растущей сбалансированно, скорость прироста вещества клеток в любой данный момент пропорциональна числу или массе имеющихся в это время бактерий. Коэффициент пропорциональности называют удельной скоростью роста (µ).
Данная величина отличается для разных культур. Даже для одной куль-
туры в зависимости от условий выращивания она меняется. Удельную скорость роста можно рассчитать по следующим формулам:
 и
и 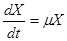 ;
;
где N – число клеток в единице объема; Х – масса клеток в единице объема; t – время.
После интегрирования и перехода к десятичным логарифмам получим формулу для определения удельной скорости роста (ч–1):

И

Зная удельную скорость роста, можно определить время генерации (g – время, необходимое для удвоения числа клеток популяции в часах или минутах): 
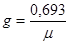 .
.
 Если рост клеток в культуре ограничен количеством внесенного в питательную среду компонента, то между его начальной концентрацией и полученной биомассой клеток существует постоянная линейная зависимость (при условии ограничения роста только по одному параметру). Масса клеток, образованная на единицу использованного компонента среды, представляет собой величину, которую называют экономическим коэффициентом (или выходом биомассы) – Y. Эту величину определяют по уравнению:
Если рост клеток в культуре ограничен количеством внесенного в питательную среду компонента, то между его начальной концентрацией и полученной биомассой клеток существует постоянная линейная зависимость (при условии ограничения роста только по одному параметру). Масса клеток, образованная на единицу использованного компонента среды, представляет собой величину, которую называют экономическим коэффициентом (или выходом биомассы) – Y. Эту величину определяют по уравнению:

где Х – масса сухого вещества клеток (г/мл культуры), вступившей в стационарную фазу роста; Х0 – масса сухого вещества клеток в 1 мл среды сразу после инокуляции среды; (Х – Х0) – урожай бактериальной культуры (урожай зависит от количества и природы используемых питательных веществ, а также от условий культивирования); (S0 – S) – количество потребленного субстрата (компонента среды).
Закономерности роста чистых культур при периодическом
культивировании
В лабораторных и промышленных условиях используют два основных способа культивирования микроорганизмов: периодическое и непрерывное.
Периодическая культура - это популяция клеток в ограниченном жизненном пространстве. Рост бактерий в периодической культуре происходит до тех пор, пока содержание какого-нибудь из необходимых им компонентов питательной среды не достигнет минимума, после чего рост прекращается.
Зависимость концентрации жизнеспособных клеток при периодическом культивировании от длительности инкубирования описывается характерной кривой, которая имеет S-образную форму (рис. 1). На кривой можно различить несколько фаз роста, сменяющих друг друга в определенной последовательности: лаг-фазу; логарифмическую фазу; стационарную фазу; фазу отмирания.

Рис. 1. Основные фазы кривой роста периодической культуры микроорганизмов
Лаг-фаза охватывает промежуток времени между инокуляцией бактерий и достижением ими максимальной скорости деления. В клетках бактерий в этот период идут в основном процессы, связанные с приспособлением их к условиям культивирования. Происходит быстрое увеличение количества РНК (в 8–12 раз).
Продолжительность фазы определяется следующими факторами:
1) начальными условиями культивирования вносимого посевного материала;
2) возрастом посевного материала: чем старше культура, которую используют для инокуляции новой питательной среды, тем большее время занимает лаг-фаза.
Во время лаг-фазы деления клеток не происходит, отмечаются лишь процессы, которые подготавливают клетку к размножению. Лаг-фаза переходит в начальную фазу размножения, когда клетки начинают делиться с постепенно возрастающей скоростью.
Фаза логарифмического (экспоненциального)роста характеризуется постоянной максимальной скоростью деления клеток и скоростью роста. Для различных видов бактерий эти величины могут варьировать в значительных пределах. Например, бактерии E. coli при 37 оС делятся примерно каждые 20 мин, а бактерии родов Nitrosomonas и Nitrobacter – 5–10 ч. В итоге культуры бактерии E. coli вступают в стационарную фазу при концентрации клеток 2–5 . 109/мл.
Характеристика клеток во время логарифмической фазы: 1) все клетки в популяции имеют приблизительно одинаковый размер; 2) содержат максимальное количество РНК, белка, и количество их постоянно; 3) клетки наиболее жизнеспособны; 4) обладают высокой биохимической активностью.
Стационарная фаза наступает тогда, когда число жизнеспособных клеток достигает максимума и не увеличивается, так как скорость размножения бактерий равна скорости их отмирания. В связи с тем, что скорость роста определяется концентрацией субстрата, то еще до его полного использования начинает снижаться и скорость роста, поэтому переход от логарифмической фазы к стационарной происходит постепенно.
Химический состав клеток зависит от фактора, лимитирующего рост. По сравнению с логарифмической фазой роста культур, клетки в стационарной фазе меньше по размеру, содержат меньше РНК, более устойчивы к различного рода воздействиям. В этот период в клетках или в среде культивирования нередко накапливаются продукты вторичного метаболизма.
Продолжительность этой фазы может быть от нескольких часов до нескольких дней в зависимости от вида микроорганизма.
В стационарной фазе роста поведение клеток в бактериальной популяции может регулировать явление, которое получило название апоптоз. Суть его сводится к тому, что при исчерпании питательного субстрата голодающая популяция бактерий разделяется на две субпопуляции, одна из которых погибает и подвергается автолизу, клетки же другой популяции, используя продукты автолиза как субстрат, продолжают размножаться.
В фазе отмирания происходит логарифмическое снижение числа живых клеток. Скорость отмирания бактерий существенно варьирует в зависимости от условий среды и физиологических особенностей организма. Например, энтеробактерии отмирают медленно в отличие от некоторых видов бактерий рода Bacillus, скорость гибели которых происходит быстро. Причины отмирания клеток могут быть разными: накопление органических кислот, автолиз, накопление антибиотиков, бактериоцинов и др.
Рассмотрим процесс образования метаболитов на разных этапах роста клетки.
В логарифмической фазе образуются продукты, жизненно важные для роста микроорганизмов: аминокислоты, нуклеотиды, белки, нуклеиновые кислоты, углеводы и т.д. Их называют первичными метаболитами. Первичные метаболиты синтезируются природными микроорганизмами в количествах, необходимых лишь для удовлетворения их потребностей. Поэтому задача промышленных микробиологов состоит в создании мутантных форм микроорганизмов-сверхпродуцентов.
В фазе замедления роста и в стационарной фазе некоторые микроорганизмы синтезируют вещества, не образующиеся в логарифмической фазе и не играющие явной роли в метаболизме. Эти вещества называют вторичными метаболитами. Их синтезируют не все микроорганизмы, а в основном актиномицеты, грибы и спорообразующие бактерии. Промышленное получение вторичных метаболитов представляет огромный интерес, поскольку эти метаболиты – биологически активные вещества: например, антибиотики, гормоны, бактериоцины и т.д.
Приведенные сведения о метаболитах указывают на важность получения знаний об особенностях отдельных фаз при периодическом культивировании.
4. Рост микроорганизмов при непрерывном культивировании
В условиях непрерывного культивирования в сосуд, содержащий популяцию бактерий, подается свежая питательная среда и из него одновременно удаляется часть среды с клетками микроорганизмов. Это позволяет на длительное время задержать культуру в состоянии логарифмического роста.
Для проточного глубинного культивирования бактерий с аэрацией в промышленных и лабораторных условиях применяют биореакторы, или ферментеры. Они представляют собой герметические котлы, в которые заливается жидкая питательная среда. Ферментеры снабжены автоматическими приспособлениями, позволяющими поддерживать постоянную температуру, оптимальное значение рН и редокс-потенциал, дозированное поступление необходимых питательных веществ и т.д. Кроме того, они снабжены системами перемешивания, аэрирования, охлаждения, пеногашения.
Ферментеры бывают нескольких типов: хемостаты, турбидостаты, оксистаты, рН-статы и др. (т.е. различаются по способу управления).
Хемостат состоит из сосуда-культиватора, в который с заданной постоянной скоростью поступает питательная среда. Для равномерного и полного смешивания питательных веществ содержимое культиватора механически перемешивается и аэрируется стерильным воздухом. Избыточная биомасса клеток с питательной средой вытекает из культиватора через сливной сифон. В хемостате прирост биомассы прямо пропорционален скорости притока субстрата и удаления продуктов метаболизма. Примером хемостата в природе служит рубец жвачных животных.
Турбидостат представляет собой ферментер, в котором поддерживается заданная плотность клеток за счет определения оптической плотности среды культивирования. Когда количество биомассы увеличивается относительно некоторого выбранного уровня, что фиксируется фотоэлементом, соединенным с системой реле, включается подача свежей питательной среды.
Непрерывное культивирование широко используется в промышленной микробиологии, а также при проведении физиологических, биохимических и генетических исследований, так как в данных условиях наблюдается постоянная плотность популяции и концентрации всех компонентов питательной среды.
Синхронные культуры
Синхронные культуры – это популяции микроорганизмов, в которых все клетки находятся на одинаковой стадии клеточного цикла и делятся одновременно.Такие культуры часто необходимы для изучения процессов обмена веществ на протяжении цикла клеточного деления.
Синхронизировать рост и деление клеток в какой-либо популяции можно с использованием различных приемов, таких как: изменение температуры; изменение интенсивности освещения (для фототрофных микроорганизмов); лимитирование количества питательных веществ (т.н. «метаболический шок» - когда сначала выращивают бактерии на голодном пайке, а потом вносят в среду необходимые питательные вещества); фильтрование суспензии клеток микроорганизмов через специальный фильтр, позволяющий отобрать клетки одного размера; центрифугирование. Несмотря на разнообразие методов, которые могут привести культуру к синхронному размножению, не всегда удается в достаточной степени синхронизировать деление клеток. В таких случаях принято сочетать различные методы. Однако в синхронизированном состоянии культура не может находиться длительное время и после двух-трех генераций процесс деления клеток асинхронизируется.
Синхронизации деления подвергались различные объекты: грибы, бактерии, простейшие, водоросли, а также клетки культуры тканей растений и животных.
Дата добавления: 2019-09-13; просмотров: 1051; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
