Решение расчетных задач по химическим уравнениям.
В уравнениях реакций существуют т.н. стехиометрические соотношения – это соотношения между количествами, массами или объемами (для газов) реагирующих вещества, рассчитанные на основе уравнения реакции.
В основе расчетов по уравнениям реакций лежит основной закон стехиометрии: отношение количеств реагирующих вещества (т.е. в молях!!!) равно отношению соответствующих коэффициентов в уравнении реакции.
Т.е. в общем случае для реакции, проходящей по уравнению
aA + bB = cC + dD 
Зная количество вещества одного из участников реакции (его называют опорным веществом) по основному закону стехиометрии можно найти количество вещества всех остальных. Если дана масса или объем одного из веществ надо воспользоваться формулами ν=m/M или ν=V/Vm. Если надо найти не количество вещества, а массу или объем то опять пользуемся формулами m=ν∙M или V=ν∙Vm
Образцы решения задач по формулам (1 уровень)
Задача №1. Какое число молекул содержит аммиак (NH3) количеством вещества 3 моль?




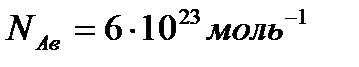
N =6.1023моль-1 . 3 моль=18.1023 (молекул)
Ответ: 1,8 .1024 молекул.
Задача №2. Какое количество вещества составляет 3 . 1023 молекул кислорода (О2)?






Ответ: 0,5 моль.
Задача №3. Вычислить количество вещества, которое соответствует 288 г фосфорной кислоты(H3PO4).
|
|
|


 M(H 3 PO 4) =1 . 3+31+16 . 4=98 г/ моль
M(H 3 PO 4) =1 . 3+31+16 . 4=98 г/ моль
𝛎 = 
Ответ: 3 моль
Задача №4. Найти массу 3 моль оксида углерода (IV) CO2.


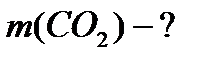


Ответ: 132 г
Задача №5 Найти объем углекислого газа количеством вещества 0,2 моль.
ν = 0,2 моль СО2 V = ν · Vm Vm = 22,4 л/моль
V - ? V = 0,2 моль·22,4 л/моль = 4,48 л Ответ: 4,48 л
Задача №6 Найти количество вещества , если сернистый газ занимает 5,6 л.
V(SO2) = 5,6 ν = 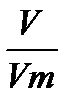 Vm = 22,4 л/моль
Vm = 22,4 л/моль
ν - ? ν =  Ответ: 0,25 моль
Ответ: 0,25 моль
Задача №7 Найти относительную плотность кислорода по гелию

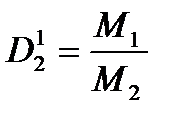
 =
=  =8
=8
М(О2)=32г/моль Ответ: т.е. кислород в 8 раз гелия
М(Не)=4г/моль
Задача №8 Найти молекулярную массу природного газа, если его плотность по водороду равна 8.
М(Х)=? 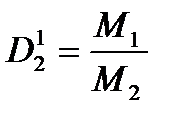 => M(Х) = D
=> M(Х) = D  · M(H2)
· M(H2)
M(Х) = 2· 8 = 16 г/моль
|
|
|
D  = 8
= 8
M(H2) = 2 г/моль Ответ: природный газ метан М(СН4) = 16 г/мол
Образцы решение задач по формулам (2 уровень)
 №9. Сколько атомов содержится в 32 граммах меди?
№9. Сколько атомов содержится в 32 граммах меди?
N(Cu)-? N = N Ав ·ν
N Ав=6·1023моль-1 ν-?  m(Cu)=32г
m(Cu)=32г
M(Cu)= 64 г/моль ν =  =0,5 моль
=0,5 моль
N(Cu) = 6· 1023 моль-1·0,5 моль = 3· 1023 (атомов)
Ответ: 3· 1023 атомов
№10. Найти массу 9· 1023 молекул воды.
m(H2O)-?  M (H2O)= 1·2 + 16 = 18 г/моль
M (H2O)= 1·2 + 16 = 18 г/моль
N(Н2О) = 9· 1023 молекул ν-?  NAb = 6· 1023 моль-1
NAb = 6· 1023 моль-1
ν (H2O) = 
m = 18 г/ моль· 1,5 моль = 27 г Ответ: 27 г
Образцы решения задач по уравнениям реакций
I уровень И в данных задачи и в вопросе речь идет о молях, т.е. количестве веществ, участвующих в реакции
№51. Какое количество вещества водорода (H2) вступит в реакцию с 2 моль азота (N2)?
ν (H2) -? x моль 2 моль АЛГОРИТМ.
|
|
|
ν(N2) =2 3H2 + N2 = 2NH3 1.Кратко записать условия задачи
3 моль 1 моль 2. Запишем уравнение реакции, расставим
коэффициенты.
3. Коэффициенты в уравнениях показывают в каких соотношениях находятся количество вещества исходных веществ и продуктов реакции, т.е. с одним молем (N2) реагирует 3 моль (H2). Математически это можно записать как пропорцию. Произведение крайних членов пропорции равно произведению средних её членов,
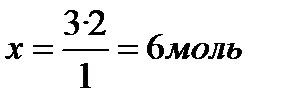
или 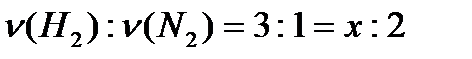
или  то есть эти записи равноценные
то есть эти записи равноценные
Ответ: 6 моль водорода.
П уровень. Рассмотрим задачу в которой надо найти не количество вещества, а его массу.
№52. Найти массу аммиака (NH3), если в реакцию с водородом вступают 2 моль азота (N2)
Запишем условия задачи и уравнение реакции, и рассчитаем количество вещества
 m (NH3)-? 2моль x
m (NH3)-? 2моль x
3H2 + N2 = 2NH3
1 моль 2 моль 1). 
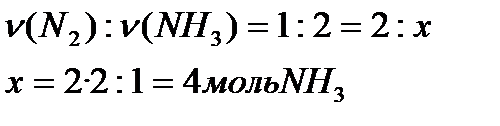
 2).
2).
Ответ: 68 г аммиака.
Дата добавления: 2019-09-13; просмотров: 152; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
