Цель: Научиться составлять уравнения прямой и обратной реакции, выражать константу равновесия, определять зависимость скорости от концентрации и температуры.
ПРИМЕР №1 Определить число протонов, электронов, нейтронов и относительную атомную массу углерода, натрия и рутения.
| а) Для углерода Относительная атомная масса : Аr (С) = 12………………….. Число протонов …р=6……… Число электронов… e- =6…… Число нейтронов : …………… …n= Ar –p= 12-6=6……… | б) Для натрия Относительная атомная масса : Аr (Na) = ……………………………… Число протонов……………………… Число электронов…………………... Число нейтронов : …………………. …………………………………. | с) Для рутения Относительная атомная масса : Аr (Ru) = ………………………………… Число протонов………………………… Число электронов……………………... Число нейтронов : ……………..……… …………………………………………….. |
ПРИМЕР №2 Определить количество молей и число молекул
| а) в 10 граммах серной кислоты Н2 SO 4 | б) в 50 граммах соли А l 2 ( SO 4 )3 ; |
1. По таблице Д.И. Менделеева определяем относительные атомную массу :
 Аr(H)=1, Аr(S)=32, Аr(O)=16, рассчитаем по этим данным относительную молекулярную массу: Мr(H2SO4)= (2*1)+32+(16*4)=98
2. Количество молей:
3. Количество молекул:
N= υ* Na=0,102* 6,02٠1023 =0,614٠1023мол. Аr(H)=1, Аr(S)=32, Аr(O)=16, рассчитаем по этим данным относительную молекулярную массу: Мr(H2SO4)= (2*1)+32+(16*4)=98
2. Количество молей:
3. Количество молекул:
N= υ* Na=0,102* 6,02٠1023 =0,614٠1023мол.
| …………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………. |
| с) Определить количество молей и число молекул в 2х литрах N 2 | д) Определить количество молей и число молекул в 14 х литрах O 2 |
1. Количество молей
 ;
2.Количество молекул
N= υ* Na=0,089 * 6,02٠1023 =0,54٠1023 мол. ;
2.Количество молекул
N= υ* Na=0,089 * 6,02٠1023 =0,54٠1023 мол.
| ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………… |
ПРИМЕР №3 Определить массовую долю каждого химического элемента
|
|
|
| а) в молекуле серной кислоты H 2 SO 4. | б) в молекуле сульфат алюминия А l 2 ( SO 4 )3 |
Мr(H2SO4)= 2*1+32+16*4=98
 100%= 2,04+32,65+65,3 100%= 2,04+32,65+65,3
| ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………… |
ПРИМЕР №4
| а) Определить практический выход водорода, если при взаимодействии 9,8г. серной кислоты с железом, водорода выделилось 2 г. 2Fe+ 3H2SO4→Fe2(SO4)3 + 3H2 | б) Определить массу железа, которая потребуется для 60грамм сульфата железа , если выход реакции составил 85% 2 Fe + 3 H 2 SO 4 → Fe 2 ( SO 4 )3 + 3 H 2 |
Дано:
m(Fe) =9,8 гр.
m(Н2) практ. =9,8 гр.
Решение: Подставим значения в уравнение
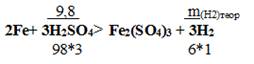


| ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………… ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………… |
САМОСТОЯТЕЛЬНАЯ РАБОТА
|
|
|
Выполнить задания:
1. Используя ПСЭ Д.И. Менделеева определить число протонов, нейтронов, электронов, относительные атомные массы Аr элементов : алюминия , водорода, кислорода.
--------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
2. Рассчитать относительную молекулярную массу -Аl(OH)3. Рассчитайте число молекул и число молей в 30
|
|
|
граммах - Аl(OH)3.
--------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
3. Определите массовую долю каждого вида атомов в соединении- Аl(OH)3
--------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
--------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
--------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
4. .Определить массу сложного вещества, выделившегося при взаимодействии 60 литров
AL(NO3 )3 cо щелочью NaOH , если выход реакции 65%(н.у): AL(NO3 )3+ 3NaOH→Аl(OH)3+ 3NaNO3
--------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
|
|
|
--------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
--------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Вывод: ………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
ПРАКТИЧЕСКАЯ РАБОТА №6
«МОДЕЛИРОВАНИЕ ПОСТРОЕНИЯ ПСЭ. СТРОЕНИЕ ОБОЛОЧКИ АТОМА»
Цель: Научиться определять расположение в ПСЭ металлов, галогенов, благородных газов, лантаноидов, актиноидов, переходных элементов; ххарактеризовать изменения свойств элементов и их соединений внутри групп и периодов (металлические свойства, радиус атомов ,электроотрицательность); распределять электроны по электронным орбиталям у элементов первых четырех периодов и записывать соответствующие электронные и графические формулы
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
| Периодический закон: «Свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от зарядов ядра атомов элементов.» 1. Свойства элементов внутри периода и подгруппы меняются периодично: ¾ В периодах слева направо R атомов уменьшаются- связано с ростом размера ядра. ¾ В подгруппах сверху вниз R атомов увеличиваются -растет число электронных слоев. 2. Энергия ионизации, сродство к электрону, электроотрицательность - ¾ В периоде слева направо они возрастают, поэтому способность притягивать к себе электроны увеличивается(окислительная)-снижаются металлические свойства. ¾ В подгруппе сверху вниз они снижается– способность отдавать свои электроны усиливается (восстановительная ) - растут металлические свойства. |  
|
СТРОЕНИЕ АТОМА
| ¾ n - главное число, определяет энергетический уровень электрона; ¾ ℓ – орбитальное число, определяет форму атомной орбитали. ¾ mℓ – магнитное число, характеризует количество орбиталей одинаковой формы, mℓ = ℓ до +ℓ . ¾ ms спиновое число | Значения
¾ п=1 →ℓ=0 (s), mℓ= 0  Ns =2
¾ п=2 →ℓ=1(p), mℓ= (-1, 0, 1 ) Ns =2
¾ п=2 →ℓ=1(p), mℓ= (-1, 0, 1 )    Np =6
¾ п=3 →ℓ=2(d), mℓ= (-2, -1, 0, 1, 2 ) Np =6
¾ п=3 →ℓ=2(d), mℓ= (-2, -1, 0, 1, 2 )      Nd =10
¾ п=4 →ℓ=3(f), mℓ= (-3,-2,-1,0,1,2,3 ) Nd =10
¾ п=4 →ℓ=3(f), mℓ= (-3,-2,-1,0,1,2,3 )        Nf=14
Размещение: ms=+/-0,5 → Nf=14
Размещение: ms=+/-0,5 → 
|
· Принцип наименьшей энергии (правило Ключковского)- электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией:1 s 2 <2 s 2 <2 p 6 <3 s 2 <3 p 6 <4 s 2 <3 d 10 <4 p 6 <5 s 2 <4 d 10 <5 p 6 <6 s 2 <4 f 14 <5 d 10 <6 p 6 <7 s 2 <5 f 14 <6 d 10 <7 p 6
· Принцип Паули: В одной квантовой ячейке не может быть 2х- электронов с параллельными спинами.
· Правило Гунда -электроны заполняют квантовые ячейки последовательно –по одному. Электроны, заполняющие квантовые ячейки последовательно, имеют одинаковые спины.
ПРАКТИЧЕСКАЯ ЧАСТЬ
Задание №1
Заполните таблицу. Как изменяются: атомный радиус, металлические свойства элементов, электроотрицательность в указанном ряду.
Задание №2 Укажите элемент, которому принадлежит данная электронная формула: a) 1s22s22p63s23p64s23d6…………………………………………………….. b) 1s2 2s2 2р63s23р64s23d104p6……………………………………………… Задание №3 Составить электронно- графические формулы химических элементов и ионов.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
САМОСТОЯТЕЛЬНАЯ РАБОТА
Выполнить задания:
1. Какому элементу принадлежит данная электронная формула: 1s22s22p63s23p64s23d104p6…………………………
2. Составьте электронные конфигурация и графические формулу элементов № 5,10 и ионов S6+, Mg2+
| №5 ------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------ | №10 ------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------ | S 6+ ------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------ | М g 2+ ------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------ |
К, Na, Li укажите их название, общее число электронов, относительную атомную массу, формулу высшего оксида, гидроксида. Как изменяются: атомный радиус, металлические свойства элементов, электроотрицательность в данном ряду.
| Название | е- = р+ | Ar | Высший оксид | Высший гидроксид | Рост металлических свойств | Атомный радиус | Электо отрицательность | |
| K |
Ý ß |
Ý ß |
Ý ß | |||||
| Na | ||||||||
| Li |
Вывод: ………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
ПРАКТИЧЕСКАЯ РАБОТА №7
«СМЕСИ И ПРИМЕСИ. РЕШЕНИЕ ЗАДАЧ НА ОПРЕДЕЛЕНИЕ МАССОВОЙ ДОЛИ ПРИМЕСЕЙ»
Цель: Ознакомиться с видами смесей, научиться выполнять готовить суспензию и эмульсию; решать задачи на определение массовой доли компонентов смеси и примесей
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
| · ЧИСТЫМИ- называют вещества, которые обладают постоянными физическими свойствами и состоят из молекул одного вида. · СМЕСЯМИ –называют системы, состоящие из нескольких чистых веществ. · ПРИМЕСЬ- это один из компонентов смеси. |  ФОРМУЛЫ ДЛЯ РАСЧЁТА ФОРМУЛЫ ДЛЯ РАСЧЁТА
|
Смеси могут быть:
1. Однородными (гомогенные)- граница раздела фаз не выражена, частицы не определяется. Для разделения применяют выпаривание, кристаллизацию, дистилляцию, хроматографию.
Растворы –этогомогенные системы, состоящие из растворителя, растворенного вещества и продуктов их взаимодействия. Вещества, составляющие раствор, называют компонентами реакции.
2. Неоднородными (гетерогенные)- граница раздела фаз выражена, частицы определяются. Иначе их называют дисперсными системами. Для разделения применяют отстаивание, фильтрование и действие магнита.
Дисперсные системы – это гетерогенные системы ,в которых одно (или несколько) вещество - дисперсная фаза в виде очень мелких частиц равномерно распределено в объеме другого -дисперсионной среде
| | ТИПЫ ДИСПЕРСНЫХ СИСТЕМ | ||

|  …………………………………………
…………………………………………
|  …………………………………………
…………………………………………
| |
 …………………………………………
…………………………………………
|  …………………………………………
…………………………………………
|  …………………………………………
…………………………………………
| |
 …………………………………………
…………………………………………
|  …………………………………………
…………………………………………
|  …………………………………………
…………………………………………
| |
ПРАКТИЧЕСКАЯ ЧАСТЬ
| Задача№1 | |
| Определить массу чистого вещества в 200гр технического СаО, если содержание в нем примесей 30%. Дано: m(CaO) тех.= 200 гр. Wприм.= 30% Найти: m(CaO) чист.= ? Решение: .m(прим.) = W прим.* m ( CaO )тех. = 0,3*200= 60гр. 100% m(CaO) чист.= m (CaO)тех.- m(прим.) =200-60= 140гр. | Определить массу примесей в 300гр технического СаС2 , если содержание примесей в нем 64%. Дано: Найти:………………………… Решение:……………………………………………………… ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………… |
| Задача№2 | |
| 11,2 гр. мрамора растворили в избытке соляной кислоты и получили 2, 24 л газа (н.у.). Рассчитайте массовую долю примесей в израсходованном образце мрамора. Дано: m(CaCO3)тех.= 11.2гр. V(CO2)=2,24л. Найти: Wприм.= ? Решение: Хгр. 2,24л CaCO3 + 2 HCl = CaCl 2 + CO2+ H2O 40+12+48 22,4л. m(CaCO3)чист.= Х= 100* 2,24 =10гр. 22,4 m(примесей) = m(CaCO3)тех.- m(CaCO3)чист. m(примесей) = 11,2-10= 1,2гр. Wприм.= m (примесей)*100% = 1,2*100% = 10,7% m(CaCO3)тех. 11,2 | Вычислите, какая масса оксида железа (III) содержащего 10 % примесей, необходима для получения железа массой 400 кг. Дано: ………………………………… ………………………………… Найти:………………………… Решение: ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………… |
| Задача№3 | |
| Рассчитайте массу сложного вещества , образованного при взаимодействии с соляной кислотой 325 г цинка, содержащего 20% примесей. Дано: Wприм.= 20% m (Zn)тех.= 325гр. Найти: m (ZnCl2) =? Решение: Wприм.= m (примесей)*100% m (Zn)тех. .m(примесей) = W прим.* m ( Zn )тех. = 0,2*325= 65гр. 100% m (Zn)чист.= m (Zn)тех.- .m(примесей)= 325-65= 260гр. 260гр. Хгр.. Zn + 2HCl = ZnCl2 + H2 65 65+71 m (ZnCl2) = 136*260/ 65 = 544гр. | Определить объем выделившегося газа, который можно получить при термическом разложении 600гр. карбоната магния, содержащего 10% примесей? М gCO 3 = Mg О+ CO 2 Дано: ………………………………… ………………………………… Найти: ………………………… Решение:………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………… |
САМОСТОЯТЕЛЬНАЯ РАБОТА
Выполнить задания:
· Определить процентное содержание примесей в бромиде железа , если при взаимодействии 400 грамм его с избытком хлора получили 0,224 литра брома: 2 FeBr 3 + 3 Cl 2 = 2 FeCl 3 + 3 Br 2
| Дано: ………………………………… ………………………………… Найти: ………………………… | …………………………………………………………………………………………………… …………………………………………………………………………………………………… …………………………………………………………………………………………………… …………………………………………………………………………………………………… …………………………………………………………………………………………………… |
Вывод: ………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
ПРАКТИЧЕСКАЯ РАБОТА №8
«РЕШЕНИЕ ЗАДАЧ НА ОПРЕДЕЛЕНИЕ ПРОЦЕНТНОЙ, МОЛЯРНОЙ И МОЛЯЛЬНОЙ КОНЦЕНТРАЦИИ
РАСТВОРОВ»
Цель: Научиться выполнять расчёты на определение процентной, молярной и моляльной концентрации с учётом разбавления растворов и увеличения доли растворимого вещества.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Раствор- это однородная система , состоящая из растворителя ,растворенных веществ и продуктов их взаимодействия. По агрегатному состоянию различают растворы: жидкие , твердые, газообразные.
Состав раствора обычно передается содержанием в нем растворимого вещества в виде:

| ¾ Массовая доля (безразмерная величина) – это отношение массы растворенного вещества к массе всего раствора: |

| ¾ Процентная концентрация ( %) – это величина показывающая сколько грамм растворенного вещества cсодержится в 100 гр. раствора |

| ¾ Молярная концентрация , или молярность (моль/литр)- это величина показывающая сколько молей растворимого вещества содержатся в 1 литре раствора |

| ¾ Моляльная концентрация (моль/кг)- это величина показывающая сколько молей растворимого вещества содержатся в 1 килограмме растворителя: |
ПРАКТИЧЕСКАЯ ЧАСТЬ
| Задача №1 | |
| Вычислить процентную концентрацию соли в растворе , если в 450 г воды растворили 50 гр. CuSO4 Дано: m (CuSO4)=50г. m (Н 2O)=450г. Найти: W% Решение mраствора = m (CuSO4)+m (Н 2O)= =450+50=500гр. W% = m ( CuSO 4 ) * 100% · mраствора W% = 50*100%/500=10% | Сколько грамм соли и воды содержится в 800 граммах 12 %-ного раствора NaNO3? Дано: ………………………………… ………………………………… Найти: ………………………… Решение …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. |
| Задача №2 | |
| Определить молярность и моляльность раствора серной кислоты, если объём раствора 600 литров а масса растворённой в нём кислоты 196 грамм , если плотность раствора 1,1г/л. Дано: Vраствора=600л m (H2SO4)=196г ρ раствора= 1,1г/л Найти: Ср,Сm Решение Используя ПСЭ рассчитаем относительную молекулярную массу растворённой кислот Mr (H2SO4)= 98 Определим молярность Ср = m ( H 2 SO 4 ) = 196/98·600=0,0033моль/л. Mr (H2SO4) ·Vраствора. Определим массу раствора и моляльность m раствора = ρ раствора* Vраствора = 1,1* 600= 660 гр. Ср = m(H2SO4) = 196 /98*(660-196)=0,0043моль/кг Mr (H2SO4)*mрастворителя | Определить молярность и моляльность раствора соляной кислоты массой 700 гр. и концентрацией 10%, если плотность раствора 1,25 г/мл Дано: ………………………………… ………………………………… ………………………………… ………………………………… Найти: ………………………… Решение …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. |
| Задача №3 | |
| Определить процентную концентрацию раствора КОН, если для его получения к400граммам 30%-ного раствора КОН прилили 50 грамм воды. Дано: W% 1 = 30%. m равтвора1=400г. m (Н 2O)=50г Найти: W% 2 Решение: W%= m (КОН) * 100% / m раствора Определим массу растворённого вещества m(КОН)= W%· mраствора = 30·400 / 100=120г. 100% · Концентрация раствора после добавления воды W%2= m (КОН) * 100% = 120·100% / (400+50) = 26,67% (mр.+m(Н 2O)) | Определить процентную концентрацию раствора соли NaCL , если для его получения к 400 гр/ 50%-ного раствора соли NaCL добавили 20 гр/ этой же соли. Дано: ………………………………… ………………………………… ………………………………… Найти: ………………………… Решение …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. |
| Задача №4 | Задача №5 |
| Сколько сахара надо добавить к 300г 30% сахарного сиропа, чтобы получить 40% сироп. Определить моляльность полученного раствора. Дано: ………………………………… ………………………………… Найти: ………………………… Решение …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. | Определить W % концентрацию раствора соли К CL , если для его получения к 600 г 50%-ного раствора этой соли добавили 200гр. 10%-ного раствора К CL Дано: ………………………………… ………………………………… Найти: ………………………… Решение …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. |
САМОСТОЯТЕЛЬНАЯ РАБОТА
Выполнить одно из заданий:
A. Сколько грамм сахара необходимо добавить к 300г. 60%-ного сахарного раствора, чтобы он стал 90%-ным
B. Смешали 40 гр. 9%-ного раствора уксуса и 20гр. 70%-ного раствора уксусной кислоты. Определить концентрацию полученного раствора уксусной кислоты.
C. Определить процентную, молярную и моляльную концентрацию раствора массой 20 гр., содержащего 3 гр. соли NaCL, плотность которого 1,2 гр/л
| Дано: ………………………………… ………………………………… Найти: ………………………… | …………………………………………………………………………………………………… …………………………………………………………………………………………………… …………………………………………………………………………………………………… …………………………………………………………………………………………………… …………………………………………………………………………………………………… …………………………………………………………………………………………………… …………………………………………………………………………………………………… |
Вывод:
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
ПРАКТИЧЕСКАЯ РАБОТА №9
«СОСТАВЛЕНИЕ УРАВНЕНИЙ ГИДРОЛИЗА СОЛЕЙ»
Цель: Познакомиться с понятием «гидролиз солей» .Научиться определять среду раствора солей, кислот, щелочей с помощью индикаторов и составлять реакции гидролиза.
ТЕОРЕТИЧЕСКИЙ ОБЗОР
Гидролиз –это процесс взаимодействия ионов соли с водой , приводящий к образованию слабого электролита .
Все соли можно разделить на 4 группы:

| Сведения по веществам · Сильные кислоты – кислоты, являющиеся сильными электролитами (H2SO4, HCl, HNO3, HBr, HI, HClO4 и другие). · Слабые кислоты – кислоты, являющиеся слабыми электролитами (H2CO3, H2SO3, H2S, H2SiO3, H3PO4 , НСN и другие) · Сильные основания – сильные электролиты - щелочи (NaOH, KOH, и другие). · Слабые основания – нерастворимые основания, слабые электролиты (Cu(OH)2, Ca(OH)2, NH4OH, Al(OH)3 и др. |
Глубина гидролиза зависит от температуры (чаще всего ее приходится повышать) и концентрации раствора (при разбавлении раствора гидролиз усиливается).
| ПРОДУКТЫ НЕОБРАТИМОМОГО ГИДРОЛИЗА | ||
| · ОСАДКИ: трудно растворимое вещество согласно таблицы растворимости Например: AL(OH)3↓ | 1. ГАЗЫ: Н2S↑, H2CO3→ CO2↑+H2O H2SO3→ SO2↑+H2O NH4OH→NH3↑+H2O | СЛАБОДИССОЦИИРУЮЩИЕ ВЕЩЕСТВА: H2O, HF, СН3СООН HNO2, HCN, H3PO4 |
ПРАКТИЧЕСКАЯ ЧАСТЬ
| 1. Соль образована сильным основанием и сильной кислотой (К2 SО4, NaNO3,)– гидролиз не идет , | |
| Пример №1 NaCL NaCL + HOH → N аОН + HCL Na++CL- + HOH→ Na1++ ОН 1- + H1++CL1- HOH→ ОН 1- + H+ Среда нейтральная рН = 7 | К2 S О4 + HOH →……………………………………………… …………………………………………………………............... …………………………………………………………............... …………………………………………………………............... |
| 2. Соль образована сильным основанием и слабой кислотой (например : Na2СО3, К2S, Ва(NO2)2, СН3СООLi) -гидролиз протекает в щелочной среде рН >7 , гидролиз идет по аниону. | |
| Пример №2 Na 2 SO 3 1 ступень I. Na 2 С O 3 + HOH → N аОН + Na НС O 3 2Na++СO32- + HOH→ Na1++ ОН1- + Na1++HСO31- СO32- + HOH→ ОН1- + H СO31- 2 ступень II. NaНСO3+ HOH→Nа ОН +Н2СO3 (Н2 СO3→СO2↑+ H2O ) Na++H++ СO32- + HOH→Na++ ОН1- + СO2↑ + H2O H1++ СO32- + HOH→ ОН 1- + СO2↑ + H2O Избыток ионов OH–в растворе обусловливает щелочную реакцию среды в растворе (pН>7) | К2 S + HOH →………………………………………………… …………………………………………………………............... …………………………………………………………............... …………………………………………………………............... …………………………………………………………............... …………………………………………………………............... …………………………………………………………............... |
| 3. Соль образована слабым основанием и сильной кислотой (MgSО4, AlCL3, Zn(NO3)2, ..) - гидролиз протекает в кислой среде рН< 7 , гидролиз идет по катиону. | |
| Пример №3: AlCl3 1-ступень I. AlCl3 +Н2О→ AlОНCl2 +НCL Al3+ + 3 CL1- +НОН→ Al ОН2+ +2CL1- +Н1+ +CL1- Al 3+ +НОН→ Al ОН2+ +Н1+ 2 ступень II. Al ОНCl2+Н2О→ Al (ОН)2Cl +НCL AlOH2+ +2CL1- +НОН→ Al(ОН)21++CL1-+Н1+ + CL1- AlOH2+ + НОН→ Al (ОН)21+ + Н1+ 3 ступень III. Al (ОН)2Cl +Н2О→ Al (ОН)3↓ +НCL Al (OH)21++CL1- +НОН→ Al (ОН)3↓+Н1+ +CL1- Al (OH)21++НОН→ Al (ОН)3↓+Н1+ Избыток ионов H+ в растворе обусловливает кислую реакцию среды в растворе (pН<7). | С uSO4 + НОН →……………………………………………… …………………………………………………………............... …………………………………………………………............... …………………………………………………………............... …………………………………………………………............... …………………………………………………………............... …………………………………………………………............... …………………………………………………………............... …………………………………………………………............... |
| 4. Соль образована слабым основанием и слабой кислотой (MgСО3, Al 2S3, Zn(NO2)2, ..) - гидролиз протекает практически в нейтральной среде рН ближе к 7 , гидролиз идет по катиону и аниону: | |
| Пример №4: CH 3 COONH 4 CH3COONH4+ Н2О→CH3COOН+NH3↑+H2O NH41+ +CH3COO1-+НОН→CH3COOН+NH3 ↑+H2O | Mg СО3 + НОН →……………………………………………… …………………………………………………………............... …………………………………………………………............... …………………………………………………………................ |
САМОСТОЯТЕЛЬНАЯ РАБОТА
Выполнить одно из заданий:
Записать реакции гидролиз в трех молекулярно-ионных формах по стадиям , укажите характер среды(кислая , нейтральная , щелочная):
А-программа a) Li2S + НОН; б)Fe(NO3)3+ НОН; в) NH4NO3 + НОН г) CsNO3+ НОН
Б-программа а) Li2SO3 + HOH, б)NH4J + НОН в)KBr + НОН
С-программа а) NH4J +HOH б)KCL + НОН
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
Вывод:
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
ПРАКТИЧЕСКАЯ РАБОТА №10
«РЕАКЦИИ ИОННОГО ОБМЕНА . МЕТОД ЭЛЕКТРОННОГО БАЛАНСА В ОВР»
Цель: Научиться практически выполнять реакции ионного обмена. Познакомиться с понятием ОВР, окислитель , восстановитель, процесс окисления, восстановления, научиться различать виды ОВР, расставлять коэффициенты методом электронного баланса.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
РИО идут в соответствии со схемой: AB + C Д à АД + ВС
Записываются РИО в трёх формах : молекулярная форма, полное ионно- молекулярное уравнение, сокращённое ионно- молекулярное уравнение.
РИО протекает необратимо в трех случаях, когда образуется:
| 1. ТРУДНОРАСТВОРИМОЕ ИЛИ НЕРАСТВОРИМОЕ ВЕЩЕСТВО –ОСАДОК («М» или «Н» в таблице растворимости) AL(OH)3↓, Cu(OH)2↓ | 2. ГАЗООБРАЗНОЕ ВЕЩЕСТВО: Н2S↑, H2CO3→ CO2↑+H2O H2SO3→ SO2↑+H2O NH4OH→NH3↑+H2O | 3. СЛАБОДИССОЦИИРУЮЩИЕ ВЕЩЕСТВА: H2O, HF, СН3СООН HNO2, HCN, H3PO4 |
ОКИСЛИТЕЛЬНО-ВОСТАНОВИТЕЛЬНЫЕ РЕАКЦИИ–это реакции, протекающие с изменением степеней окисления элементов , входящих в состав веществ.
Метод электронного баланса-один из методов уравнивания окислительно-восстановительных реакций (ОВР)
В ходе ОВР одни элементы отдают электроны, другие принимают.
ü Восстановители - атомы , или вещества отдающие свои электроны, а процесс отдачи электронов – окисление : АL0-3e-® AL3+
ü Окислители- атомы , или вещества принимающие электроны, а процесс принятия электронов – восстановление : Fe2++2e-® Fe0
ПРАКТИЧЕСКАЯ ЧАСТЬ
| ¾ РЕАКЦИИ ИОННОГО ОБМЕНА | |||||||||||||
| а) РИО обратимые, идущие с образованием хорошо дислоцирующих растворимых веществ Например: KCl + Na NO3®KNO3 + NaCl K+ + Cl- + Na+ + NO3- ↔K+ + NO3- + Na+ + Cl- С точки зрения ТЭД эти реакции не идут, так как продукты и реагенты этих реакций - сильные электролиты, существующие в растворе в виде ионов. | 1. NaNO3+ HBr→……………………………………........... …………………………………………………………............... …………………………………………………………............... …………………………………………………………............... | ||||||||||||
| б) РИО необратимые, идущие с образованием трудно растворимого соединения – осадка. Например: AgNO3 + NaCl → AgCl+ NaNO3 Ag+ + NO3- + Na+ + Cl- →AgClâ + Na+ +NO3- Ag+ + Cl- → AgCl | 2. С uSO 4 + NaOH →….……………………………............. …………………………………………………………........... …………………………………………………………........... | ||||||||||||
| б) РИО необратимые, идущие с образованием газообразных веществ. Например: Na2S + 2HCl→2 NaCl + H2Sá 2Na+ + S-2 + 2H+ + 2Cl- → 2Na++ 2Cl- + H2S↑ S-2 + 2H+ →H2Sá | 3. Na2CO3 + HC l → ……………………………………... …………………………………………………………........... …………………………………………………………........... | ||||||||||||
| РИО необратимые, идущие с образованием слабодиссоциирующих веществ. Например: NaOH + HCl→ NaCl + H2O Na+ + OH- + Cl- +Н+→Na+ + Cl- + H2O OH- + H+ → H2O | 4. К3 PO 4 + HCL →……………………………………........... …………………………………………………………............... …………………………………………………………............... | ||||||||||||
| ¾ ОКИСЛИТЕЛЬНО- ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ | |||||||||||||
Пример №1 Аl + Fe2O3® Fe + AL2O3
Тип реакции - межмолекулярная реакция,
Расставляем степени окисления всех элементов:
Аl0 + Fe3+2O2-3® Fe0 + AL3+ 2O2- 3
Найденные коэффициенты проставляем в ОВР: 2Аl + Fe2O3® 2Fe + AL2O3 Пример №2 O2 + H2 ® H2О Тип реакции - внутримолекулярная реакция Расставляем степени окисления всех элементов: O0 2 + H0 2 ® H1+ 2О 2-
O2 + 2H2 ® 2H2O Пример №3 Na2 S4+ O3 ® Na2 S6+ O4 +Na 2S2- 1. Тип реакции -диспропорционирования
4Na2 S O3 ® 3Na2 SO4+Na2S | 1. K2Cr2O7 + HCl = Cl2 + KCl + CrCl3 + H2O ……………………………………………………………… ……………………………………………………………… ……………………………………………………………… ……………………………………………………………… 2. C + HNO3( конц ) = CO2 ↑ + NO2 ↑+ H 2 O. ……………………………………………………………… ……………………………………………………………… ……………………………………………………………… ……………………………………………………………… 3. NaNO3 → NaNO2 + O2↑. ……………………………………………………………… ……………………………………………………………… ……………………………………………………………… ……………………………………………………………… | ||||||||||||
САМОСТОЯТЕЛЬНАЯ РАБОТА
Выполнить одно из заданий:
1.Записать, РИО в трех формах между веществами:
А-программа a)Ca(OH)2+ HNO3; б) (NH4)2CO3 +HCL; в) AlCL3+ KOH.
Б-программа a ) K2SO3+ HCL ; б) Fe (OH)3 + H2SO4.
С-программа а) MgCL2 +KOH
2. Допишите электронные уравнения, укажите окислитель, восстановитель, процесс окисления и восстановления : а) Zn0 -2e- ®………. б ) Ba2+ +2e-®……….
3.Расставить коэффициенты в уравнениях, используя метод электронного баланса , указать окислитель , восстановитель, процесс окисления и восстановления и тип ОВР. Ca3(PO4)2+C+SiO2→CaSiO3+P+CO………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
Вывод:
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
ПРАКТИЧЕСКАЯ РАБОТА №11
«РЕШЕНИЕ ЗАДАЧ ПО ХИМИЧЕСКОЙ КИНЕТИКЕ»
Цель: Научиться составлять уравнения прямой и обратной реакции, выражать константу равновесия, определять зависимость скорости от концентрации и температуры.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
| аАгаз + вВгаз→сСгаз + dD тв | ¾ Скорость прямой реакции равна: n пр. = Кпр.∙ СА а ∙ СВ в ¾ Скорость обратной реакции равна: n обр.= Кобр..∙ СС с |

| ¾ Температура - зависимость скорости реакции от температуры выражается правилом Вант Гоффа: при повышении температуры на 10 градусов скорость химической реакции увеличивается в 2-4 раза, где V2 и V1 - скорости реакций при температурах t2 и t1; γ - температурный коэффициент скорости реакции. |
Химическое равновесие - это такое состояние обратимого химического процесса , при котором скорости прямой и обратной реакций равны между собой: n пр. = n обр
| ВЛИЯНИЕ ТЕМПЕРАТУРЫ, ДАВЛЕНИЯ, КОНЦЕНТРАЦИИ НА ХИМИЧЕСКОЕ РАВНОВЕСИЕ | |
| Температура | ↑Т-равновесие сместится в сторону эндотермической реакции ↓ Т-равновесие сместится в сторону экзотермической реакции |
| Давление | ↑Р-равновесие сместится в сторону реакции с меньшей суммой коэффициентов перед газообразными веществами ↓Р- равновесие сместится в сторону реакции с большей суммой коэффициентов перед газообразными веществами. |
| Концентрация | ↑С (реагента) равновесие сместится в сторону прямой реакции (вправо) ↓ С (реагента) равновесие сместится в сторону обратной реакции (влево) ↑С (продукта ) равновесие сместится в сторону обратной реакции (влево) ↓ С (реагента) равновесие сместится в сторону прямой реакции (вправо) |
ПРАКТИЧЕСКАЯ ЧАСТЬ
| Пример №1 Записать уравнения скоростей для прямой и обратной реакции: Zn (тв) + Н 2 SO 4(ж) ® ZnSO 4(ж) + H 2(г) Во сколько раз возрастёт скорость реакции, если увеличить концентрацию ZnSO 4 в 2раза. Решение : Для прямой и обратной реакции: n пр. = Кпр.* С ( Н 2 SO 4 ) 1 n обр. = Кобр.∙ С ( Н 2 ) 1 .* С( ZnSO 4( ) 1 ¾ После повышения концентрации в 2 раза: n ** обр. = Кобр.∙ С ( Н 2 ) 1 .* 2*С( ZnSO 4( ) 1 ¾ Во сколько раз возрастёт скорость обратной реакции при увеличении концентрации ZnSO 4 в 2раза: n **обр = Кобр.∙ С (Н2) 1 .* (2*С(ZnSO4()) 1 = 21= 2 раза n обр. Кобр.∙ С ( Н 2 ) 1 .* С( ZnSO 4( ) 1 | Записать уравнения скоростей для прямой и обратной реакции: N 2(Г) + 3 Н 2(г) ® 2 N Н3 (г) Во сколько раз возрастёт скорость реакции, если увеличить концентрацию Н2 в 3 раза. Решение: ……………………………………………………………………. ……………………………………………………………………. ……………………………………………………………………. ……………………………………………………………………. ……………………………………………………………………. ……………………………………………………………………. ……………………………………………………………………. ……………………………………………………………………. ……………………………………………………………………. |
Пример №2
Определить скорость реакции при 600С , если при 200С она равна 0,5моль/л.с., а температурный коэффициент равен 2
 Дано: t1 = 200С, t2= 600С Дано: t1 = 200С, t2= 600С  = 2
Найти: n2 =?
Решение:
Пусть скорость реакции при 600С = 2
Найти: n2 =?
Решение:
Пусть скорость реакции при 600С
 будет равна n2 =Х
Подставим в формулу значения:
Х= 0,5 * 24= 8 моль/л.с. будет равна n2 =Х
Подставим в формулу значения:
Х= 0,5 * 24= 8 моль/л.с.
| Определить температурный коэффициент реакции если при изменении температуры на 200С , скорость данной реакции возросла с 10 моль/л.с., до 160 моль/л.с. Дано: ………………………………………………………………….. Решение: ………………………………………………………………….. ………………………………………………………………….. …………………………………………………………………. …………………………………………………………………. |
| Пример №3 Напишите выражение для константы равновесия гомогенной системы: СН4(г) + СО2 (г) ®2СО(г) + Н2(г) - Q Как следует изменить температуру и давление, чтобы повысить выход водорода? Решение: СН4 (г) + СО2 (г) ®2СО(г) + Н2(г) - Q (1+1=2 ) ( 2 + 1= 3 ) ¾ Снижение давления ↓Р- сместит равновесие в сторону реакции с большей суммой коэффициентов перед газообразными веществами, т.е. в сторону прямой реакции с образованием водорода. ¾ Значение (- Q) говорит о том, что прямая реакция эндотермическая , значит рост температуры приведёт к увеличению количества водрода. | Напишите выражение для константы равновесия гетерогенной системы H2S (г) + SО2 (г)→3S(тв)+2Н2 O(г) +Q Как следует изменить температуру и давление, чтобы повысить выход оксида серы? Решение: ……………………………………………………………………. ……………………………………………………………………. ……………………………………………………………………. ……………………………………………………………………. ……………………………………………………………………. ……………………………………………………………………. ……………………………………………………………………. ……………………………………………………………………. ……………………………………………………………………. ……………………………………………………………………. |
САМОСТОЯТЕЛЬНАЯ РАБОТА
Выполнить задания по указанной реакции: 2H2S (г) + 3О2 (г) = 2Н2О (г) + 2SO2 (г) + Q
1. Составьте уравнения скорости прямой и обратной реакции.Во сколько раз возрастёт скорость реакции, если увеличить концентрацию О2 в 3 раза.
2. Чему равен температурный коэффициент реакции , если при увеличении температуры на 40 0 С скорость реакции возросла в 5 раз?
3. Как следует изменить температуру и давление, чтобы повысить выход оксида серы?
Вывод:
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
ЛАБОРАТОРНАЯ РАБОТА №6
«ПОЛУЧЕНИЕ И ИЗУЧЕНИЕ СВОЙСТВ МЕТАНА, ЭТИЛЕНА, АЦЕТИЛЕНА, БЕНЗОЛА».
Цель: Экспериментально получить метан, этилен и ацетилен. Изучить свойстват метана, этилена, ацетилен и бензола.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
¾ Метан (СН4)-это газ без цвета и запаха, почти в два раза легче воздуха. Он плохо растворим в воде, но хорошо растворяется в органических растворителях. Смесь метана с кислородом в соотношении 1:2 и метана с воздухом 1:10 взрывоопасна. Обычно для обнаружения утечки метана в газопроводах, к нему добавляют небольшое количество, сильно пахнущего вещества (меркаптаны). Запишем реакции:
| 1. СН4 +CL2→………………………………………………. 2. СН4 +HNO3→…………………………………………… 3. 2СН4крекинг →……………………………………………. 4. 2СН4крекинг →……………………………………………. | 5.2СН4крекинг →…………………………………………………... 6.СН4 +O2 горение→……….……………………………………… 7.СН4 +O2 окисление→……….……………………………………. 8.СН4 +Н2O →……….………………………………………….. |
¾ Этилен (СН2=СН2) -это газ без цвета и практически без запаха, легче воздуха. Он плохо растворим в воде, но хорошо растворяется в органических растворителях (бензоле , хлороформе и т.п. С воздухом этилен и его газообразные гомологи образуют взрывчатые смеси. Запишем реакции.
| 1. СН2=СН2 +Н2→……………………………………… 2. СН2=СН2 +CL2→…………………………………… 3. СН2=СН2 +НCL→…………………………………… 4. СН2=СН2 +Н2О→…………………………………… | 5. СН2=СН2 +О2 горение→……………………………………. 6. СН2=СН2 +О2 окисление→..………………………………… 7. СН2=СН2 + СН2=СН2 +….n→…………………………… |
¾ Ацетилен (СН≡СН)-это газ без цвета и практически без запаха , легче воздуха. Он плохо растворим в воде ,как и большинстве органических растворителей. Ацетилен хорошо растворяется в ацетоне. С воздухом ацетилен образует взрывчатую смесь. Запишем реакции.
| 1. СН≡СН +Н2→……………………………………… 2. СН≡СН +CL2→…………………………………… 3. СН≡СН +НCL→…………………………………… 4. СН≡СН +Н2О→…………………………………… | 5. СН≡СН +О2 горение→………………………………………. 6. СН≡СН +О2 окисление→..…………………………………… 7. СН≡СН + СН≡СН →………………………………………. 8. 3СН≡СН →…………………………………………………. |
¾ Бензол (С6Н6) – это бесцветная , легкокипящая нерастворяющаяся в воде жидкостьТкип.=80,1°С;Т пл.=5,5 °С, при охлаждении бензол превращаетсяв бесцветные кристаллы. Бензол ядовит, имеет запах.
| 1. С6Н6+Н2→……………………………………… | 2. С6Н6+CL2 FeCL3→………………………………………. |
ПРАКТИЧЕСКАЯ ЧАСТЬ
| Ход работы | Рисунки, реакции, наблюдения. | Выводы | ||||
| Опыт №1 ПОЛУЧЕНИЕ МЕТАНА И ИЗУЧЕНИЕ ЕГО СВОЙСТВ | ||||||
| 1. Соберем прибор. Внесём в пробирку несколько грамм ацетата натрия и щёлочи. Закроем пробирку пробкой с газоотводной трубкой. Нагреем смесь, соберем газ. Подожжем полученный газ с помощью лучины. 2. Пропустим полученный газ через бромную воду и водный раствор КMnO4 |  Наблюдали:
………………………………………………………………………………………………………………………………………………………………………………
…………………………………………………………..
Допишем реакции:
СН3 COONa+NaOH ®…….……….………..
СН4+ О2®………………………………….... Наблюдали:
………………………………………………………………………………………………………………………………………………………………………………
…………………………………………………………..
Допишем реакции:
СН3 COONa+NaOH ®…….……….………..
СН4+ О2®…………………………………....
| Вывод: ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………… | ||||
| Опыт №2 ПОЛУЧЕНИЕ ЭТИЛЕНА ДЕГИДРОТАЦИЕЙ ЭТАНОЛА И ИЗУЧЕНИЕ ЕГО СВОЙСТВ | ||||||
| 1. Соберем прибор. Нальем в пробирку 1-2 мл. смесь этанола с Н2SO4 (конц.) Прибавим 0,5г. речного песка, закроем пробирку пробкой с газоотводной трубкой. Нагреем смесь, соберем газ и пропустим через раствор КMnO4. 2. Подожжем газ с помощью тлеющей лучины. |
……………………………………………………………………………………………………………………………………………………………………………………………………………………………… Допишем реакции: С2Н5ОН®………………………………..….. СН2=СН2 + О2 ®……………………...………..... СН2= СН2+Н 2О+ О КМпО4®……………… | Вывод: ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………… | ||||
| Опыт №3 ПОЛУЧЕНИЕ АЦЕТИЛЕНА ГИДРОТАЦИЕЙ КАРБИДА КАЛЬЦИЯ И ИЗУЧЕНИЕ ЕГО СВОЙСТВ | ||||||
| 1. Соберем прибор. Поместим в пробирку 1-2 кусочка карбида кальция и прильем 0,5мл воды. Закроем пробирку пробкой с газоотводной трубкой . Соберем газ и пропустим его через раствор КMnO4. 2. Газ подожжем с помощью тлеющей лучины. |
……………………………………………………………………………………………………………………………………………………………………………………………………………………………… Допишем реакции: СаС2+ Н2О ®…………………………… СН≡СН + О2 ® ………………………………. СН≡СН + Н2О +О К MnO 4® ………………………… | Вывод: ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………… | ||||
| Опыт №4 СВОЙСТВА БЕНЗОЛА | ||||||
| а) Физические свойства бензола Визуально определим свойства бензола. Растворим бензол в воде, эфире и спирте. Охладим пробирку с бензолом до t > 5,50C б) Химические свойства бензола ¾ Поместим немного бензола в фарфоровую чашку и подожжём. ¾ Добавим к 1мл. бензола столько же азотной и серной кислоты ¾ Пропустим через 1мл. бензола хлор в присутствии света ¾ Смешаем бензол с 1мл водного раствора КMnO4 и бромную воду | Наблюдали: ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………… Допишем реакции: С6Н6 + О2®………………………………..………….... С6Н6 + НNO3®……………………………………..…..
С6Н6 +К MnO 4 ®………………………………..………….. С6Н6 +бромная вода ®……………………..…..………….. | Вывод: ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………… | ||||
САМОСТОЯТЕЛЬНАЯ РАБОТА
Выполнить задание.

| ………………………………………………………………….. …………………………………………………………………. …………………………………………………………………… | …………………………………………………………………… …………………………………………………………………... …………………………………………………………………… |
Вывод:
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
ПРАКТИЧЕСКАЯ РАБОТА №12
Дата добавления: 2019-09-08; просмотров: 157; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!


 Наблюдали:
Наблюдали: Наблюдали:
Наблюдали: