СТРУКТУРНОЕ РАЗНООБРАЗИЕ БАКТЕРИЙ
Занятие 2. Движение бактерий
Ученых всегда восхищала подвижность простых организмов, таких, как бактерии. Действительно, бактерии - весьма привлекательный объект для изучения подвижности и связанных с ней проблем: их клеточная организация относительно проста (по сравнению с клетками эукариот). Биохимические процессы их хорошо изучены; кроме того, они быстро и в больших количествах размножаются, так что представляют собой идеальную систему для изучения биологических проблем.
Системы, предназначеные для обеспечения подвижности у эукариотических организмов, имеют сложную систему, однако у всех изученных клеток они построены из удивительно похожих элементов. Компоненты систем подвижности могут, очевидно, приспосабливаться к любым ситуациям. Сходство в строении основных компонентов подвижности указывает на то, что они кодируются генами, которые сохранились неизменными на протяжении всей клеточной эволюции.
По морфологическим свойствам и по белковому составу все структуры, создающие движение у эукариотических клеток, можно отнести к двум основным системам. Первая система строится из микротрубочек, основной компонент которых - тубулин, вторая - из микрофиламентов, содержащих главным образом актин. Эти две системы ответственны за различные типы движения. Микротрубочки связаны с движением ресничек и жгутиков, микрофиламенты - с амебоидным движением.
|
|
|
-18-
Наиболее распространенным типом движения бактерий является поступательное движение, осуществляющееся с помощью жгутиков. Расположение жгутиков на поверхности клетки может быть различным (рис. 2). Если жгутики находятся у полюсов или в полярной области, то имеет место полярное или субполярное расположение, если вдоль боковой поверхности, то говорят о латеральном расположении. В зависимости от числа жгутиков и их локализации на поверхности клетки различают монополярные монотрихи, монополярные политрихи, биполярные монотрихи, биполярные политрихи и перетрихи.
|
 |
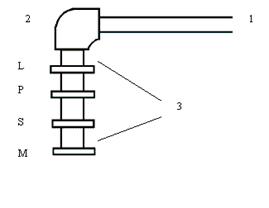
Рис. 2. Основные типы расположения жгутиков у бактерий:
1 - монополярный монотрих, 2 - монополярный политрих, 3 - биполярный монотрих, 4 - биполярный политрих, 5 - перитрих
Строение жгутика. Жгутик бактерий состоит из трех главных частей (см. рис. 3). Основную массу жгутика (до 95%) составляет длинная спиральная нить - тело жгутика. У большинства бактерий нить состоит только из одного белка - флагеллина. Белковые субъединицы уложены в виде спирали, внутри которой имеется полый канал.
|
|
|

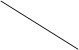 У поверхности клеточной стенки нить переходит в изогнутую структуру - крюк, который представляет собой цилиндр, диаметром большим или равным диаметру нити (20 нм), выполняющий функцию гибкого сочленения с базальным телом. Базальное тело представляет собой систему из двух или четырех колец, нанизаных на стержень, являющийся продолжением крюка.
У поверхности клеточной стенки нить переходит в изогнутую структуру - крюк, который представляет собой цилиндр, диаметром большим или равным диаметру нити (20 нм), выполняющий функцию гибкого сочленения с базальным телом. Базальное тело представляет собой систему из двух или четырех колец, нанизаных на стержень, являющийся продолжением крюка. |
|
|
-19-
 |
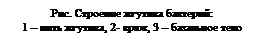
Два внутренних кольца (M и S) являются обязательными структурами базального тела, тогда как наружные кольца (P и L) отсутствуют у грамположительных бактерий, и, следовательно, не принимают участия в движении. М-кольцо локализовано в цитоплазматической мембране, а S-кольцо располагается в периплазматическом пространстве грамотрицательных или в пептидогликановом слое грамположительных бактерий. Кольца P и L у грамотрицательных бактерий локализованы соответственно в пептидогликановом слое и в наружной мембране. Функция этих колец сводится к тому, чтобы обеспечить наилучшее крепление стержня, проходящего через клеточную стенку грамотрицательных бактерий, в то время как у грамположительных эту функцию выполняет многослойный жесткий пептидогликановый мешок.
|
|
|
-20-
Электрохимический протонный градиент как движущая сила вращения жгутика. Для работы жгутикового мотора необходима энергия трансмембранного электрохимического протонного градиента, причем обе его составляющие - электрическая и концентрационная поддерживают движение бактерий, которое прекращается при добавлении в среду протонофорных разобщителей, устраняющих трансмембранный протонный градиент. Механизм образования электрохимического протонного градиента удобно рассмотреть на примере фототрофной бактерии R. rubrum, поскольку цитоплазматическая мембрана данных бактерий имеет систему дыхания и сопряженную с ней фотосинтетическую систему переноса электронов (рис. 4).
В темноте, в результате окисления сукцината, выполняющего роль донора электронов, происходит трансмембранный перенос водорода. При этом протон выводится из клетки в окружающую среду, а электрон поступает на цитохром с2, который является общим компонентом системы дыхания и фотосинтетической системы переноса электронов. Далее от цитохрома с2 электрон при участии цитохромоксидазы, роль которой выполняет цитохром о, передается на кислород. В результате восстановления кислорода образуется вода, что сопровождается связыванием протона из цитоплазмы клетки. Таким образом, в результате окисления сукцината в системе дыхания на цитоплазматической мембране возникает электрохимический протонный градиент.
|
|
|
На свету же электрон от цитохрома с2 передается на бактериохлорофилл реакционного центра и далее - в систему циклического переноса электронов. Преобразование световой энергии в электрическую протекает в реакционном центре, компоненты которого расположены трансмембранно, при этом происходит перенос электрона от фотовозбужденного бактериохлорофилла реакционного центра на первичный стабильный акцептор хинонной природы (QА).
-21-

Рис.4. Взаимодействие фотосинтетической и дыхательной систем переноса электронов в цитоплазматической мембране несерной пурпурной бактерии Rhodospirillum rubrum . (Бхл)2 - бактериохлорофильный димер реакционного центра; QA и QB- первичный и вторичный хинон реакционного центра; Q и Q Н2 - окисленная и восстановленная форма хинона мембранного фонда; bh и bi -высокопотенциальный и низкопотенциальный гем цитохрома b; с2 и с, - цитохром c2 и с,; цит. о - цитохромоксидаза; FeS и с1 -FeS-белок Риске и цитохром с1, входящие в состав b с1- комплекса; СДГ-сукцинатдегидрогеназа (сукцинат-Со Q-редуктаза), ТМФД - тетраметил - п - фенилендиамин
В дальнейшем электрон от акцептора QА передается на вторичный акцептор QB, роль которого выполняет рыхлосвязанный хинон, а бактериохлорофилл восстанавливается в результате принятия электрона от цитохрома с2. Второй электрон молекула хинона принимает от цитохрома bh. В результате принятия двух электронов идет и последовательное связывание из цитоплазмы клетки двух протонов. В протонированной форме хинон пересекает цитоплазматическую мембрану и на противоположной стороне мембраны последова-
-22-
тельно окисляется бактериохлорофиллом реакционного центра и цитохромом b1. В результате окисления хинона идет выброс двух протонов в окружающую среду. Особенностью данной циклической системы переноса электронов является возможность ее функционирования в анаэробных условиях в отсутствии доноров электронов.
Таким образом, функционирование фотосинтетической электронтранспортной системы, как и системы дыхания, приводит к созданию по обе стороны цитоплазматической мембраны протонного градиента, который служит движущей силой процесса фотофосфорелирования и движения бактерий.
Механизм работы жгутикового мотора. Гипотетическая модель работы жгутикового, мотора была предложена В. П. Скулачевым. Согласно этой модели вращение жгутика определяется вращением М-кольца, содержащего по периферии поясок из NH2- групп (рис. 5).
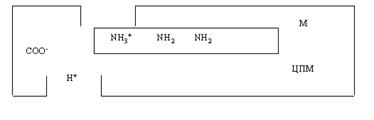 |
Рис. 5. Модель работы протонного мотора базальной структуры жгутика: М - кольцо, ЦПМ – цитоплазматическая мембрана бактериальной клетки
-23-
Одна из серии аминокислот открывается в верхний протонпроводящий путь. Анионная группа, например карбоксильная, прикреплена к мембране в начале нижнего протонпроводящего пути. Протонирование NH2 приводит к электростатическому притяжению между NH3-+ и COO--группами. Поскольку NH3+ прикреплена к кольцу М, то оно поворачивается, чтобы сблизить NH3+- и COO--группы. Вращение М-кольца приводит к перемещению следующей аминогруппы к верхнему протонному пути. Протонирование COO- сопровождается выбросом Н+ через нижний полуканал в цитоплазму клетки. Число транслоцирующих протонов за один поворот диска равен количеству –NH2-групп (=103).
Таким образом, жгутиковый мотор бактерий преобразует электрохимическую энергию протонного градиента в механическую, что проявляется во вращении жгутика и поступательном движении бактерий.
Таксисы бактерий. Целенаправленное движение бактерий, проявляющееся в виде ответной реакции организма на действующий фактор среды, называется таксисом. В зависимости от движения бактерий, к фактору или от него, выделяют положительный и отрицательный таксисы. Вещества, вызывающие положительный таксис называют аттрактантами, а отрицательный - репеллентами. Пo природе дeйcтвующего фактора различают хемотаксис, фототаксис, вискозитаксис, магнитотаксис и др.
Приготовление препаратов
Раздавленная капля. Для приготовления данного препарата на предметное стекло наносят каплю воды и помещают в нее небольшое количество молодой культуры микроорганизмов, размешивают и накрывают покровным стеклом. Культуру, выращенную на плотной питательной среде, переносят в каплю воды микробиологической петлей, культуру, выращенную в жидкой среде, - стерильной пипеткой или стеклянной палочкой. В этом случае каплю воды на предметное стекло можно не наносить. Капля исследуемого материала должна быть небольшой, чтобы после прижимания ее покровным стеклом не было избытка жидкости, выступающей из-под него. В противном случае избыток жидкости удаляют фильтровальной бумагой. Готовый препарат помещают на предметный столик микроскопа и рассматривают его под иммерсией, предварительно нанеся в центр покровного стекла кап-
-24-
лю иммерсионного масла.
При наблюдении под микроскопом можно заметить активное движение бактерий, которые перемещаются в разных направлениях с разной скоростью. Не следует путать самостоятельное движение бактерий с броуновским движением в воде мельчайших частиц, вызывающих беспорядочные колебания клеток на одном месте. Движение бактерий не следует также путать с чисто механическим движением, когда с током жидкости все частицы, находящиеся в ней, передвигаются в одном направлении с одинаковой скоростью.
Для изучения механизма движения бактерий следует провести опыты с протонофорным разобщителем (10-6) и соляной кислотой (5%-ный раствор). Для этого на стык покровного и предметного стекол стеклянной палочкой наносят каплю разобщителя, который устраняет электрохимический протонный градиент на мембране, что приводит к прекращению движения бактерий. Если после прекращения движения в среду аналогичным образом внести соляную кислоту, что создает искусственный протонный градиент, то клетки вновь начнут двигаться.
После окончания наблюдений поднимают тубус микроскопа, препарат снимают с предметного столика и помещают в сосуд с дезинфицирующей жидкостью, а объектив протирают бензином.
Висячая капля. Для приготовления этого препарата каплю клеточной суспензии наносят в центр покровного отекла, которое переворачивают каплей вниз и помещают на специальное предметное стекло с лункой в центре. Капля должна свободно висеть, не касаясь краев и дна лунки. Края лунки предварительно смазываются вазелином. Капля оказывается герметизированной во влажной камере, что позволяет вести многодневные наблюдения за объектом. Полученный препарат микроскопируют. Для этого на поверхность покровного стекла наносят каплю иммерсионного масла и под контролем глаза сбоку опускают в нее объектив, не касаясь покровного стекла. Затем, наблюдая в окуляр, медленно поднимают тубус микроскопа до получения ясного изображения. После просмотра препарата стекла кладут в дезинфицирующий раствор, а объектив протирают.
Препарат отпечаток. Из агаризованной среды, на которой микроорганизмы растут сплошным газоном, вырезают скальпелем небольшой кубик и переносят его на предметное стекло так, чтобы поверхность с микроорганизмами была обращена вверх. Затем к колонии прикладывают чистое покровное стекло, слегка придавляют его и тот
-25-
час же снимают, стараясь не сдвинуть в сторону. Полученный препарат помещают в каплю воды на предметное стекло. Отпечаток можно получить и на предметном стекле, если касаться им поверхности колонии. В качестве объекта исследования для приготовления данного препарата может быть использован свежий сыр. Для этого небольшой кусок сыра сдавливают между двумя предметными стеклами. Затем сыр убирают, на отпечаток наносят каплю воды, накрывают покровным стеклом и микроскопируют под иммерсией.
Объекты исследования: Клеточная суспензия несерных пурпурных бактерий R. rubrum, культуры бактерий на твердой питательной среде, сыр.
Задания
1. Приготовить препарат «раздавленная капля» (используя жидкую культуру фототрофных бактерий) и провести опыты с разобщителем и соляной кислотой. На основе наблюдений сделать выводы.
2. Приготовить препарат «висячая капля», используя ту же культуру бактерий.
3. Приготовить препарат «отпечаток», используя культуры бактерий на твердой питательной среде и сыр.
Контрольные вопросы Строение и механизм вращения жгутика. Таксисы.
Занятие 3. Клеточная стенка бактерий
Клеточная стенка является важным и обязательным компонентом для большинства прокариотных организмов. Она служит механическим барьером между протопластом и внешней средой и придает клетке определенную, присущую ей форму.
В 1884 г. Грамом был разработан метод комплексного окрашивания бактерий йодом с фиолетовым красителем. При последующей обработке клеток этиловым спиртом и промывке водой у одних видов бактерий (грамположительных) данный комплекс остается в клетке, и они окрашиваются в синий цвет, а у других (грамотрицательных) комплекс вымывается, и они обесцвечиваются. Способность или неспособность окрашиваться по Граму, что связано с различиями в строении клеточной стенки, является важным диагностическим признаком и позволяет разделить бактерии на две большие группы.
Исследование химического состава клеточной стенки показа-
-26-
ло, что ее основным компонентом является муреиновый комплекс, составляющий у грамположительных бактерий основную массу клеточной стенки, а у грамотрицательных лишь 10%. Муреиновый комплекс представлен гетерополимерами, построенными на основе чередующихся остатков ацетилглюкозамина и ацетилмурамовой кислоты, соединенной с пептидной цепочкой. Характерной особенностью данного пептида является то, что синтез его идет не на рибосомах, а при участии ферментов, и в состав его входят аминокислоты D- формы. У грамположительных бактерий клеточная стенка состоит из мощного многослойного муреинового каркаса, а у грамотрицательных муреиновый комплекс однослойный. Другим отличием грамположительных бактерий является присутствие в составе клеточной стенки тейховых кислот, которые прочно связаны с муреиновым комплексом. Данные кислоты представляют собой полимеры, построенные на основе глицерина, и не входят в состав клеточной стенки грамотрицательных бактерий. Данные группы микроорганизмов отличаются также и аминокислотным составом клеточной стенки. У грамотрицательных бактерий кроме муреинового комплекса в составе клеточной стенки имеется белковый слой, включающий полный набор аминокислот, в то время как у грамположительных бактерий в составе клеточной стенки их не более четырех, поскольку именно четыре аминокислоты входят в пептидную цепочку муреинового комплекса.
Химический состав и строение клеточной стенки определяют и такое свойство бактерий как кислотоустойчивость. Она обусловлена высоким содержанием в клеточной стенке миколовых кислот и присуща некоторым микобактериям. Для выявления данного свойства используют концентрированные растворы красок и нагревание. В результате такой обработки клетки приобретают окраску и не обесцвечиваются при последующем воздействии крепких растворов кислот и щелочей.
Приготовление препаратов
Окраска по Граму. На предметном стекле из предложенной для исследования культуры готовят мазок, который просушивают на воздухе и фиксируют в пламени горелки. Так как окраска по Граму у некоторых видов бактерий с возрастом может изменяться, для проведения этой методики всегда берут молодые односуточные культуры. Далее препарат последовательно обрабатывают раствором Люголя и
-27-
1%-ным раствором кристаллического (или генцианового фиолетового) по 2 мин каждым, не промывая мазок между сменой красителей. После окраски препарата двумя красителями его нужно промыть водой. Клетки грамположительных и грамотрицательных бактерий на этом этапе имеют одинаковый синий цвет.
Затем препарат, промытый водой, обрабатывают 96%-ным этиловым спиртом, нанося его пипеткой на мазок или внося предметное стекло с препаратом в стакан с этиловым спиртом. После обработки спиртом препарат промывают водой. Поскольку данный этап является наиболее важным в осуществлении всей процедуры окраски по Граму, следует готовить не один, а несколько препаратов для каждой из исследуемых культур и варьировать время обработки препарата спиртом от 15 до 60 с. Препараты на этом этапе следует проконтролировать под микроскопом. Клетки грамположительных бактерий будут иметь синий цвет, а грамотрицательные обесцвечены. Если результат будет удовлетворительным, препарат докрашивают фуксином не более 30 с. Промытый и высушенный препарат просматривают под микроскопом, используя иммерсионный объектив. При этом клетки грамположительных бактерий будут иметь фиолетовый цвет, а грамотрицательные - розовый.
КОН-метод определения грамположительных и грамотрицательных бактерий состоит в том, что на предметное стекло наносят каплю 3%-ного водного раствора КОН, в эту каплю петлей вносят исследуемую культуру бактерий и тщательно перемешивают. Если за 60 с суспензия бактерий в КОН становится вязкой или желеобразной, то анализируемая культура является грамотрицательной, а если консистенция раствора не меняется - культура грамположительная. Данный метод является более быстрым, простым и дешевым, и следовательно, может быть успешно использован для быстрой идентификации вновь выделенных микроорганизмов.
Определение кислотоустойчивости по Циль-Нильсену. Данный метод получил наиболее широкое применение для выявления кислотоустойчивости бактерий. На предметном стекле готовят два мазка - исследуемых клеток и клеток кислотоустойчивых бактерий. Препараты высушивают на воздухе и фиксируют в пламени горелки. На мазки помещают полоски фильтровальной бумаги и заливают карболовым фуксином Циля, а затем препарат 2-3 раза подогревают до появления паров, держа стекло высоко над пламенем горелки. Глядя на мазок сбоку, наблюдают за появлением пара и, когда это происходит, тотчас
-28-
препарат отставляют в сторону. Затем препарату дают остыть, снимают с него фильтровальную бумагу, промывают водой и обесцвечивают 5% -ным раствором серной кислоты. Для этого предметное стекло с препаратом погружают 2-3 раза в стакан с кислотой или наносят кислоту пипеткой на мазок и выдерживают 5 с. Далее препарат обрабатывают спиртом 10 с, промывают водой, высушивают на воздухе и микpocкoпиpуют под иммерсией. При строгом соблюдении режима окраски кислотоустойчивые клетки приобретают красный цвет, а некислотоустойчивые – синий. Данное свойство можно определять у клеток любого возраста.
Объекты исследования. Чистые культуры бактерий: Bacillus subtilis, Bacillus mesentericus.
Задания
1. Провести окраску бактерий по Граму в три этапа:
· обработка комплексом красителей и промывка водой,
· обработка спиртом и промывка водой,
· обработка фуксином и промывка водой.
Приготовленные препараты каждого из этапов просмотреть под микроскопом и результаты наблюдений зарисовать в тетради.
2. Провести идентификацию грамположительных и грамотрицательных бактерий используя КОН- метод.
3. Провести идентификацию бактерий на кислотоустойчивость по Циль-Нильсену.
Контрольные вопросы Состав и строение клеточной стенки грамположительных и грамотрицательных бактерий. Методика окраски бактерий по Граму. Кислотоустойчивость бактерий.
Занятие 4. Капсулы и слизистые чехлы
Снаружи клеточная стенка бактерий может быть окружена слизистым веществом. В зависимости от его толщины и консистенции различают макро- и микрокапсулы, а также слизистые чехлы. Под капсулой понимают слизистое образование, имеющее четко очерченную поверхность и прочную связь с клеточной стенкой. Если толщина сли зистого образования меньше 0,2 мкм и, следовательно, оно может быть обнаружено только с помощью электронного микроскопа, то его следует отнести к микрокапсуле, если больше 0,2 мкм, то - к макрокапсу-
-29-
ле которую можно видеть в обычный световой микроскоп. Если же окружающее клетку слизистое вещество имеет аморфный, бесструктурный вид и легко отделяется от поверхности клетки, то его определяют как слизистый чехол. Между этими тремя структурами у бактерий обнаружено много переходных форм.
Наличие капсул зависит от штамма микроорганизма и условий его культивирования. Некоторые бактерии, образующие капсулу, могут легко, в результате мутации превращаться в бескапсульные формы. Наличие или отсутствие капсулы можно обнаружить невооруженным глазом по морфологии колоний, образующихся на твердой среде. Колонии, состоящие из клеток, окруженных капсулами, имеют гладкую поверхность, а колонии, сформированные из бескапсульных клеток, - шероховатую.
Изучение строения капсул показало, что они имеют многослойную упорядоченную ультраструктуру, которая в свою очередь, имеет фибриллярное строение. Фибриллы, формирующие отдельные слои капсул, могут быть расположены параллельно или перпендикулярно клеточной стенке. Капсулы содержат некоторые компоненты, одинаковые с клеточной стенкой, и поэтому их в какой-то степени можно рассматривать как производные клеточной стенки. Однако химический состав капсулы и клеточной стенки не идентичны. Основными химическими компонентами капсул большинства бактерий являются полисахариды гомо- или гетерополимерной природы. В первом случае они построены из сахарного остатка одного типа, во втором – из различных сахарных остатков.
Капсулы не являются обязательными структурами клетки, так как отсутствие их не приводит к нарушению клеточной активности. Однако капсулы выполняют определенные функции, полезные для клетки. Слизистые покрытия многих прокариот обладают антигенными свойствами, могут служить источником запасных питательных веществ, предохраняют клетку от механических повреждений, от высыхания, препятствуют проникновению фагов, осуществляют связь клеток в колонии.
-30-
Приготовление препаратов
Метод негативной окраски чаще всего применяется для выявления капсул. С этой целью небольшое количество клеток с плотной среды помещают в каплю разбавленного фуксина, смешивают с каплей туши, накрывают покровным стеклом и микроскопируют. При этом на общем темном фоне препарата хорошо видны бесцветные капсулы, окружающие клетки, окрашенные в розовый цвет. Существуют и специальные методы окраски капсул.
Окраска капсул по методу Гинса. На конец предметного стекла петлей наносят каплю черной туши, добавляют клетки, перемешивают и ребром покровного стекла делают мазок по всей поверхности стекла. Мазок высушивают на воздухе и фиксируют. Далее мазок окрашивают карболовым фуксином 3 мин, промывают водой, вновь высушивают и микроскопируют с иммерсионной системой. На темно-сером фоне препарата видны розовые клетки бактерий, окруженные бесцветными капсулами.
Окраска капсул по методу Мисена. Готовят мазок, высушивают на воздухе, фиксируют в пламени горелки и красят раствором метиленового синего 3 мин, подогревая до появления пара. Препарат охлаждают, промывают водой, подсушивают и микроскопируют. Капсулы окрашиваются в светло-розовый цвет, бактерии в темно-синий.
Окраска капсул по Антони. Готовят мазок, высушивают его на воздухе, красят 2 мин 1%-ным раствором кристаллического фиолетового, промывают 2%-ным раствором медного купороса, подсушивают и микроскопируют. В поле зрения на сером фоне препарата капсулы остаются неокрашенными, а бактерии окрашиваются в фиолетовый цвет.
Объекты исследований: Bacillus subtilis, Sarcina flava.
Задание
1. Из предложенных культур приготовить препараты для выявления капсул разными методами. Просмотреть под микроскопом и зарисовать.
Контрольные вопросы Капсулы и их значение в жизни клетки.
-31-
Занятие 5. Споры бактерий
Бактерии рода Bacillus, Clostridium и Plectridium так же как отдельные кокки и спириллы, способны образовывать споры (эндоспоры) – тельца сферической или эллиптической формы, устойчивые к воздействию неблагоприятных факторов. Как правило, внутри бактериальной клетки образуется только одна спора. Однако в последнее время у отдельных видов Clostridium обнаружены клетки с двумя и более спорами. Обычно спорообразование начинается, когда бактерии испытывают недостаток питательных веществ или когда в среде в большом количестве накапливаются продукты обмена веществ бактерий. Поэтому споры можно рассматривать как приспособление организма для выживания в неблагоприятных условиях среды.
Таким образом, можно сделать вывод, что споры бактерий – уникальные по структуре и свойствам образования, не имеющие аналогов по степени устойчивости к неблагоприятным факторам среды. Формирование спор зависит от условий роста. Споры могут оставаться живыми в условиях, когда вегетативные клетки, то есть клетки, не образовывающие споры, погибают. Для уничтожения спор требуется температура пара 120°С при давлении его 1 атм. При этих условиях споры погибают через 20 мин.
Общая схема спорообразования может быть представлена в следующем виде. В результате деления бактериальной клетки, сопровождающегося выпячиванием цитоплазматической мембраны, наблюдается обособление двух протопластов, при этом один из них накрывается другим.
Дальнейшее развитие споры заключается в образовании нескольких слоев споровых покровов и ее созревании. Диаметр споры приблизительно равен диаметру клетки, в которой она образовалась, или несколько превышает его. Споры имеют вид плотных сильно преломляющих свет телец овальной или сферической формы. В зависимости от расположения спор клетки имеют различную форму. Споры могут образовываться в центре клетки, не вызывая изменение ее формы, – бациллярный тип; в центре клетки и изменять ее форму – клостридиальный тип; на конце клетки, придавая ей вид барабанной палочки, – плектридиальный тип.
После созревания споры клеточная стенка вегетативной части клетки разрушается, и спора выходит в окружающую среду. При попадании в благоприятные условия спора начинает прорастать. Споры
-32-
бактерий могут длительное время (десятки, сотни и даже тысячи лет) существовать в покоящемся состоянии.
Приготовление препаратов
Споры обладают многослойными труднопроницаемыми оболочками, поэтому при простой обработке препарата спорообразующих бактерий фуксином или генциановым фиолетовым споры не окрашиваются, а обнаруживаются в клетках в виде бесцветных включений. Для окраски спор используют специальные сложные методы.
Метод Пешкова. На предметном стекле готовят мазок исследуемой культуры, высушивают на воздухе, фиксируют в пламени горелки и заливают раствором метиленового синего по Леффлеру. Краситель доводят до кипения, держа предметное стекло над пламенем горелки. По мере испарения красителя добавляют новые его порции. Продолжительность окраски с момента закипания – 20с. Затем предметное стекло охлаждают, препарат промывают водой, что вызывает обесцвечивание цитоплазмы, и докрашивают 30 с 0,5%-ным водным раствором нейтрального красного. Вновь промывают водой, подсушивают и микроскопируют под иммерсией. При правильном окрашивании клетки имеют красный, а споры – синий цвет.
Метод Златогорова. Готовят мазок, высушивают и фиксируют в пламени горелки. На мазок кладут полоску фильтровальной бумаги и красят карболовым фуксином Циля, подогревая препарат 10 мин до появления паров (в результате споры и клетки окрашиваются в красный цвет), снимают бумажку и 10 с обесцвечивают 5% -ным раствором серной кислоты (споры остаются окрашенными в красный цвет), затем промывают водой. В дальнейшем препарат дополнительно окрашивают 1 мин раствором метиленового синего (окрашиваются только клетки), промывают водой, подсушивают на воздухе и микроскопируют под иммерсией. При данном методе вегетативные клетки окрашиваются в синий цвет, споры - в красный.
Объекты исследования. Грамположительные бактерии рода Bacillus , Clostridium и Plectridium.
Задание
1. Приготовить по данным методикам препараты из предложенных культур на выявление спор. Просмотреть под микроскопом и зарисовать.
Контрольные вопросы Типы спорообразования. Формирова-
-33-
ние споры. Роль спор в жизни бактерий.
Занятие 6. Запасные вещества и морфология дрожжей
Многие микроорганизмы в определенных условиях образуют запасные вещества, которые обнаруживаются в клетке в виде гранулярных цитоплазматических включений. Накопление их в клетке происходит в условиях избыточного содержания, прежде всего энергетических субстратов в среде. Поэтому важнейшей функцией запасных веществ является энергетическое обеспечение синтеза индуцибельных ферментов в период адаптации клеток к меняющимся условиям окружающей среды. Природа запасных веществ может быть различна, но чаще всего это полисахариды, липиды, полифосфаты или молекулярная сера.
Липидные гранулы. У дрожжей или мицелярных грибов запасные липиды представлены нейтральными жирами, которые легко обнаруживаются в живых клетках без специальных методов окраски в виде сильно преломляющих свет капель. Бактерии в качестве резервных липидов синтезируют поли-β-оксимасляную кислоту (ПОМ), которая образует округлые или продолговатые гранулы, окруженные белковой мембраной. С мембраной связаны ферменты синтеза и распада ПОМ. Важным фактором, способствующим накоплению ПОМ у разных бактерий, является увеличение концентрации питательных веществ в среде – глюкозы, пирувата, а также лимитирование экзогенного источника азота. В некоторых случаях ПОМ может составлять до 80% массы клеток. Распад гранул ПОМ наблюдается в средах, обедненных источником энергии и углерода, и связан с ферментативным гидролизом полимера, в результате которого образуются мономеры β-оксимасляной кислоты. В дальнейшем эта кислота преобразуется в ацетат, который метаболизируется через цикл трикарбоновых кислот.
Гранулы углеводной природы (полисахариды) являются производными глюкозы и представлены крахмалоподобными веществами - гранулезой и гликогеном. Их накопление стимулируется недостатком азота при избытке источника углерода и энергии и может достигать 50% массы клетки. При обеднении среды данные полисахариды могут служить источником углерода и энергии для развития бактерий.
Полифосфаты (волютин), накапливаясь в клетке, образуют овальные гранулы. Они представляют собой запас фосфора, который может быть использован клеткой. Особенно энергичное накопление
-34-
волютина происходит при перенесении бактерий из среды, лимитированной по фосфату, в среду, богатую ими.
Дрожжи являются наиболее удобными объектами исследований по выявлению запасных питательных веществ. Дрожжи представляют собой одноклеточный организм и в то же время обладают чертами, характерными для эукариотических клеток. Это, в сочетании с хорошо изученной генетической системой делает их идеальным организмом для исследования основ клеточной биологии эукариотических клеток.
Клетки разных видов дрожжей значительно крупнее бактериальных и морфологически весьма разнообразны. Они бывают круглые, овальные, цилиндрические, яйцевидные, колбовидные, треугольные, стреловидные и серповидные (см. рис.6).
|
 |
Рис. 6. Морфология и размножение дрожжей: 1 – шаровидные и палочковидные почкующиеся клетки; 2 – элипсовидные клетки со спорами; 3 – вытянутые делящиеся клетки
Это одноклеточные, неподвижные организмы. Дрожжевая клетка содержит дискретное ядро, окруженное ядерной мембраной, деление ядра протекает по механизму митоза, при котором хромосомы делятся и расходятся в метафазе. Кроме того, жизненный цикл дрожжей включает плазмогамию и мейоз, а также чередование гаплоидной и диплоидной фаз развития. Все это - характерные черты любого эукариотического организма. Другие свойства – наличие митохондрий, структура хромосом и природа белок-синтезирующей системы – имеют характер прокариотических.
Наиболее распространенным способом вегетативного размно
-35-
жения дрожжей является почкование. При этом, дочерняя клетка возникает в виде маленькой почки, которая растет в течение большей части клеточного цикла, пока не достигнет размера материнской клетки. Рост дрожжей происходит в основном во время формирования почек, поэтому почка к моменту ее отделения становится по размеру более или менее такой же, как зрелая клетка. Клетки могут разойтись вскоре после деления, однако часто еще до их расхождения начинаются новые циклы клеточного деления, в результате которых клетки иногда не отделяются друг от друга и образуют псевдомицелий, что характерно для дрожжей Candida.
Размножение делением встречается реже. Оно свойственно видам Schizosaccharomyces, клетки которых после деления могут не расходиться, в результате чего формируется истинный мицелий. Половое размножение большинства дрожжей (аскомицетов) связано с образованием репродуктивных структур – асков и аскоспор, которые формируются при ухудшении условий среды культивирования. Обычно половой процесс чередуется с вегетативным размножением.
Дрожжи имеют типичную для эукариотной клетки структурную организацию. Клеточная стенка дрожжей, в отличие от бактерий, легко различима в световом микроскопе. Клетки некоторых дрожжей могут иметь полисахаридную капсулу. В цитоплазме имеется ядро, митохондрии; как и у всех эукариотных организмов хорошо развит мембранный аппарат, представленный эндоплазматической сетью, аппаратом Гольджи и лизосомами. Клетки дрожжей при определенных условиях культивирования содержат гликоген, волютин, липиды.
Приготовление препаратов
Гликоген. Для его обнаружения используют клетки дрожжей, выросшие на пивном сусле и затем помещенные в раствор 20%-ной сахарозы. В этих условиях клетки за сутки образуют большое количество гликогена. Клеточную суспензию в виде небольшой капли наносят на предметное стекло и добавляют к ней каплю раствора Люголя. Препарат накрывают покровным стеклом и через 2-3 мин микроскопируют под иммерсией. Наличие в цитоплазме бурых зернышек или крапинок указывает на присутствие гликогена. Поскольку реакция на гликоген хорошо идет в кислой среде, то перед выявлением в клетках гликогена среду, в которой выдерживали микроорганизмы, подкисляют. При подогревании препарата до 60°С бурая окраска гликогена исчеза-
-36-
ет, а после охлаждения восстанавливается.
Гранулеза. Наряду с гликогеном в клетках может накапливаться в качестве запасного вещества полисахарид гранулеза, которая в результате взаимодействия с иодом окрашивается в тёмно-синий цвет. Для выявления гранулезы используют дрожжи, предварительно выдержанные на среде с картофелем. Клеточную суспензию вносят петлей в каплю раствора Люголя, накрывают покровным стеклом, выдерживают 2-3 мин и микроскопируют под иммерсией.
Волютин. Для выявления волютина используют дрожжи, выросшие на средах, богатых фосфатами. Из микробной культуры готовят мазок, высушивают на воздухе и фиксируют в пламени горелки. На фиксированный мазок наливают пипеткой метиленовый синий по Леффлеру и красят 3 мин. Затем препарат промывают водой, накрывают покровным стеклом и микроскопируют. При этом клетки окрашиваются в голубой цвет, а волютин имеет вид капель сине-фиолетового цвета. Если на стык покровного и предметного стекла нанести каплю 1%-ной серной кислоты, то в результате ее действия происходит обесцвечивание цитоплазмы клетки, за исключением волютина.
Жир. Для выявления жира используют дрожжи, выдержанные на среде с 2%-ной глюкозой. Готовят препарат мазок, высушивают на воздухе, фиксируют в пламени горелки, окрашивают 3 мин суданом Ш, микроскопируют под иммерсией. Включения жира окрашиваются в оранжевый цвет.
Сера. Включение серы встречаются только у прокариот. Благодаря двойному лучепреломлению капли серы хорошо заметны в клетках без специального окрашивания и исчезают при обработке клеток спиртом или при действии ледяной уксусной кислоты.
Дата добавления: 2019-09-02; просмотров: 303; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
