Мимовільність і ступінь протікання окислювально-відновних реакцій
Як було зазначено вище, у гальванічних елементах протікають мимовільні окислювально-відновні реакції. Іншими словами, будь-яка реакція, за допомогою якої в гальванічному елементі одержують позитивну е.р.с., повинна бути мимовільною. Отже, використовуючи потенціали напівреакцій для обчислення е.р.с. зв'язаної з ними повної окислювально-відновної реакції, можна визначити, чи належна ця реакція протікати мимовільно. При цьому варто користуватися таким правилом: позитивна е.р.с. указує на мимовільний процес, у той час як негативна е.р.с. указує на немимовільний процес.
Е.р.с. і зміна вільної енергії
Відомо, що зміна вільної енергії ΔG, яким супроводжується хімічний процес, є мірою мимовільності його протікання. Оскільки е.р.с. електрохімічного елемента, де протікає окислювально-відновна реакція, указує, наскільки вона мимовільна, неважко зрозуміти, що між е.р.с. електрохімічного елемента і зміною вільної енергії реакції, що протікає в ньому, повинно існувати визначене співвідношення.
Таке співвідношення дійсно існує:
ΔG = – nFE (4.1)
У цьому рівнянні Е – е.р.с. електрохімічного елемента, n – число молів електронів, стерпних в окислювально-відновній реакції, a F-постійна, що носить назву число Фарадея (по імені Майкла Фарадея). Число Фарадея являє собою електричний заряд 1 моля електронів, і ця кількість заряду зветься фарадей (Ф):
1Ф = 96 500  = 96 500
= 96 500  (4.2)
(4.2)
|
|
|
У тому випадку, якщо реагенти і продукти знаходяться в стандартних станах, рівняння (4.1) здобуває вид
∆G° = –nFE° (4.3)
Е.р.с. і константа рівноваги
Доведено, що стандартна зміна вільної енергії ∆G° зв'язана з константою рівноваги. До рівнянням (4.4):
∆G° = – 2,30• R• T• lgК (4.4)
З цього рівняння випливає, що стандартна е.р.с. окислювально-відновної реакції Е° повинна бути зв'язана з константою рівноваги співвідношенням
–nFE° = – 2,30 R• T• lg К
відкіля  (4.5)
(4.5)
Якщо застосувати це рівняння при Т = 298 К и підставити в нього чисельні значення величин R і F, воно спроститься:
 (4.6)
(4.6)
Отримані рівняння показують, що стандартна е.р.с. електрохімічного елемента тим більше, чим більше константа рівноваги реакції, що протікає в електрохімічному елементі.
Е.р.с. і концентрація
На практиці гальванічні елементи рідко діють при стандартних умовах. Однак е.р.с. елемента, що працює при нестандартних умовах, можна обчислити по Е°, температурі і концентраціям реагентів і продуктів у гальванічному елементі. Рівняння, що дозволяє проводити такі розрахунки, виводиться зі співвідношення між ∆G і ∆G°:
|
|
|
∆G = ∆G° + 2,30 R T lgQ (4.7)
Оскільки, відповідно до рівняння (4.1), ∆G = – nFE, можна записати, що
– nFE = – nFE° + 2,30 R T lgQ
Вирішуючи попереднє рівняння відносно Е, знаходимо
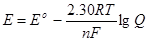 (4.8))
(4.8))
Це співвідношення відоме за назвою рівняння Нернста, по імені Германа Вальтера Нернста (1864-1941), німецького хіміка, що зіграв важливу роль у створенні теоретичних основ електрохімії. При 298 К величина 2,30 RT/F має значення 0,0591 В, що дозволяє записати рівняння Нернста в більш простому виді:
 (4.9)
(4.9)
Щоб проілюструвати застосування рівняння (4.9), розглянемо реакцію Zn(тв.) + Cu2+ (водн.)  Zn2+ (водн.) + Cu (тв.) Е° = 1,10 В
Zn2+ (водн.) + Cu (тв.) Е° = 1,10 В
У даному випадку n = 2, і рівняння Нернста дає
 (4.10)
(4.10)
Нагадаємо, що у вираження для Q входять тільки концентрації іонів у розчині, але воно не включає концентрації твердофазних учасників реакції. Експериментально встановлено, що е.р.с. електрохімічного елемента не залежить від розміру і форми твердих електродів. З рівняння (4.10) випливає, що е.р.с. гальванічного елемента, у якому протікає окислювально-відновна реакція між міддю і цинком, зростає при підвищенні [Cu2+] і зменшенні [Zn2+]. Наприклад, при [Cu2+] = 5,0 і [Zn2+] = 0,050 М маємо
|
|
|


У загальному випадку, якщо концентрації реагентів підвищуються щодо концентрацій продуктів, це приводить до підвищення ступеня мимовільності реакції, що протікає в гальванічному елементі, і зростанню його е.р.с. І навпаки, якщо концентрації продуктів підвищуються в порівнянні з концентрацією реагентів, е.р.с. зменшується. Під час дії електрохімічного елемента відбувається витрата реагентів і утворення продуктів. Зв'язане з цим зменшення концентрацій реагентів і зростання концентрацій продуктів викликає поступове зменшення е.р.с. елемента [1, 7, 8, 11].
Дата добавления: 2019-09-02; просмотров: 283; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
