Темы собеседования при защите
Лабораторная работа № 7
Изучение диаграммы температура кипения – состав пара над жидкими двухкомпонентными растворами
Цель работы:1) ознакомление с методом разделения двухкомпонентных смесей; 2) построение диаграммы температуры кипения – состав пара над жидкими бинарными смесями.
Теоретические сведения
Раствором называются химические фазы переменного состава. Различают газовые, жидкие и твердые растворы. В теории растворов рассматривают два основных класса: идеальные и реальные растворы.
Растворы, которые при любых концентрациях подчиняются закону Рауля, называются идеальными. К идеальным растворам относят и бесконечно разбавленные растворы. Закон Рауля формулируется следующим образом: относительное понижение давления насыщенного пара растворителя  над раствором равно мольной доле растворенного вещества
над раствором равно мольной доле растворенного вещества  :
:

Мольной долей  –го компонента раствора
–го компонента раствора  называется отношение числа молей
называется отношение числа молей  –го компонента к сумме чисел молей двух компонентов раствора
–го компонента к сумме чисел молей двух компонентов раствора  :
:
 (1)
(1)
В идеальном растворе силы взаимодействия между одноименными и разноименными молекулами или частицами двух веществ одинаковы. Образование раствора не сопровождается тепловым эффектом, и его объем равен сумме объемов каждого компонента.
К идеальным растворам относятся двухкомпонентные системы бензол 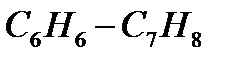 , гексан
, гексан  – гекпан
– гекпан  , вода
, вода  – тяжелая вода
– тяжелая вода  . Из закона Рауля следует, что давление насыщенного пара компонента вид раствором выражается линейной функцией его концентрации, выраженной в мольных долях. Указанная зависимость представлена на рис.1. Величины
. Из закона Рауля следует, что давление насыщенного пара компонента вид раствором выражается линейной функцией его концентрации, выраженной в мольных долях. Указанная зависимость представлена на рис.1. Величины  означают соответственно общее давление насыщенного пара, парциальные для компонентов
означают соответственно общее давление насыщенного пара, парциальные для компонентов 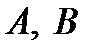 давления насыщенного пара над раствором
давления насыщенного пара над раствором  ,
,  - давления насыщенного пара компонентов
- давления насыщенного пара компонентов  над жидкостями
над жидкостями  соответственно.
соответственно.
|
|
|

Рис. 1 Зависимость общего и парциальных давлений пара от состава
идеального раствора А-В (Т = const).
Свойства реальных растворов отклоняются от закона Рауля, их образование сопровождается тепловым эффектом, зависящим от концентрации раствора и температуры.
По отклонению свойств растворов от идеального закона судят о силе и характере взаимодействия между его компонентами. Различают положительные и отрицательные отклонения от закона аддитивности. Положительные отклонения имеют место при повышении давления насыщенного пара над раствором по сравнению с идеальным значением. Положительное отклонение свойства раствора от закона идеальности показано на рис.2.
|
|
|

Рис. 2. Зависимость общего и парциальных давлений пара от состава
неидеального раствора А-В с положительным отклонением
от закона Рауля (сплошные линии) (Т = const).
При положительных отклонениях от закона Рауля система характеризуется более сильным притяжением одно именных частиц раствора 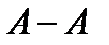 и
и  по сравнению с притяжением разноименных частиц
по сравнению с притяжением разноименных частиц  . При этом система стремится к расслаиванию, что приводит к повышенной летучести компонентов. Образование растворов с положительными отклонениями от закона Рауля, как правило, сопровождается поглощением тепла и увеличением объема системы. К таким растворам относятся системы ацетон
. При этом система стремится к расслаиванию, что приводит к повышенной летучести компонентов. Образование растворов с положительными отклонениями от закона Рауля, как правило, сопровождается поглощением тепла и увеличением объема системы. К таким растворам относятся системы ацетон 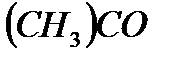 – сероуглерод
– сероуглерод 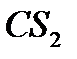 , этиловый спирт
, этиловый спирт  – этиловый эфир
– этиловый эфир 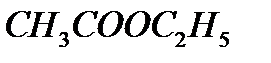 .
.
Отрицательные отклонения дают уменьшение давления насыщенного пара над раствором по сравнению с давлением насыщенного пара над идеальным раствором. Для растворов с отрицательным отклонением от закона Рауля зависимость давления насыщенного пара от состава показана на рис.3. Отрицательное отклонение обусловлено наличием больших сил притяжения между разноименными частицами (молекулами) раствора  по сравнению с взаимодействием между одноименными частицами
по сравнению с взаимодействием между одноименными частицами  и
и  . Отрицательные отклонения наблюдаются у растворов веществ, склонных к сольватации, гидратации, образованию комплексов. Системы вода
. Отрицательные отклонения наблюдаются у растворов веществ, склонных к сольватации, гидратации, образованию комплексов. Системы вода  –хлористый водород
–хлористый водород  , вода
, вода 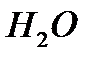 – серная кислота
– серная кислота  характеризуется отрицательными отклонениями от закона Рауля. При смещении компонентов выделяется тепло и уменьшается объем раствора.
характеризуется отрицательными отклонениями от закона Рауля. При смещении компонентов выделяется тепло и уменьшается объем раствора.
|
|
|
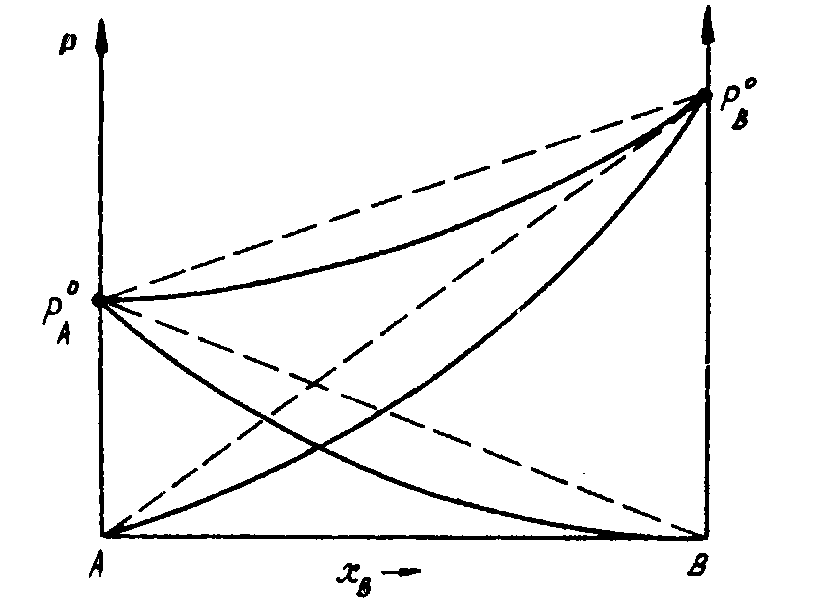
Рис. 3. Зависимость общего и парциальных давлений пара от состава
неидеального раствора А-В с отрицательным отклонением
от закона Рауля (сплошные линии) (Т = const).
В случае, когда отклонения от закона Рауля очень велики или когда давления насыщенных паров над чистыми компонентами приблизительно равны друг другу, кривая общего давления насыщенного пара может проходить через максимум или минимум, в зависимости от типа отклонения.
На одной диаграмме температура кипения жидкости – состав жидкости  можно провести линию зависимости температуры кипения жидкости от состава пара G при постоянном давлении. Связь между составами жидкости, пара и температурой кипения жидкости показана на рис.4. Точки кипения
можно провести линию зависимости температуры кипения жидкости от состава пара G при постоянном давлении. Связь между составами жидкости, пара и температурой кипения жидкости показана на рис.4. Точки кипения  и
и  отвечают температурам кипения чистых компонентов. Кривая T
отвечают температурам кипения чистых компонентов. Кривая T  - линия насыщенного пара, выше кривой находится пар, кривая T
- линия насыщенного пара, выше кривой находится пар, кривая T 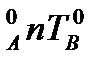 - линия жидкости. Внутри указанных кривых находится гетерогенная область, содержащая пар и жидкость. Рис.4 наглядно описывает формулировку первого закона Коновалова: пар по сравнению с жидкостью обогащен более легколетучим компонентом. В данном случае компонент
- линия жидкости. Внутри указанных кривых находится гетерогенная область, содержащая пар и жидкость. Рис.4 наглядно описывает формулировку первого закона Коновалова: пар по сравнению с жидкостью обогащен более легколетучим компонентом. В данном случае компонент  системы
системы 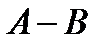 кипит при более низкой температуре, чем компонент
кипит при более низкой температуре, чем компонент 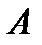 . На этом законе основана фракционная перегонка жидких смесей в ректификационных колонках, благодаря которой осуществляется их разделение.
. На этом законе основана фракционная перегонка жидких смесей в ректификационных колонках, благодаря которой осуществляется их разделение.
|
|
|
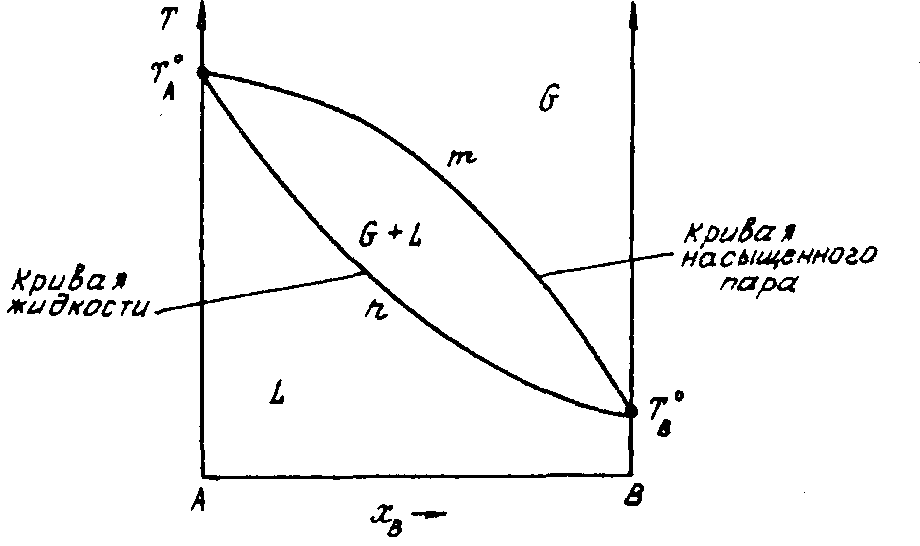
Рис.4. Диаграмма состояния двухкомпоненной системы А-В температура
кипения-состав пара и жидкости (Р = const).
В случае достаточно больших отклонений от закона Рауля на кривых температура кипения жидкости – состав пара и жидкости может появиться максимум или минимум в зависимости от типа отклонения. В экстремальных точках (азеотропная точка) кривая пара соприкасается с кривой жидкости. Азеотропная смесь кипит и дает пар, состав которого равен составу жидкости. Поэтому разделить такие смеси фракционной перегонкой нельзя.
Экспериментальная часть
Готовят четыре смеси ацетон  – изопропиловый спирт
– изопропиловый спирт  объемом 50 мл согласно объемным соотношениям 2,5:47,5; 7,5:42,5; 15:35 и 35:15 и измеряют их показатели преломления, а также показатели преломления индивидуальных веществ на рефрактометре RM50, внешний вид и основные части которого приведены на рис.5.
объемом 50 мл согласно объемным соотношениям 2,5:47,5; 7,5:42,5; 15:35 и 35:15 и измеряют их показатели преломления, а также показатели преломления индивидуальных веществ на рефрактометре RM50, внешний вид и основные части которого приведены на рис.5.

Рис.5. Рефрактометр RM50: 1 - крышка; 2 - клавиши Info, Reset, Home; 3 - кнопка включения; 4 - контрольная лампа; 5 - сенсорный экран
Измеряют показатели преломления четырех отобранных проб, а также индивидуальных веществ рефрактометрическим методом. Необходимо помнить, что показатель преломления сильно зависит от температуры, поэтому все измерения этого свойства жидкостей проводят при комнатной температуре. Для каждого раствора делают четыре замера этого свойства. Экспериментальные данные вносят в форму таблицы.
Для перегонки растворов используется стенд, представленный на рис. 6. Он состоит из колбонагревателя, круглодонной двухгорлой колбы, холодильника Димрота, через который пропускают холодную воду, и цифрового измерителя температуры с датчиком в защитном колпаке.

Рис. 6. Стенд для простой перегонки с цифровым измерителем температуры
Через холодильник Димрота пропускают холодную воду. Колбу со смесью и термометром нагревают при помощи колбонагревателя. Конденсат пара отбирают в количестве 1 мл (приблизительно 20 капель) в мелкую пробирку. Во время перегонки раствора измеряют термометром температуру кипения первой  и двадцатой
и двадцатой 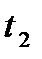 капли конденсата. В колбу с раствором помещают тонкие керамические или стеклянные капилляры, чтобы избежать перегрева и разбрызгивания жидкости. Для правильного измерения температуры кипения жидкости термометр (температурный датчик) располагается таким образом, чтобы он касался кипящей жидкости. Экспериментальные данные вносят в форму таблицы.
капли конденсата. В колбу с раствором помещают тонкие керамические или стеклянные капилляры, чтобы избежать перегрева и разбрызгивания жидкости. Для правильного измерения температуры кипения жидкости термометр (температурный датчик) располагается таким образом, чтобы он касался кипящей жидкости. Экспериментальные данные вносят в форму таблицы.
Форма таблицы
Мольная доля ацетона, температура кипения растворов
и показатель преломления исходной жидкости и конденсата
| Номер эксперимента | Мольная доля изопропилового спирта в растворе до перегонки | Показатель преломления раствора до перегонки | Температура кипения, К | Показатель преломления раствора после перегонки | Мольная доля изопропилового спирта в растворе после перегонки | ||

| 
| ||||||
| Примечание: | |||||||
Методика выполнения работы
Используя плотности ацетона и изопропилового спирта при комнатной температуре, а также объемные соотношения компонентов в растворах, вычисляют мольные доли ацетона в исходных растворах по формуле (1). Строят градуировочный график зависимости показателя преломления жидкости от мольной доли ацетона  в растворе. По значениям показателя преломления конденсата из градуировочного графика находят мольные доли ацетона
в растворе. По значениям показателя преломления конденсата из градуировочного графика находят мольные доли ацетона  соответствующие мольным долям ацетона в паре.
соответствующие мольным долям ацетона в паре.
Далее строят диаграмму состояния двухкомпонентной системы ацетон - изопропиловый спирт в координатах температура кипения – состава, на оси ординат откладывается температура кипения  . По экспериментальным точкам проводят кривую пара и кривую жидкости, на которых четыре пары точек при постоянной температуре кипения являются концами коннод.
. По экспериментальным точкам проводят кривую пара и кривую жидкости, на которых четыре пары точек при постоянной температуре кипения являются концами коннод.
Требования к отчету
Отчет должен содержать:
1) заполненную форму таблицы;
2) график зависимости показателя преломления жидкости от мольной доли компонента;
3) диаграмму состояния двухкомпонентной системы в координатах температура кипения - состав;
4) выводы по работе.
Темы собеседования при защите
Растворы. Способы выражения концентрации растворов. Закон Рауля и Генри. Положительные и отрицательные отклонения свойств растворов от закона Рауля. Правило фаз Гиббса. Диаграммы: общее и парциальные давления пара – состав раствора, температура кипения – состав раствора.
Рекомендуемая литература
1. Эткинс П. Физическая химия: Пер. с 7-го англ. изд. - Т.1-3. - М.: МГУ, 2007.
2. Стромберг А.Г., Семченко Д.П. Физическая химия. 7-е изд. – М.: Высшая школа. 2009г.
3. Практические работы по физической химии / Под ред. К.П.Мищенко, А.А.Равделя, А.М.Пономаревой – СПб: Профессия, 2003.
4. Краткий справочник физико-химических величин / Под ред. А.А.Равделя, А.М.Пономаревой – СПб: Иван Федоров, 2002.
Дополнительная литература
1. Глазов В.М. Основы физической химии. М.: Высшая школа, 1981. С.49-50.
2. Курс физической химии. Т.1 и Т.2 /Под ред. Я.И.Герасимов. М.: Химия, 1973г.
Дата добавления: 2019-09-02; просмотров: 41; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!


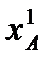
 ацетона 329 К;
ацетона 329 К;  изопропилового спирта 355 К.
изопропилового спирта 355 К.