КЛИНИЧЕСКИЕ АСПЕКТЫ НИКОТИНОВОЙ ЗАВИСИМОСТИ
Зависимость от никотина
Нил Л. Беновиц, доктор медицины
Курение сигарет остается главной причиной непредотвратимой болезни и преждевременной смерти в Соединенных Штатах и других странах. В среднем 435,000 человек в Соединенных Штатах умирают преждевременно от связанных с курением болезней каждый год; в целом, курение вызывает каждый 5-й смертельный случай. Шанс, что куривший всю жизнь умрет преждевременно от осложнения курением, составляет приблизительно 50%.
Употребление табака является основной причиной смерти от рака, сердечно-сосудистых и легочных заболеваний. Курение сигарет также является фактором риска для дыхательных путей и других инфекций, остеопороза, репродуктивных расстройств, неблагоприятных послеоперационных событий и задержки заживления ран, язвы двенадцатиперстной кишки и желудка и диабета. Кроме того, курение тесно связано с травмами, связанными с пожарами. Заболевание, вызванное курением, является следствием воздействия отравляющих веществ, находящихся в табачном дыму. Хотя никотин играет незначительную роль, если таковая имеется, в возникновении заболеваний, вызванных курением, непосредственная причина этих заболеваний – это пристрастие к никотину.
В настоящее время приблизительно 45 миллионов американцев курят табак. Семьдесят процентов курильщиков говорят, что хотели бы бросить, и каждый год, 40% действительно не курят в течение, по крайней мере, 1-го дня. Некоторые, очень зависимые курильщики предпринимают серьезные попытки отказаться, но в состоянии остановиться только на несколько часов. Кроме того, 80% из тех, кто пытается бросить курение по их собственному желанию, возвращаются к курению в течение месяца, и каждый год, только 3% курильщиков успешно оставляют курение. К сожалению, темпы, с которыми люди — в первую очередь дети и подростки — становятся ежедневными курильщиками, почти совпадают с темпами прекращения курения, поэтому распространенность отказа от курения сигарет в последние годы снижается очень медленно.
|
|
|
Эта статья сфокусирована на никотине, как определяющем факторе склонности к табаку и фармакологическое влияние никотина, которое вызывает курение сигарет. Табачная зависимость (как вся наркомания) включает взаимодействие фармакологии, изученных или обусловленных факторов, генетики, социальных факторов и факторов окружающей среды (включая дизайн табачного изделия и маркетинг) (Рис. 1). Фармакологические причины использования никотина - это улучшение настроения непосредственно или через облегчение абстиненции и увеличение умственных или физиологических функций.
|
|
|

• Рисунок 1
Зависимость от никотина с точки зрения биологии.
Никотин действует на холиномиметические холинергические рецепторы, вызывая выпуск нейромедиаторов, оказывающих психотропные влияния, которые полезны. С повторным выделением толерантность развивается ко многим эффектам никотина, таким образом уменьшая его основные эффекты укрепления и стимулирование физической зависимости (т.е.,появляется абстиненция в отсутствие никотина). Поведение курильщика под влиянием фармакологической обратной связи и факторов окружающей среды, таких как стимулы курения, друзья, которые курят, стрессы и реклама продукта. Уровни никотина в теле относительно конкретного уровня потребления никотина от курения модулируются уровнем метаболизма никотина, который происходит в печени в основном посредством фермента CYP2A6. Другие факторы, которые влияют на поведение курильщика, включают возраст, пол, генетику, психическое заболевание и токсикоманию.
МЕХАНИЗМЫ МОЗГА
НИКОТИНОВЫЕ АЦЕТИЛХОЛИНОВЫЕ РЕЦЕПТОРЫ
Вдыхание дыма от сигареты перегоняет никотин из табака в сигарету. Частицы дыма переносят никотин в легкие, где он быстро всасывается легочной венозной циркуляцией. Затем никотин поступает в артериальное кровообращение и быстро переходит из легких в мозг, где связывается с никотиновыми холинергическими рецепторами (лиганд-управляемыми ионными каналами, которые обычно связывают ацетилхолин). Связывание никотина на стыке между 2 субблоками приемного устройства раскрывает канал, таким образом, позволяя войти натрию или кальцию. Вход этих катионов в клетку добавочно активирует напряжение зависимых каналов от кальция, позволяя войти большему количеству кальция. Одним из эффектов поступления кальция в нейрон является высвобождение нейромедиаторов.
|
|
|
Холиномиметический холинергический рецептор состоит из пяти подгрупп. Мозг млекопитающего выражает девять α подгрупп (α2 через α10) и три β подгруппы (β2 через β4). Самые богатые рецепторы - α4β2, α3β4, и α7, последние из которых являются хомомерическими. Рецептор α4β2* (звездочка указывает, что другие подгруппы могут присутствовать в этом рецепторе) является основным медиатором зависимости никотина. В подгруппе у мышей разрушение гена β2 устраняет поведенческие влияния никотина; перевставляя ген в вентральную сегментальную область и восстанавливая поведенческие реакции на никотин. Подгруппа α4 - важный определяющий фактор чувствительности к никотину. Мутация, затрагивающая единственный нуклеотид в формирующей пору области рецепторного гена мыши, делает его сверхчувствительным к эффектам никотина. Другие подгруппы могут сформировать функциональные рецепторы. Наличие подгруппы α5 объединилось с проводимостью увеличений кальция α4β2 в семь раз; генные варианты α5 также изменяют реактивность никотина в культивируемых клетках человека. От подтипа α3β4, вероятно, зависит влияние никотина на сердечно-сосудистую систему. Хомомерические рецепторы вовлекаются в быструю синаптическую передачу и долгосрочное потенцирование к допаминергическим нейронам в возбуждающих исходных данных и играют роль в обучении и сенсорном восприятии.
|
|
|
ВЫСВОБОЖДЕНИЕ НИКОТИНА И НЕЙРОМЕДИАТОРА
Стимуляция никотиновых холинергических рецепторов высвобождает различные нейротрансмиттеры в головном мозге. Один из них, дофамин, сигнализирует о приятном опыте и имеет решающее значение для усиления эффектов (эффектов, способствующих самостоятельному введению) никотина и злоупотреблением другими наркотиками, а также для убедительных факторов, таких как еда. Экспериментально проведенные исследования по высвобождению дофамина в нейронах предотвращают самостоятельное употребление никотина у крыс. Никотин высвобождает дофамин в мезолимбической области, полосатом теле и лобной коре головного мозга (рис. 2). Дофаминергические нейроны в вентральной сегментальной области среднего мозга и в оболочке прилежащего ядра имеют решающее значение в лекарственном вознаграждении (оба региона играют роль в восприятии удовольствия и вознаграждения).

• Рисунок 2
Роль мезолимбической дофаминовой системы в активности никотина
Никотин активирует α4β2* рецепторы в вентральной сегментарной области, в результате чего происходит высвобождение дофамина в оболочке прилежащего ядра.
Холинергические рецепторы становятся десенсибилизированными, а некоторые - нет. В результате GABA-опосредованный никотин также увеличивает и выпуск глутамата, что облегчает выпуск дофамина и выпуск γ-аминомасляной кислоты (GABA) , которая ингибирует выпуск дофамина. При длительном воздействии на никотин, некоторые холиномиметические подавляющие тоны уменьшаются, в то время, как установленное глутаматом возбуждение сохраняется, таким образом увеличивая возбуждение дофаминергических нейронов и увеличивая реактивность к никотину.
Мера функции наградной системы у крыс - это порог для электрической самостимуляции в среднем переднем мозге: более низкий порог указывает на увеличенную реактивность к полезным стимулам. Никотин понижает порог для вознаграждения, эффект, который может продлиться больше 30 дней. Он также увеличивает активность в префронтальной коре, таламусе и визуальной системе, отражая активацию кортикобазальных таламических ганглиями мозговых схем (часть наградной сети), и выпускает дофамин в стриатуме. 20 других нейромедиаторов, которые могут быть вовлечены в зависимость от никотина, гипокретины, нейропептиды, производятся в боковом гипоталамусе, который регулирует стимулирующие эффекты никотина на центры вознаграждения в головном мозге и модулирует самостоятельное введение никотина у грызунов.
МОНОАМИНОКСИДАЗА
Компоненты сигаретного дыма, которые отличаются от никотина, способствуют никотиновой зависимости. Моноаминоксидаза- ферменты, расположенные в катехоламинергических и других нейронах, катализируют метаболизм дофамина, норадреналина и серотонина. Продукты конденсации ацетальдегида в сигаретном дыме с биогенными аминами ингибируют активность моноаминоксидазы типа А и моноаминоксидазы типа В, и имеются данные о том, что ингибирование моноаминоксидазы способствует зависимости курения за счет снижения метаболизма дофамина.
НЕЙРОАДАПТАЦИЯ
С повторным воздействием никотина развивается нейроадаптация (терпимость) к некоторым эффектам никотина. Так как нейроадаптация развивается, количество связывающих участков на холиномиметических холинергических рецепторах в мозгу увеличивается, вероятно, в ответ на установленную никотином десенсибилизацию рецепторов. Десенсибилизация — это вызванное лигандом закрытие и устойчивость рецептора — как полагают, играют роль в терпимости и зависимости: симптомы тяги и отказа, которые возникают у курильщиков, когда десенсибилизировано α4 β2*, холиномиметические холинергические рецепторы становятся чувствительными в периодах воздержания, таких, как ночное связывание во время сна 2Никотин - эти рецепторы в период курения облегчают тягу и отказ.
Курение сигарет в количествах, которые характерны для ежедневных курильщиков, поддерживает почти полную насыщенность — и, таким образом, десенсибилизацию — α4 β2* холиномиметических холинергических рецепторов. Поэтому, курильщики, вероятно, пытаются избежать абстиненции, поддерживая десенсибилизированное состояние. Выдерживая достаточные уровни горящего никотина, чтобы предотвратить абстиненцию, они также получают полезные эффекты из обусловленного подкрепления, связанного с курением, такого, как вкус и запах дыма.
Отказ от никотина вызывает беспокойство и стресс, оба из которых являются сильными стимулами для того, чтобы заняться курением снова. Отрицательный эффект, который символизирует реакцию на отказ от никотина, вероятно, происходит частично из-за каскада событий, включающих увеличенные уровни экстрагипоталамического рилизинг - фактора адренокортикотропного гормона (CRF), и увеличивает связывание CRF с фактором высвобождения адренокортикотропного гормона рецепторов (CRF1) в мозгу, таким образом активируя систему рецепторов CRF–CRF1, которая добивается ответов на стресс. У крыс поведение, подобное беспокойству, и высвобождение CRF в центральном ядре миндалины, происходят во время отказа от никотина. CRF вызывает беспокойство, тогда как фармакологическая блокада рецепторов CRF1 ингибирует возбуждающие эффекты при отказе от никотина. Блокада рецепторов CRF1 также предотвращает увеличение самоназначения никотина, которое происходит во время воздержания от принудительного назначения никотина у крыс. Таким образом, и недостаточная активность допаминергической системы, и активация системы рецептора CRF–CRF1 способствуют симптомам отмены никотина, что часто ускоряет рецидив.
КЛИНИЧЕСКИЕ АСПЕКТЫ НИКОТИНОВОЙ ЗАВИСИМОСТИ
НИКОТИНОВЫЕ АЦЕТИЛХОЛИНОВЫЕ РЕЦЕПТОРЫ
Никотин вызывает удовольствие и уменьшает стресс и тревожность. Курильщики используют его для модуляции уровня возбуждения и контроля настроения. Курение улучшает концентрацию внимания, время реакции и выполнение определенных задач. Облегчение симптомов при отмене никотина, вероятно, является основной причиной этого повышенного проявления и приподнятого настроения. Прекращение курения вызывает появление симптомов отмены: раздражительность, подавленное настроение, беспокойство и тревогу. Интенсивность этих расстройств в настроении аналогична той, которая наблюдается у психиатрических амбулаторных больных. Ангедония – это чувство, что человек получает меньшее удовольствие в жизни - может также произойти с отказом от никотина, и от употребления других лекарств.
Основу никотиновой зависимости, представляет собой сочетание положительного подкрепления, в том числе повышение настроения и избегания симптомов отмены (рис. 3). Кроме того, кондиционирование играет важную роль в развитии табачной зависимости.
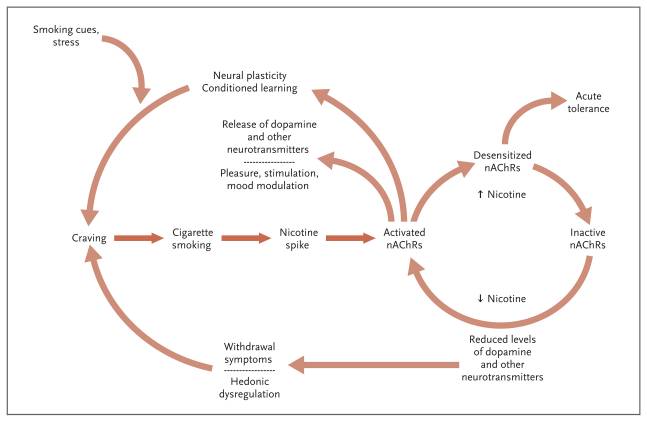
• Рисунок 3
Молекулярные и поведенческие аспекты никотиновой зависимости
Тяга, вызванная курением, стрессорами или желанием облегчить симптомы отмены, приводит к акту курения сигареты, которая доставляет всплеск никотина в мозг. Никотиновые холинергические рецепторы (nAChR) активируются, в результате чего высвобождается дофамин и другие нейротрансмиттеры, которые, в свою очередь, вызывают удовольствие, стимуляцию и поднятие настроения. Активация рецепторов также приводит к развитию новых нейронных цепей (нейропластичности) и сочетается с сигналами окружающей среды, поведенческой обусловленностью. После активации никотином, nAChRs в конечном счете становятся нечувствительными к нему, что приводит к кратковременной толерантности к никотину и снижению удовлетворенности от курения. В период между курением сигарет или после прекращения употребления табака уровень никотина в мозгу снижается, что приводит к снижению уровня дофамина и других нейротрансмиттеров и к абстинентным симптомам, включая тягу. При отсутствии никотина nAChR восстанавливают чувствительность к никотину и реактивируются в ответ на новую дозу. Адаптировано от Дани и Хайнемана.
УСЛОВНОЕ ПОВЕДЕНИЕ
Когда человек, который подвержен никотиновой зависимости, прекращает курить, желание возобновить - рецидивное и сохраняется после абстиненции, симптомы рассеиваются. При регулярном курении курильщик приходит к тому, чтобы соотнести определенные настроения, ситуации, или факторы окружающей среды — связанные с курением стимулы — с полезными эффектами никотина. Как правило, эти стимулы вызывают рецидив.
Ассоциация между такими стимулами и ожидаемыми эффектами от никотина и заканчивающимся желанием употребить никотин, составляет форму создания условий. Исследования на животных показывают, что изменения причин выделения никотина в белковом выражении клеток головного мозга и в их синаптических связях — процесс назван невральной пластичностью — которые лежат в основе создания условий. Никотин также увеличивает поведенческие реакции на условные раздражители, которые могут способствовать компульсивному курению. Кроме того, исследования у зависимых от никотина крыс, показывают, что условные раздражители, связанные с отказом от никотина, увеличивают величину отказа посредством возвышения наградного порога мозга. Таким образом, стимулы, связанные с отказом от никотина, могут уменьшать функцию наградных систем мозга.
Желание курить сохраняется, частично, созданием таких условий. Курильщики обычно берут сигарету после еды с чашкой кофе или алкогольным напитком, или с друзьями, которые курят. Когда это повторяется много раз, такие ситуации становятся сильным стимулом для желания курить. Сами по себе аспекты курения — это манипуляция курения материалов, или вкуса, запаха или чувства дыма в горле — также становятся связанными с радостными эффектами от курения. Даже неприятные капризы могут стать обусловленными стимулами для курения: курильщик может узнать, что не наличие сигареты вызывает раздражительность, а что курение - это то, что обеспечивает облегчение. После таких повторенных случаев, курильщик может ощутить раздражительность от любого источника как стимул для курения. Функциональные образцы исследования показали, что выделение к связанным с лекарственным средством стимулам активирует корковые области мозга, включая островок Рейля (структура в коре, связанная с определенными основными эмоциями). Курильщики, которые несут вред островку Рейля (например, мозговая травма), более вероятно, бросят курить вскоре после травмы, и оставаться абстинентными, и, менее вероятно, будут иметь сознательные желания курить, чем курильщики с травмой головного мозга, которая не поражает островок Рейля.
ЦИКЛ ТАБАЧНОЙ ЗАВИСИМОСТИ
Курение является высокоэффективной формой введения лекарственных средств. Никотин, который вдохнули, входит в циркуляцию быстро через легкие и продвигается в мозг за секунды. Быстрые темпы всасывания и попадания в мозг вызывают сильный “порыв” и усиливают действие препарата. У животных быстрое введение никотина потенцирует двигательную сенсибилизацию, которая связана с наградой, и нейропластические изменения в головном мозге. Процесс курения также обеспечивает быстрое подкрепление и учитывает точную дозировку, делая возможным для курильщика получить желательные результаты без токсичности. В отличие от сигарет, никотиновые препараты, продаваемые для содействия прекращению курения, поставляют никотин медленно, и риск злоупотребления низок. В дополнение к доставке никотина в мозг быстро, сигареты были разработаны с добавками и инженерными функциями для повышения его аддиктивности.
Существует значительное колебание уровня никотина в крови от сигареты к сигарете. Тем не менее, он накапливается в организме в течение 6-9 часов регулярного курения и воздействует на организм 24 часа. Артериовенозные различия в концентрации никотина при курении сигарет значительны, при этом артериальный уровень в 10 раз превышает венозный. Сохранение никотина в головном мозге в течение дня и ночи изменяет структуру и функцию никотиновых рецепторов, стимулируя внутриклеточные процессы нейроадаптации.
Фармакологическое умственное или физическое функционирование и предотвращение абстиненции имеет место, когда никотин не доступен. Рисунок 4 показывает, что типичное ежедневное основание зависимости от никотина - это комбинация положительного подкрепления, такого как улучшение настроения и цикла курения.

• Рисунок 4
Цикл табачной зависимости
Первая терпимость к никотину начинает развиваться. Вторая сигарета выкуренная позже, в то время, когда курильщик узнал, что есть некоторый регресс терпимости. С последующим курением есть накопление никотина в организме, приводящее к большему уровню терпимости, и абстиненция становится более явной между последующими сигаретами. Заштрихованная область графика представляет аффективную нейтральную зону, которая существует между пороговым значением никотина, должен был произвести удовольствие сигареты в день, имеет существенный фармакологический эффект, прежде всего активация, но в то же время, и активация и пороговое значение, ниже которого появится абстиненция. Скоротечно высокий уровень никотина в мозгу после индивидуально выкуренных сигарет, может быть частично преодолена терпимость, но основные (эйфорические) эффекты никотина имеют тенденцию уменьшаться в течение дня. Воздержание в течение ночи позволяет значительную десенсибилизацию действиям никотина. Адаптировано от Беновиц.
Курильщики, как правило, выкуривают одинаковое количество никотина изо дня в день для достижения желаемого эффекта. Они корректируют свое поведение при курении, чтобы компенсировать изменения в доступности никотина (например, при переходе с обычных сигарет на сигареты с низким выходом) для регулирования уровня никотина в организме. Легкие курильщики (те, кто курит ≤5 сигарет в день) и случайные курильщики курят в основном для положительного подкрепляющего эффекта никотина и имеют минимальные (или не имеют) симптомы отмены. Они курят в основном в связи с определенными видами деятельности (после еды или во время употребления алкоголя), и с меньшей вероятностью курят в ответ на негативное воздействие. Хотя симптомы отмены могут быть незаметны, многим легким и случайным курильщикам трудно бросить курить. Некоторые из них имеют высокий уровень зависимости, но с фармакодинамикой, которая отличаются от таковых у более тяжелых курильщиков.
ГЕНЕТИКА НИКОТИНОВОЙ ЗАВИСИМОСТИ
Исследования у близнецов показали высокую степень наследуемости курения сигарет (≥50%), включая уровень зависимости и количество ежедневно выкуриваемых сигарет. 50 этих исследований также выявили наследуемость определенных симптомов, которые возникают, когда курильщик прекращает курить.
Предпринимались многочисленные попытки выявить гены, лежащие в основе никотиновой зависимости. Такие исследования проблематичны, потому что множество генов и факторов окружающей среды определяют сложное поведение, и многие различные фенотипы зависимости могут иметь различную генетическую основу. Гены-кандидаты, кодирующие подтипы никотин-рецепторов, дофаминовые рецепторы и транспортеры дофамина, ГАМК-рецепторы, опиатные и каннабиноидные рецепторы и другие типы рецепторов, были связаны с различными аспектами поведения при курении. Однако последующие исследования не повторили многие из первоначальных выводов.
Недавние широкие геномные исследования ассоциации указывают на несколько многообещающих генетических определяющих факторов зависимости никотина. Bierut и др. сравнил геномы курильщиков, которые стали зависящими от никотина с геномами курильщиков, которые не зависели. . Сигналы от широких геномных исследований ассоциации вели исследованию второй фазы ассоциации гена-кандидата Saccone и др., в котором их нескольких сильных генетических ассоциаций были раскрыты 54, как самые известные, были гены в α5/α3/β4 холиномиметическом холинергическом комплексе рецепторного гена на хромосоме 15. Это и другие широкие геномные исследования ассоциации табачной зависимости также определили гены, затрагивающие клеточную адгезию и внеклеточные матричные молекулы, которые распространены среди различных склонностей. Эти результаты исследования согласовываются с идеей, что невральная пластичность и изучение - ключевые определяющие факторы индивидуальных различий в уязвимости для зависимости от никотина и других наркотиков.
У вариантов, связанных с зависимостью никотина в α5/α3/β4 генной области (хромосома 15, 15q25) также, есть отчетливая связь с количеством сигарет, выкуренных за день, плазменные уровни котинина (биомаркер потребления никотина), уровни в моче канцерогенных веществ табачного дыма и риски связанных с болезнями, вызванными курением. Механизмы ассоциаций между этими вариантами и болезнью, вероятно, связаны с уровнем зависимости и, таким образом, уровнем потребления токсинов табачного дыма; однако, холиномиметические холинергические рецепторы также модулируют воспалительные реакции, ангиогенез и апоптоз, и таким образом, составляют дополнительные механизмы, через которые никотин мог влиять на риск болезни.
УЯЗВИМОСТЬ ПЕРЕД ЗАВИСИМОСТЬЮ
Употребление табака обычно начинается в детстве или в подростковом возрасте — 80% курильщиков начинают курить до 18 лет. Хотя две трети молодых людей курят сигареты, лишь 20-25% из них становятся зависимыми от ежедневного курения, как правило, в зрелом возрасте. Факторы риска курения в детском или подростковом возрасте включают влияние сверстников и родителей, поведенческие проблемы (например, плохая успеваемость в школе), личностные характеристики (бунтарство, риск, депрессия и тревога) и генетические влияния.
Риск зависимости возрастает, когда курение начинается рано. Исследования развивающегося мозга у животных показывают, что никотин может вызывать постоянные изменения, которые приводят к зависимости. Изменения мозга у крыс-подростков, подвергшихся воздействию никотина, выше, чем у взрослых крыс. Подростки-крысы, которые подвергались воздействию никотина, имеют более высокие показатели самостоятельного введения никотина взрослыми, что согласуется с идеей о том, что раннее воздействие никотина увеличивает тяжесть зависимости.
Табачная зависимость широко распространена среди лиц с психическими заболеваниями или токсикоманией расстройств. Механизмы этой ассоциации, вероятно, включают общую генетическую предрасположенность, способность никотина облегчать некоторые психиатрические симптомы и ингибирующее воздействие табачного дыма на моноаминоксидазу.
Поведение курильщика у женщин проявляется более сильно под влиянием обусловленных стимулов и отрицательного аффекта; мужчины, более вероятно, будут курить в ответ на фармакологические стимулы, регулируя свое потребление никотина более точно, чем женщины. В среднем, женщины усваивают никотин намного быстрее, чем мужчины, которые могут способствовать их увеличенной восприимчивостью к зависимости от никотина и могут помочь объяснить, почему среди курильщиков - женщин труднее найти тех, кто бросает.
Поскольку курильщики регулируют потребление никотина для поддержки определенного уровня в течение дня, те, кто усваивает никотин быстро, принимают больше сигаретного дыма в день, чем те, кто медленно метаболизирует никотин. Никотин преобразуется в котинин, главным образом, ферментом печени CYP2A6. 76 человек с генетической основой медленного метаболизма (те, у кого гены варианта CYP2A6 связаны со сниженной активностью ферментов) ежедневно курят меньше сигарет, чем люди с более быстрым метаболизмом. У 77 наблюдаемых выявилось, что доля курильщиков с генетически медленным метаболизмом в популяции курильщиков уменьшается с увеличением возраста когорты курильщиков, и это свидетельствует о том, что те, у кого медленный метаболизм, с большей вероятностью бросают курить, чем те, у кого метаболизм быстрее. Быстрый метаболизм никотина связан с более тяжелыми симптомами абстиненции и снижением вероятности успеха при применении никотинового пластыря.
ЗАКЛЮЧЕНИЕ
Никотин выдерживает табачную зависимость, которая является основной причиной инвалидности и преждевременной смерти, действуя на холиномиметические холинергические рецепторы в мозгу, чтобы вызвать высвобождение дофамина и других нейромедиаторов. Высвобождение дофамина, глутамата и GABA особенно важны в развитии зависимости никотина, и CRF может играть ключевую роль в отказе. Нейроадаптация и терпимость включают изменения в холиномиметических рецепторах и невральной пластичности. Зависимость от никотина происходит, когда у курильщика возникает необходимость полагаться на курение, чтобы смодулировать настроение и активацию, облегчить абстиненцию или и то, и другое. Легкие или случайные курильщики курят, главным образом, для положительного укрепления в определенных ситуациях. Генетические исследования указывают, что холиномиметические подтипы рецептора и гены, вовлеченные в нейропластичность и исследование, играют роль в развитии зависимости. У людей с психиатрическими нарушениями или токсикоманией, когда объясняется значительная доля нынешних курильщиков, есть увеличенная восприимчивость к табачной зависимости. Никотин усваивается, прежде всего, ферментным CYP2A6, и изменение в уровне метаболизма никотина способствует различиям в уязвимости перед табачной зависимостью и реакцией на лечение для отказа от курения. Увеличенное понимание механизмов зависимости от никотина привело к разработке новых лекарств (например, варениклин), который действует на определенный холиномиметический рецептор, выделяя подтипы. Разработка других препаратов, которые действуют на холиномиметические рецепторы и другие медиаторы зависимости от никотина, вероятно, далее увеличит эффективность медикаментозного лечения для отказа от курения.
Дата добавления: 2019-07-17; просмотров: 310; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
