Характеристика основных потребностей микроорганизмов в макро- и микроэлементах. Ауксотрофы и прототрофы.
Для роста и размножения бактерий, а, следовательно, и для их питания, необходимы различные химические соединения, растворенные в воде. По количественному вкладу в построение клетки различают макро- и микроэлементы. К макроэлементам относят 10 элементов таблицы Менделеева: углерод, водород, кислород, азот, серу, калий, кальций, фосфор, магний, железо. Микроэлементы нужны бактериям в очень малых, следовых, количествах, они представлены марганцем, молибденом, цинком, медью, кобальтом, никелем, хлором, бромом и некоторыми другими металлами и неметаллами. Большинство из них содержится в виде примесей в макроэлементах или может попадать в питательные среды из стеклянной посуды, воды или воздуха. Некоторые бактерии могут обходится и без микроэлементов.
Для роста микроорганизмов так же необходим азот, который входит в состав органических соединений или солей в разной степени восстановления. Это могут быть соли аммония, нитраты или отдельные аминокислоты. Для удовлетворения потребности бактерий в азоте используют также продукты неполного расщепления белков животного происхождения - гидролизаты , пептоны и сложные белковые смеси - нативную сыворотку животных, асцитическую жидкость и др.
Кроме углерода, азота и других химических элементов, многие бактерии нуждаются в факторах роста, к которым относятся витамины, основания нуклеиновых кислот и другие биологически активные вещества. По этому признаку микроорганизмы можно разделить на две группы: ауксотрофы , для которых в среде необходимо наличие одного или нескольких факторов роста и прототрофы , они в факторах роста не нуждаются.
|
|
|
Механизм регуляции активности ферментов в микроорганизмах.
Поскольку практически все реакции в клетке катализируются ферментами, регуляция метаболизма сводится к регуляции интенсивности ферментативных реакций. Скорость последних может регулироваться двумя основными способами: путем изменения количества ферментов и/или изменения их активности, т. с. степени испольвания их каталитического потенциала.
Регуляция активности ферментов
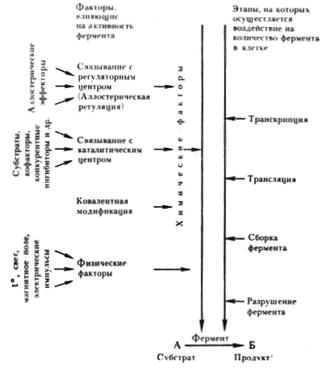
Рис. 28. Регуляторные воздействия на уровень клеточных метаболитов (продуктов)
Факторы, регулирующие активность ферментов, разнообразны по своей природе (рис. 28). Физические факторы (температура, давление, свет, магнитное поле, электрические импульсы оказывают менее специфическое действие, чем химические. В свою очередь действие последних также может быть разделено на несколько типов. Одни химические вещества связываются с активным центром фермента, например субстраты, кофакторы, конкурентные ингибиторы, что приводит к изменению ферментативной активности. Другие вещества взаимодействуют со специальными участками на поверхности молекулы определенного типа фермента, не имеющими непосредственного отношения к центрам каталитической активности, но тем не менее приводящими к ее изменению.
|
|
|
Наконец, активность некоторых ферментов регулируется путем химической модификации их молекулы, в основе которой лежит ковалентное обратимое связывание с ферментом определенной группировки, что приводит к изменению его активности. У прокариот известны две ферментные системы, активность которых регулируется таким путем. Глутаминсинтетаза E. coli, катализирующая синтез глутамина, существует в двух формах, различающихся присутствием в одной из них остатка адениловой кислоты. Присоединение его с помощью ковалентной связи, катализируемое соответствующим модифицирующим ферментом, приводит к образованию менее активной аденилированной глутаминсинтетазы:

Удаление адениловой группы, ведущее к возникновению деаденилированной формы фермента, резко повышает его каталитическую активность. Аналогичный механизм регулирования активности фермента путем присоединения и удаления остатка уксусной кислоты (ацетилирование — деацетилирование) обнаружен для цитратлиазы у фотосинтезирующей бактерии Rhodopseudomonas gelatinosa. В этом случае активна ацетилированная форма фермента.
|
|
|
Наиболее быстрым, точным и тонким механизмом регуляции активности ферментов является регуляция, которой подвергается определенный тип ферментов, получивших название аллостерических21. Эти ферменты, как правило, занимают ключевые позиции в обмене веществ, располагаясь в "стратегических" пунктах клеточного метаболизма — начале метаболических путей или местах разветвлений, где расходятся или сходятся несколько путей.
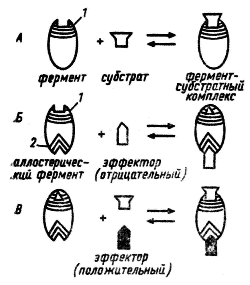
Рис. 29. Связывание субстрата с ферментом (А) и действие отрицательного (Б) и положительного (И) эффектора на каталитическую активность аллостерического фермента: 1 — каталитический центр; 2 — регуляторный центр (no Schlegel, 1972)
Аллостерические ферменты имеют каталитический и регуляторный (аллостерический) центры, пространственно разобщенные, но функционально тесно взаимосвязанные. Каталитическая активность фермента меняется в результате связывания с его регуляторным центром определенных метаболитов, называемых эффекторами. Кроме конечных продуктов данного пути, эффекторами могут быть субстраты ферментов, а также некоторые конечные продукты родственных метаболических путей. Если действие эффектора приводит к понижению каталитической активности фермента, такой эффектор называется отрицательным, или ингибитором. Положительным называют эффектор, действие которого повышает каталитическую активность фермента. Положительным эффектором, или активатором, чаще всего бывает субстрат данного фермента.
|
|
|
Связывание эффектора с регуляторным центром приводит к изменению сродства фермента к субстрату в результате какого-то конформационного изменения фермента (рис. 29).
Наиболее простой случай аллостерической регуляции — регуляция первого фермента неразветвленного биосинтетического пути его конечным продуктом. Если конечный продукт накапливается в избытке, он подавляет активность первого фермента в процессе, называемом ингибированием по принципу обратной связи Примером такого типа регулирования является ингибирование биосинтеза L-изолейцина (рис. 30) Первый фермент на пути синтеза L-изолейцина L-треониндезаминаза является аллостерическим и ингибируется только L-изолейцином.

Рис. 30. Регуляция биосинтеза L-изолейцина по механизму отрицательной обратной связи; ф, — треониндезаминаза; ф — фз — ферменты, катализирующие промежуточные стадии биосинтеза L-изолейцина. Стрелкой показано ингибирование треониндезамнназы L-изолейцином
Дата добавления: 2019-07-15; просмотров: 306; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
