Краткие теоретические сведения
Федеральное государственное бюджетное образовательное учреждение
высшего образования
«Саратовский государственный технический университет имени
Гагарина Ю.А.»
Кафедра «Электроснабжение и электротехнология»
Методические указания к практическим занятиям
По дисциплине
Общая энергетика »
направления подготовки
«13.03.02 Электроэнергетика электротехника »
Профиль: «Электроснабжение»;
«Электротехнологические установки и системы»
Саратов 2017
1. Введение.
Дисциплина «Общая энергетика» занимает основное место среди дисциплин базовой части программы подготовки бакалавров направления 13.03.02 «Электроэнергетика и электротехника» по профилю «Электроснабжение», определяющих теоретический уровень профессиональной подготовки бакалавров.
Методические указания составлены для семи тем практических занятий
1. Основные определения термодинамики.
2. Термодинамические процессы.
3. Тепловые электрические станции.
4. Атомные электрические станции.
5. Анализ паросилового цикла Ренкина.
6. Термодинамические процессы в двигателях внутреннего сгорания.
7. Поршневые газовые машины. Двигатель Стирлинга.
и охватывают применение расчетных термодинамических методик применительно к энергетическим процессам. Трудоемкость практических занятий определяется требуемой степенью углубленности изучения тем и может составлять от 2 до 6 академических часов. Применение математических пакетов (Mathcad, MATLAB) к расчету термодинамических циклов и параметров процессов требует самостоятельного изучения со стороны студентов.
|
|
|
Практическое занятие № 1
1. Основные определения термодинамики.
Цель работы: Изучение основных параметров и состояний пара.
План проведения занятия:
1. Рассмотрение теоретических сведений.
2. Решение примеров.
3. Ответы на контрольные вопросы.
Краткие теоретические сведения
В тепловых машинах процессы перехода теплоты в работу и работы в теплоту осуществляются посредством рабочего тела (обычно газ или водяной пар), изменяющего свое физическое состояние при сообщении теплоты или при силовом на него воздействии.
Величины, характеризующие физическое состояние тела, называются
термодинамическими параметрами состояния тела, они определяются основными параметрами: удельным объемом, давлением и температурой.
Для каждого состояния тела параметры принимают вполне определенные значения, не зависящие от массы тела и обусловливаемые лишь его внутренними молекулярными особенностями — скоростью молекул и их взаимным расположением. Удельный объем -объем единицы веса,обычно1кг вещества:
|
|
|
v = V м3/ кг,
G

где V - полный объем тела;
G - вес.
Удельный вес -величина,обратная удельному объему, (вес единицы объема(1м3):
g =1= G кг / м3 u V


Плотность -масса[единицы объема:
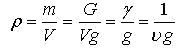
Удельный объем, удельный вес и плотность взаимно определяют друг друга и каждый из них может служить одним из параметров тела.
Давление газа -результат воздействия(ударов)на окружающую оболочкумолекул газа, находящихся в хаотическом непрерывном движении.
Давление газа (при его равновесном состоянии), действующее по нормали к стенкам оболочки, равно и противоположно по направлению внешнему давлению.
Термодинамическим параметром, определяющим состояние газа, является не полное давление газа на оболочку, а удельное, т. е. его давление в килограммах, приходящееся на единицу поверхности: 1 м2 или 1 см2.
Техническая атмосфера (ат) -давление газа,равное1кг/см2.
1 ат = 1 кг/см2 = 10 000 кг/м2.
Физическая атмосфера -давление воздуха на уровне моря на45°географическойшироты, соответствующее давлению, производимому ртутным столбом высотой 760 мм при температуре, равной 0° С.
|
|
|
1 физ. ат = 1,0333 техн. ат = 10333 кг/м2.
Сравнительно небольшие давления могут измеряться высотой столба жидкости. 1 физ. ат = 760 мм рт. ст. при 0° С.
| 1 техн. ат = | 760 | |
| = 735,6 мм pт. cт. при 0° С. |

1,0333
Высота водяного столба при этих же условиях будет в 13,595 раза больше высоты
ртутного столба (ртуть в 13,595 раза тяжелее воды).
1 ат = 1 кг/см2 = 736 мм. рт. ст. = 10 м вод. ст.
В абсолютной системе CGS (сантиметр, грамм-масса, секунда) за единицу силы принята длина, площади - квадратный сантиметр и давления - 1 дин/см2.
Давление, равное 106 дин/см2, называется «бар».
1 ат = 1 кг/см2 = 0,981 бар.
Приборы для измерения давления — манометры (измерение давления больше атмосферного), вакуумметры (измерение давления меньше атмосферного) и барометры (измерение атмосферного давления). Манометры показывают избыток измеряемого давления (абсолютного ра) над атмосферным (барометрическим рб).
pа = pб + pм
Абсолютное давление газа равно избыточному давлению (манометрическому), сложенному с барометрическим давлением.
Вакуумметры показывают избыток атмосферного (барометрического) давления над измеряемым абсолютным давлением.
pа = pб - pв
т. е. в случае разрежения давление газа равно барометрическому давлению без вакуумметрического (pв)
|
|
|
Во все термодинамические формулы вводится абсолютное давление газа.
При измерении давления в атмосферах применяются условные обозначения: ата
— для абсолютного давления и ати — для избыточного. Например, манометр показывает 5 ати, полное давление газа будет 6 ата.
Влияние на высоту столба ртути температуры . При возрастании температурыувеличиваются объем, а следовательно, и высота столба ртути, соответствующая данному давлению. При вычислении по показанию барометра атмосферного давления высоту столба ртути барометра h приводят к высоте h0 при 0° С:
h0= h (1 — 0,000172 t).
Тогда атмосферное давление (ат) при t°C будет равно:
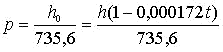
Приведение высоты столба ртути барометра к 0° С можно проводить графическим методом по диаграммам.
Температура является мерой нагретости тел.Тела имеют одинаковуютемпературу, если между ними не существует теплообмена, т. е. если они находятся между собой в тепловом равновесии, при котором будут равны средние значения кинетической энергии поступательного движения их молекул. Если же тела не находятся
в тепловом равновесии и между ними имеется теплообмен, то тело, отдающее теплоту другому телу, обладает большей температурой, большей кинетической энергией молекул. Таким образом, температура определяет направление теплового потока. Разность температур тел определяет меру их отклонения от теплового равновесия.
Эмпирическая температура -мера отклонения тела от состояния тепловогоравновесия с тающим льдом, находящимся под давлением в одну физическую атмосферу. За единицу температуры принят один градус, из условия, что температуре тающего под атмосферным давлением льда приписывается 0°, а температуре кипящей под атмосферным давлением воды — 100°.
Числовая величина температуры тела измеряется посредством термометров: ртутных, спиртовых и др. Для точных измерений температуры применяют газовые термометры. В технике пользуются также термометрами, действие которых основано не на свойстве расширения тел при нагревании (термоэлементы, термометры сопротивления и пр.).
Абсолютная температура -температура,пропорциональная среднейкинетической энергии поступательного движения молекул тела. Абсолютная температура должна принимать значение, равное нулю при состоянии тела, при котором прекратилось бы тепловое движение его молекул. Эта предельная минимальная температура называется абсолютным нулем и является началом для отсчета температур.
Абсолютная температура отсчитывается от предельно низкой температуры — от абсолютного нуля и является всегда положительной величиной. Эмпирическая температура отсчитывается от некоторой произвольно выбранной начальной температуры
— температуры таяния льда под атмосферным давлением — и поэтому может быть как положительной, так и отрицательной величиной. Введение абсолютной шкалы устраняет условность при оценке значения температуры и начала ее отсчета, неизбежные при измерении температуры по шкалам, построенным с использованием физических свойств тех или иных веществ.
Абсолютная температура тела может быть измерена посредством газового термометра. На основании закона Гей-Люссака можно показать, что постоянная точка идеального газового термометра, являющаяся началом отсчета температур, лежит на 273,16 ° С ниже нуля стоградусной шкалы. Шкала водородного термометра дает незначительное отклонение от шкалы идеального газа. Между абсолютной температурой тела (Т° К или Т° абс) и температурой эмпирической (t° С) имеется зависимость:
Т = t + 273,16.
На основании второго закона термодинамики вводится так называемая термодинамическая температура,тождественная с абсолютной температурой
Пар -реальный газ со сравнительно высокой критической температурой,а такжеблизкий к состоянию насыщения. За реальными газами с низкими критическими температурами сохраняется название газов вплоть до состояния насыщения.
Парообразование -процесс перехода жидкости в пар.
Испарение -парообразование,происходящее только с поверхности жидкости ипри любой температуре. Интенсивность испарения зависит от природы жидкости и температуры. При испарении понижается температура жидкости, из нее вылетают молекулы, обладающие сравнительно большими скоростями, вследствие чего и уменьшается средняя скорость движения оставшихся в ней молекул. Испарение жидкости может быть полным, если над жидкостью находится неограниченное пространство.
Кипение –образование пузырьков пара у стенок сосуда и внутри жидкости.Присообщении жидкости теплоты увеличиваются ее температура и интенсивность испарения. При некоторой вполне определенной температуре, зависящей от природы жидкости и давления, под которым она находится, наступает парообразование во всей ее массе.
Конденсация -процесс превращения пара в жидкость,осуществляющийся приотнятии от него тепла и являющийся процессом, обратным парообразованию. Конденсат - жидкость, образующаяся при конденсации пара в паросиловых установках.
Возгонка , или сублимация -процесс перехода вещества из твердого состояниянепосредственно в пар. Десублимация - процесс, обратный процессу сублимации, т. е. процесс перехода пара непосредственно в твердое состояние.
Насыщенный пар - пар,находящийся в равновесном состоянии с жидкостью,изкоторой он образуется. Насыщенный пар имеет температуру, являющуюся функцией его давления, равного давлению среды, в которой происходит процесс кипения. При увеличении объема насыщенного пара при постоянной температуре происходит переход некоторого количества жидкости в пар, при уменьшении же объема при постоянной температуре — переход пара в жидкость, но как в первом, так и во втором случаях давление пара остается постоянным.
Сухой насыщенный пар получается при испарении всей жидкости. Объем и температурасухого пара являются функциями давления. Состояние сухого пара определяется одним параметром (давлением или температурой).
Влажный насыщенный пар получается при неполном испарении жидкости, являетсясмесью пара с мельчайшими капельками жидкости, распространенными равномерно во всей его массе и находящимися в нем во взвешенном состоянии. Степень сухости -весовая доля пара во влажном паре(обозначается х).
Степень влажности -весовая доля жидкости(обозначается y). у =1-х
Для сухого пара х=1, а для воды х=0. В процессе парообразования степень сухости пара постепенно увеличивается от нуля до единицы. Состояние влажного пара определяется двумя параметрами, (давлением или температурой и степенью сухости).
Перегретый пар -пар,температура которого выше температуры насыщенногопара того же давления. Температура перегретого пара зависит от давления и объема. Степень перегрева -разность между температурой перегретого пара и температуройнасыщенного пара того же давления.
Так как удельный объем перегретого пара больше удельного объема насыщенного пара того же давления, то в единице объема перегретого пара содержится меньшее число молекул, чем в единице объема насыщенного пара. Вследствие этого перегретый пар является не насыщенным и обладает меньшей плотностью, чем соответствующий насыщенный пар.
Перегретые пары по своим физическим свойствам близки к газам и тем в большей мере, чем выше степень их перегрева. Состояние перегретого пара, так же как и газа, определяется двумя любыми независимыми параметрами (давлением и температурой).
На рис. 1.1 представлены кривые, которые устанавливают для некоторых веществ зависимость между давлением и температурой кипения. Приведенная диаграмма, построенная по экспериментальным данным, показывает, что температуры кипения различных веществ при одном и том же давлении значительно отличаются друг от друга.

Рис. 1.1 Кривые зависимости между давлением и температурой кипения
Энтальпия (теплосодержание) - функция состояния тела,определяемогонезависимыми параметрами р и Т - равна внутренней энергии тела, сложенной с работой, необходимой для ввода рассматриваемого тела с объемом v в окружающую его внешнюю среду, имеющую давление р и находящуюся с телом в равновесном состоянии
I = u+Apv
Потенциальная энергия давления среды - работа, отдаваемая среде. Энтальпия является суммой внутренней энергии тела и потенциальной энергии давления среды.
Энтропия - функция состояния тела,принимающая для каждого его состоянияопределенное значение. Для обратимых циклов справедливо:
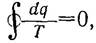
т.е. подынтегральное выражение представляет собой функцию состояния тела. Энтропия для 1 кг газа – s, измеряется в ккал/кг·град. Для произвольного
количества газа энтропия - S = Gs, где G — вес газа, кг.

где р, v, T — независимые параметры, определяющие состояние тела.
Свойство энтропии состоит в том, что изменения величин состояния тела в процессе не зависят от его характера и полностью определяются крайними состояниями тела в процессе и изменения этих величин в циклах равны нулю.
Решение примеров.
Задача. Определить давление при заданной температуре кипения для различных веществ, согласно табл. 1.1, и рис. 1.1. (Необходимо определить давление в мм. рт. ст., избыточное давление в ати , и давление в кг/см2, если 1 физ. ат =1,0333 кг/см2=760 мм. рт. ст.)
Таблица 1.1
Данные для определения давления
| № варианта | tкипºС | Вещество | № варианта | tкипºС | Вещество |
| 1 | -90 | СО2 | 16 | 210 | Н2О |
| 2 | -80 | СО2 | 17 | 230 | Н2О |
| 3 | -70 | СО2 | 18 | 250 | Н2О |
| 4 | -50 | СО2 | 19 | 270 | Н2О |
| 5 | -30 | СО2 | 20 | 280 | Н2О |
| 6 | -10 | СО2 | 21 | 370 | Нg |
| 7 | 0 | СО2 | 22 | 390 | Нg |
| 8 | 10 | СО2 | 23 | 410 | Нg |
| 9 | 20 | СО2 | 24 | 430 | Нg |
| 10 | 30 | СО2 | 25 | 450 | Нg |
| 11 | 110 | Н2О | 26 | 470 | Нg |
| 12 | 130 | Н2О | 27 | 490 | Нg |
| 13 | 150 | Н2О | 28 | 510 | Нg |
| 14 | 170 | Н2О | 29 | 530 | Нg |
| 15 | 190 | Н2О | 30 | 550 | Нg |
Контрольные вопросы
1. Что такое удельный объем, удельный вес, плотность?
2. Чему равна температура в ºК 0ºС?
3. Дайте определения энтропии, энтальпии.
4. Дайте определения или опишите процесс:
пара, парообразования, испарения, кипения, конденсации, возгонки, десублимации, насыщенного пара, сухого насыщенного пара, влажного насыщенного пара, перегретого пара.
5. В чем состоит различие между эмпирической и абсолютной температурами?
6. Какими приборами измеряются температура и давление?
7. В чем состоит различие между физической и технической атмосферами?
8. Как связаны между собой степень влажности и степень сухости пара?
Практическое занятие № 2
2. Термодинамические процессы.
Цель работы: Освоение методики расчетов параметров термодинамических процессов.
План проведения занятия:
1. Рассмотрение теоретических сведений.
2. Решение примеров.
3. Ответы на контрольные вопросы.
Краткие теоретические сведения
Удельная теплоемкость с–количество теплотыq,которое требуется для изменениятемпературы единицы количества вещества на один градус:

В зависимости от способа измерения единицы количества вещества, характера
термодинамического процесса и величины интервала температур различают несколько видов теплоемкостей.
1.В зависимости от единицы количества вещества – 1 кг, 1 м3, 1 кмоль
теплоемкость бывает массовой с[Дж/(кг К)] объемной c’ [Дж/(м3К)]
молярной µс[Дж/(кмоль К)]

Количество теплоты

где m – масса газа, Vн – объем газа, приведенный к нормальным физическим условиям, n
– число молей газа.
2. В зависимости от способа подвода теплоты теплоемкость бывает:
теплоемкость при постоянном давлении (изобарная)ср, теплоемкость при постоянном объеме (изохорная)сv.
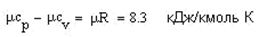
или

где R – газовая постоянная. Показатель адиабаты

3. В зависимости от интервала температур теплоемкость бывает:
истинная c –теплоемкость,соответствующая бесконечно малому интервалу температур, средняя cm-теплоемкость,соответствующая конечному интервалу температур.
При практических расчетах пользуются табличными данными средних теплоемкостей в интервале температур от 0 до t оС. Количество теплоты, требующееся для нагрева 1 кг рабочего тела от 0 до t1 или до t2:

где - табличные значения теплоемкостей в интервалах температур (0..t1) и (0..t2).
4. Термодинамический процесс –последовательное изменение состояния рабочего тела врезультате его энергетического взаимодействия с окружающей средой.
Равновесный процесс–тело последовательно проходит непрерывный ряд состоянийравновесия.
Обратимый процесс–в окружающей среде не остается никаких изменений,а телопроходит через одни и те же равновесные состояния, как в прямом, так и в обратном направлении.
Виды процессов в технической термодинамике:Изохорный –протекает при постоянном объеме, Изобарный –протекает при постоянном давлении, Изотермический –протекает при постоянной температуре, Адиабатный –отсутствует теплообмен с окружающей средой, Политропный –удовлетворяет уравнениюpVn= const.
При исследовании этих процессов определяют уравнение процесса в координатах p-V и T-s, связь между параметрами состояния газа, изменение внутренней энергии, величину
внешней работы и количество подведенной теплоты на осуществление процесса или количество отведенной теплоты.
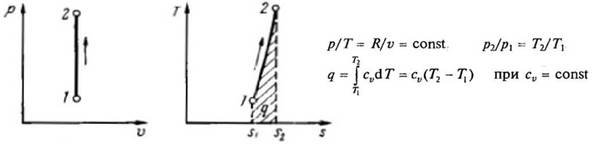
Рис.2.1 Изохорный процесс в p-V и T-s координатах

Рис. 2.2 Изобарный процесс в p-V и T-s координатах

Рис. 2.3 Изотермический процесс в p-V и T-s координатах
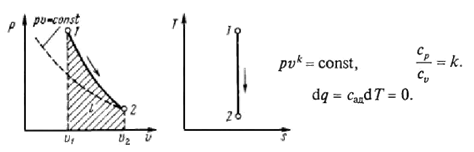
Рис. 2.4 Адиабатный процесс в p-V и T-s координатах
Политропный процесс имеет обобщающее значение–охватывает всюсовокупность основных термодинамических процессов.
pVn = const
Показатель политропы n может принимать любое численное значение в пределах от – ∞ до + ∞,но для данного процесса величина постоянная.

Термический КПД тепловой машины
К = (Q1-Q2)/Q1
где Q1 - теплота, переданная рабочему телу от теплоотдатчика; Q2 -теплота,отведенная от рабочего тела в теплоприемник.
В течение всего цикла рабочее тело совершает работу А = Q1 - Q2.

Рис. 2.5 Изображение основных термодинамических процессов идеального газа в p-V и T-s координатах.
Решение примеров.
1. Считая теплоёмкость идеального газа зависящей от температуры, определить: параметры газа в начальном и конечном состояниях, изменение внутренней энергии, теплоту, участвующую в процессе, работу расширения.
| Вариант | Процесс | t1, оС | t2, оС | Газ | p1,МПа | m, кг |
| 0 | Изохорный | 2400 | 400 | O2 | 1 | 2 |
| 1 | Изобарный | 2200 | 300 | N2 | 4 | 5 |
| 2 | Адиабатный | 2000 | 300 | H2 | 2 | 10 |
| 3 | Изохорный | 1800 | 500 | N2 | 3 | 4 |
| 4 | Изобарный | 1600 | 400 | CO | 5 | 6 |
| 5 | Адиабатный | 1700 | 100 | CO2 | 6 | 8 |
| 6 | Изохорный | 1900 | 200 | N2 | 8 | 3 |
| 7 | Изобарный | 2100 | 500 | H2 | 10 | 12 |
| 8 | Адиабатный | 2300 | 300 | O2 | 12 | 7 |
| 9 | Изобарный | 1500 | 100 | CO | 7 | 9 |
2. Сжатие воздуха в компрессоре происходит: а) по изотерме, б) по адиабате.
| Известны расход G, начальное давление Р1 = 100 кПа, начальная температура | t1 | 0C, | ||||||||
| степень сжатия | e. (Таблица 2.1) | величину теоретической работы сжатия, | ||||||||
| Определить | для | обоих | вариантов | |||||||
| мощности компрессора, а также изменения внутренней энергии и энтропии при сжатии.. | ||||||||||
| Теплоемкость воздуха Сv = f(t) считать постоянной. | Таблица 2 . 1 | |||||||||
| Последняя | e | t10C | Предпоследняя | G, кг/мин | ||||||
| цифра | цифра | |||||||||
| шифра | шифра | |||||||||
| 0 | 4 | 5 | 0 | 20 | ||||||
| 1 | 4.5 | 10 | 1 | 23 | ||||||
| 2 | 4.8 | 15 | 2 | 25 | ||||||
| 3 | 5.0 | 20 | 3 | 27 | ||||||
| 4 | 5.5 | 25 | 4 | 30 | ||||||
| 5 | 6.0 | 10 | 5 | 32 | ||||||
| 6 | 6.5 | 30 | 6 | 35 | ||||||
| 7 | 7.0 | 18 | 7 | 38 | ||||||
| 8 | 7.5 | 23 | 8 | 40 | ||||||
| 9 | 8.0 | 27 | 9 | 45 | ||||||
| 10 | 7.5 | 5 | 0 | 20 | ||||||
| 11 | 7.0 | 10 | 1 | 23 | ||||||
| 12 | 6.5 | 15 | 2 | 25 | ||||||
| 13 | 6.0 | 20 | 3 | 27 | ||||||
| 14 | 5.5 | 25 | 4 | 30 | ||||||
| 15 | 5.0 | 10 | 5 | 32 | ||||||
| 16 | 4.8 | 30 | 6 | 35 | ||||||
| 17 | 4.5 | 18 | 7 | 38 | ||||||
| 18 | 4 | 23 | 8 | 40 | ||||||
| 19 | 3.5 | 27 | 9 | 45 | ||||||
Контрольные вопросы
1. В чем заключаются особенности адиабатного процесса?
2. В чем заключаются особенности политропного процесса?
3. В чем заключаются особенности изобарного процесса?
4. В чем заключаются особенности изотермного процесса?
5. В чем заключаются особенности изохорного процесса?
6. Какие виды теплоемкости применяются при расчетах теплопередачи?
7. Что учитывает средняя теплоемкость?
8. В чем заключаются особенности равновесного термодинамического процесса?
9. Как связаны между собой молярная и массовая теплоемкости?
10. Как определить газовую постоянную через теплоемкости?
Практическое занятие № 3
3. Тепловые электрические станции
Цель работы: Ознакомиться с принципом работы тепловых электрических станций.
План проведения занятия:
1. Рассмотрение теоретических сведений.
2. Решение примеров.
3. Ответы на контрольные вопросы.
Дата добавления: 2019-07-15; просмотров: 535; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
