Электрический ток в жидкостях.
Жидкости, как и твердые тела, могут быть проводниками и диэлектриками.
К проводникам относятся растворы кислот, щелочей и солей. Их называют электролитами.
К диэлектрикам относится дистиллированная вода.
При растворении электролитов под влиянием электрического поля полярных молекул воды происходит распад электролитов на ионы.

 Пример: в воде находится молекула соляной кислоты: HCl. Эта молекула состоит из ионов H+ и Cl-, которые удерживаются кулоновской силой притяжения. Молекулу HCl окружают диполи воды и как бы растаскивают ее на ионы. В результате образуются (+) ионы-катионы и (- ) ионы-анионы.
Пример: в воде находится молекула соляной кислоты: HCl. Эта молекула состоит из ионов H+ и Cl-, которые удерживаются кулоновской силой притяжения. Молекулу HCl окружают диполи воды и как бы растаскивают ее на ионы. В результате образуются (+) ионы-катионы и (- ) ионы-анионы.
Распад молекул на ионы называется электролитической диссоциацией.Число, показывающее, какую часть всех молекул электролита составляют молекулы, распавшиеся на ионы, называются степенью диссоциации.
 В отсутствии внешнего электрического поля ионы движутся хаотически. Под действием электрического поля движение становится упорядоченным. Положительно заряженные ионы-катионы движутся к катоду (отрицательному электроду), а отрицательные ионы-анионы к аноду (положительному электроду). Т.е. возникает электрический ток.
В отсутствии внешнего электрического поля ионы движутся хаотически. Под действием электрического поля движение становится упорядоченным. Положительно заряженные ионы-катионы движутся к катоду (отрицательному электроду), а отрицательные ионы-анионы к аноду (положительному электроду). Т.е. возникает электрический ток.
Т.к. перенос заряда осуществляется ионами, то такую проводимость назвали ионной.
При электролизе происходит выделение веществ на электродах.
Процесс выделения веществ на электродах при прохождении электрического тока называется электролизом.
|
|
|
Это явление было изучено М.Фарадеем и в 1833 году установлены законы электролиза, которые получили имя ученого.
Первый закон Фарадея:
Масса вещества, выделившегося при электролизе, прямо пропорциональна величине заряда, прошедшего через электролит:
m = kq
т.к. I = 
 q =I t
q =I t  m = k I t,
m = k I t,
где q – заряд [Кл],
m – масса вещества [кг],
k – электрохимический эквивалент вещества [кг/Кл],
Он равен отношению массы вещества, выделившегося при электролизе на электролите к заряду, прошедшему через электролит.
Второй закон Фарадея:
Электрохимический эквивалент вещества пропорционален отношению молярной массы вещества к валентности:
k =  ,
,
где F – постоянная Фарадея , F=9,65 · 104 Кл/моль,
М – молярная масса [кг/моль],
n – валентность.
Объединенный закон электролиза Фарадея:
m =  или
или 
Тема 3
Электрический ток в газах и вакууме.
1. В обычных условиях газы состоят из нейтральных молекул и атомов и являются диэлектриками. Распад молекул и атомов газа на ионы называется ионизацией. Ионизаторами газа могут быть:
1) высокая температура
2) ультрафиолетовые лучи
|
|
|
3) рентгеновское излучение
4) 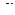 - излучение
- излучение
Процесс обратной ионизации называется рекомбинацией. В газах сочетается ионная и электронная проводимости.
Процесс протекания электрического тока через газ называется газовым разрядом. Электрический ток в газах – это направленное движение положительных ионов к катоду, отрицательных ионов и электронов к аноду.
Дата добавления: 2019-07-15; просмотров: 168; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
