Ревизионная артропластика бедренного компонента эндопротеза
Глава 10. Ревизионная артропластика тазобедренного сустава.
Как было отмечено ранее, эндопротезирование при тяжёлых травмах и заболеваниях тазобедренного сустава в настоящее время является методом выбора, позволяющим в краткие сроки купировать болевой синдром, восстановить функцию сустава, тем самым улучшить качество жизни пациентов, однако, рано или поздно встаёт вопрос о развивающейся нестабильности компонентов эндопротеза.
P.M. Pellicci с соавторами подсчитали, что в первый год с момента имплантации требуют замены 0,7 % эндопротезов, затем в течение каждого последующего года вплоть до 10 лет количество ревизий возрастает на 2,2 % ежегодно[Pellicci PM. 1986, Pellicci PM, с соавт. 1985.]. В настоящее время соотношение первичного и ревизионного эндопротезирования в крупнейших центрах мира составляет 4:1 и даже 3:1, а в ближайшем будущем на каждые две первичных операции, возможно, будет приходиться одна замена эндопротеза или его компонента [Волокитина, Е.А., 2005; Templeton J.E, 2001; Malchau H с соавт, 2002].
Основными показаниями к хирургической ревизии служат асептическое расшатывание эндопротеза или его компонентов, глубокое нагноение, рецидивирующие вывихи, усталостные переломы конструкций, переломы бедра или костей таза [Донченко С.В. с соавт., 2005; Каграманов, С.В., 2002]. Наиболее частой причиной ревизионной артропластики служит асептическое расшатывание, при этом вертлужный компонент проявляет признаки нестабильности в три раза чаще, чем бедренный [Неверов В.А., Закари С.М., 1997; Amstutz H.C с соавт,, 1982; Fender D. с соавт., 1999; Надеев А.А, 2006].
|
|
|
Ревизионная артропластика тазобедренного сустава, безусловно, является сложным оперативным вмешательством, имеющим особую философию, специальные технологии выполнения операции в условиях дефицита костной ткани, иные конструкции имплантатов и инструментарий. При всем многообразии неожиданностей, которые встречает хирург во время ревизионного эндопротезирования, следует иметь четкий план оперативного вмешательства, не допускающий методических блужданий, но и не исключающий творческого подхода. Поэтому, важным аспектом ревизионной артропластики является выбор классификации дефектов вертлужной впадины и проксимального отдела бедренной кости, которая бы наиболее полно отражала дефицит костной ткани на основе простых рентгенологических критериев.
Адекватная предоперационная оценка дефектов костной ткани, в свою очередь, предполагает наличие программы их хирургической реконструкции, соответствующей типу дефекта. Мы в своей практической деятельности пользуемся классификациями, предложенными W.G. Paprosky (для дефектов вертлужной впадины) и T.H. Mallory (для дефектов бедренной кости) [Paprosky W.G., Lawrence J., Cameron H.U 1991; Mallory T.H].
|
|
|
Ревизионная артропластика вертлужной впадины.
Для успешного проведения ревизии с заменой вертлужного компонента необходимо тщательно проследить историю развития заболевания, включая протокол первичной артропластики, рентгенограммы тазобедренного сустава в динамике, изменение жалоб пациента с момента имплантации эндопротеза.
Как правило, нестабильность вертлужного компонента эндопротеза сопровождается появлением боли в паховой области, усиливающейся при физической нагрузке. Наличие аналогичной боли при пассивной ротации и сгибании в тазобедренном суставе однозначно указывает на суставную их природу и позволяет дифференцировать с болью, обусловленной патологией поясничного отдела позвоночника.
Выполнение рентгенограмм в динамике позволяет оценить нарастание остеолиза вокруг вертлужного компонента. Как уже говорилось выше, наличие узкой полоски просветления (до 2 мм) вокруг чашки без увеличения ее ширины и протяженности при отсутствии клинических проявлений не является основанием для ревизионной артропластики [DeLee J.G. с соавт., 1976]. Диагноз нестабильности вертлужного компонента эндопротеза устанавливают на основании клинических проявлений (нарастающая боль в паховой области при ходьбе и движениях в суставе), рентгенологической картины остеолиза вокруг имплантата (ширина просветления более 2-х мм свидетельствует о нарушении фиксации протеза). Наибольшее значение имеют I и II зоны (по классификации Charnley-DeeLee). Миграция чашки является абсолютным подтверждением ее нестабильности.
|
|
|
Существует три основных методики ревизионной артропластики, обусловленной асептической нестабильностью вертлужного компонента эндопротеза тазобедренного сустава: «цементная», бесцементная и установка антипротрузионных конструкций.
Следует оговориться, что результаты операций с применением вертлужных компонентов цементной фиксации и использование костного цемента в качестве пластического материала, несмотря на использование современной цементной техники показывают неудовлетворительный результат [Тихилов Р.М., Цыбин А.В., Сивков В.С. с соавт. 2006; Р.М Тихилов, В.М. Машков, А.В. Цыбин, В.С c соавт. 2007; Цыбин А.В. 2007; Callagan J.J. с соавт., 2000; Paprosky W.G. с соавт., 1999; Templeton J.E., 2001].
При проведении ревизионной операции по замене вертлужного компонента эндопротеза тазобедренного сустава оперирующий хирург, как правило, стремится восстановить центр ротации сустава, что в большинстве случаев возможно после восстановления костной основы области вертлужной впадины [Dorr L.D. с соавт., 1995]. Однако, необходимо отметить существование альтернативных методик – установка компонента бесцементной фиксации малых размеров с высоким центром ротации, либо больших размеров (так называемые «Jumbo cup») в истинную вертлужную впадину. Установка вертлужного компонента выше истинного центра ротации сустава пока не нашла широкого применения при проведении ревизий с заменой вертлужного компонента, однако зарубежные коллеги отмечают хороший результат использования данной методики при долгосрочных наблюдениях [Dearborn J.T. с соавт., 1999]. W.H.Harris отмечает отличный результат применения данной методики у пациентов со значительными дефектами вертлужной впадины при среднем сроке наблюдения 16,8 лет [Harris W.H. 2006].
|
|
|
Применение имплантатов «press-fit» фиксации больших размеров (диметром более 68 мм) также показывает хороший результат [Ullmark G., 2000; Engh C.A. с соавт., 1998]. Эти компоненты рассматриваются как альтернатива опорным кольцам. Эффективность данной методики высока, хорошие результаты достигают в 94–98% случаев при сроках наблюдения свыше 10 лет [Whaley A.L, 2001].
Бесспорным преимуществом применения двух последних методик является отсутствие необходимости использования дополнительного пластического материала (массивных костных аллотрансплантатов) при значительном дефиците костной ткани области вертлужной впадины, однако проведение таких вариантов хирургической ревизии требует виртуозности выполнения и исключительного мастерства, иначе исход может быть непредсказуем.
Решение о том, какой тип реконструкции лучше использовать в каждом конкретном случае нестабильности вертлужного компонента должно основываться на тщательном предоперационном планировании, включающем оценку состояния костной ткани области вертлужной впадины и целостности ацетабулярного кольца (rim'a) для определения возможности установки имплантата бесцементной фиксации.
Отдельным вопросом является применение костных трансплантатов в качестве пластического материала для восполнения дефицита костной массы. На современном этапе развития костная пластика играет важную роль при проведений операций ревизионной артропластики, в особенности при значительном дефиците костной ткани.
В первую очередь необходимо определить функцию трансплантата (биологическая, механическая или комбинированная), после чего выбрать его тип (аутологичная костная стружка, фрагменты донорской вертлужной впадины, головки или мыщелков бедренной кости, спонгиозные блоки из метаэпифиза большеберцовой кости) [Денисов-Никольский Ю.Н., 2005].
В нашей практике мы используем аутологичную костную стружку, полученную непосредственно во время операции при обработке вертлужной впадины фрезами, замороженные донорские головки бедренных костей и фиксированные спонгиозные блоки из метаэпифизов большеберцовых костей.
Выбор способа хирургического лечения значительно облегчается, если известна величина дефекта вертлужной впадины и его локализация, для этого были предложены различные классификации. Наибольшую известность получили классификации Paprosky, Antonio, AAOS, Gross'а.
Классификация, разработанная W.G. Paprosky с соавт.(1991), отличается простотой воспроизведения и практической направленностью. Система точной оценки дефицита костной массы вертлужной впадины базируется на изучении рентгенограмм в переднезадней проекции. В основе рентгенологической оценки лежат четыре специфических критерия: степень лизиса костной ткани в области "фигуры слезы", нижнего края седалищной кости, количественная оценка миграции вертлужного компонента в краниальном направлении, оценка медиальной миграции чашки за линию Келера. Используя эти критерии, хирург до операции может оценить состояние кольца вертлужной впадины, внутренней стенки, передней и задней колонн вертлужной впадины. "Фигура слезы" соответствует вырезке вертлужной впадины, медиальная стенка определяет глубину впадины [Paprosky W.G., Lawrence J., Cameron H.U., 1999]. Полный лизис "фигуры слезы" означает не только повреждение внутренней стенки, но и потерю большей части костного вещества нижней и внутренней частей передней и задней колонн вертлужной впадины. Независимо от того, наступила ли деструкция костной ткани вследствие механического повреждения, или в результате воспалительной реакции как ответ на продукты стирания полиэтилена, повреждение внутренней стенки происходит вместе с деструкцией нижних отделов передней и задней колонн в связи с тем, что они связаны в единую анатомическую структуру. Полное отсутствие "фигуры слезы" означает потерю костного вещества в объеме 10-15% от объема кости вертлужной впадины, необходимой для фиксации вертлужного компонента. Рентгенологические признаки лизиса седалищной кости означают существенную потерю костного вещества нижней стенки задней колонны и задней стенки вертлужной впадины. Лизис указанных структур означает потерю 20-25% от всего костного вещества вертлужной впадины. При оценке миграции вертлужного компонента необходимо знать ее величину и направление. Величину смещения центра тазобедренного сустава устанавливают по сравнению с первичными рентгенограммами. Для этого проводят горизонтальную линию, соединяющую верхушки запирательных отверстий и измеряют расстояние между этой линией и центром сустава. Смещение центра сустава может быть в следующих направлениях: верхнелатеральном, верхнемедиальном и медиальном. Миграция в краниальном направлении вследствие косого наклона подвздошной кости может быть либо вверх и вовнутрь, либо вверх и кнаружи. Смещение имплантата вверх сопровождается разрушением крыши вертлужной впадины и повреждением обоих колонн. Степень смещения чашки вверх прямо пропорционально степени разрушения колонн и потере костного вещества, создающего противоупор для вертлужного компонента. Миграция чашки на 3 см вверх от линии запирательного отверстия (или на 2 см от нормального центра ротации тазобедренного сустава) означает существенную потерю костной ткани, оцениваемую в 25-50% от всего костного запаса вертлужной впадины. Хотя миграция чашки вверх сопровождается повреждением обеих колонн, при смещении в верхнелатеральном направлении в большей степени страдает задняя колонна, а при верхнемедиальном - передняя колонна. Верхнелатеральная дислокация является более неблагоприятной, т.к. сопровождается значительным разрушением задней колонны и имеет тенденцию к быстрому прогрессированию. Кроме того, важным фактором, влияющим на прогрессирование остеолиза является величина нагрузки на сустав, она ниже при расположении центра ротации более медиально, книзу и кпереди. И наоборот, нагрузка больше при смещении центра вверх, латерально и кзади. Это объясняет быстрое прогрессирование дислокации при верхнелатеральной миграции чашки. Однако, верхнемедиальные дефекты более обширные и представляют большие сложности для оперативного лечения. Медиальная миграция чашки (или протрузионный дефект вертлужной впадины) сопровождается повреждением внутренней стенки, нижнего и внутреннего отделов обеих колонн и проявляется дислокацией имплантата за линию Келера.
Описанные выше четыре рентгенологических критерия были использованы для создания классификации дефектов вертлужной впадины и положены в основу обоснования выбора имплантатов бесцементной фиксации и реконструкции костной основы вертлужной впадины.
По классификации W.G. Paprosky выделяют три типа дефектов вертлужной впадины. Тип 1 дефекта вертлужной впадины. Этот тип ацетабулярного дефекта почти аналогичен таковому, который создается хирургом во время первичной артропластики. Кольцо вертлужной впадины остается интактным, определяется минимальный лизис костной ткани вокруг чашки. Большие структурные дефекты костной ткани отсутствуют, возможно появление небольших отверстий после удаления остатков костного цемента. Нет признаков остеолиза в области "фигуры слезы" и седалищной кости, миграция вертлужного компонента отсутствует (имплантат не заходит за линию Келера и не смещен вверх). Таким образом, при этом типе дефекта сохраняется крыша вертлужной впадины, ее внутренняя стенка и обе колонны. Более 90% губчатой костной ткани вертлужной впадины сохранены и могут контактировать с пористой поверхностью вертлужного компонента. Реконструкция заключается в минимальной пластике аутологичной костной стружкой небольших дефектов костной ткани (рис. 11.1). Применение вертлужных компонентов бесцементной фиксации различных дизайнов показывает хороший и отличный результат у 94-98% больных при сроках послеоперационного наблюдения более 10 лет [Leopold S.S. с соавт., 1999; Mulliken B.D. с соавт. 1996].
|



а) б) в)
Рис. 11.1. а) Схематическое изображение дефекта вертлужной впадины (тип 1) и рентгенограммы левого тазобедренного сустава б-й Ф., 49 лет: б) через 4 года после первичного эндопротезирования тазобедренного сустава; в) ревизионное эндопротезирование, вертлужная впадина обработана обычным путем, установлена чашка бесцементной фиксации (Trilogy, Zimmer, Warsaw) и полнопокрытая ревизионная ножка AML (J&J, DePuy).
Тип 2 дефекта вертлужной впадины. Это наиболее часто встречающийся тип дефекта вертлужной впадины, при котором зона остеолиза увеличивается, кольцо вертлужной впадины вытягивается вверх, но передняя и задняя колонны остаются интактными.
Тип 2А дефекта вертлужной впадины отличается от типа 1 большим остеолизом, начальными признаками миграции вертлужного компонента вверх, но не более 3-см выше линии, проведенной через вершину запирательного отверстия или 2-х см выше нормального центра ротации тазобедренного сустава. Остеолиз "фигуры слезы" имеет небольшой объем и затрагивает только ее наружный край. Лизис седалищной кости не распространяется выше 7 мм от верхнего края запирательного отверстия. Внутренняя миграция чашки минимальна, линия Келера остается интактной. Реконструкцию этого типа дефекта вертлужной впадины выполняют по тем же правилам, что и предыдущего - используют чашку с пористым покрытием с заполнением мелких дефектов вертлужной впадины костной стружкой. Примерно от 85 до 90% имплантата будет контактировать с костной тканью, а 10-15% поверхности чашки может остаться недопокрытой в верхней части (рис. 11.2).
|



а) б) в)
Рис. 11.2 а) Схематическое изображение дефекта вертлужной впадины (тип 2А) и рентгенограммы правого тазобедренного сустава б-го Л., 59 лет: б) через 3 года после первичного эндопротезирования тазобедренного сустава; в) ревизионное эндопротезирование, вертлужная впадина обработана обычным путем, установлена чашка бесцементной фиксации (Duraloc, J&J, DePuy) и полнопокрытая ревизионная ножка AML Solution (J&J, DePuy).
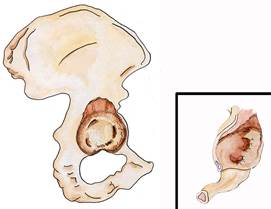
Тип 2В дефекта вертлужной впадины отличается от предыдущего большей вытянутостью кольца вертлужной впадины вверх (на месте полусферы образуется эллипс). Смещение чашки вверх достигает 3 см и приводит к частичному разрушению крыши вертлужной впадины. Степень остеолиза "фигуры слезы" и седалищной кости остается минимальной. Чашка смещается не только вверх, но и медиально, однако линия Келера остается интактной, имплантат находится вне малого таза. Передняя и задняя колонны не повреждены. При этом типе дефекта вертлужной впадины может быть использован вертлужный компонент с пористым покрытием. Контакт имплантата с костной тканью вертлужной впадины будет более 60% и, примерно, от 20 до 30% чашки может остаться недопокрытой в верхнем отделе (рис. 11.3).
|
a)



б) в) г)
Рис. 11.3. Схематическое изображение дефекта вертлужной впадины и рентгенограммы левого тазобедренного сустава б-й Ж., 52 лет: а) Схематическое изображение дефекта вертлужной впадины (тип 2В) б, в) 10 лет после первичного эндопротезирования левого тазобедренного сустава, чашка установлена со смещением в краниальном направлении, после ее удаления дефект вертлужной впадины 2 В типа; г) установлен вертлужный компонент (Trilogy, Zimmer, Warsaw) с одновременным костно-пластического замещения дефекта крыши вертлужной впадины, ножка – VerSys Bd, Zimmer, Warsaw).
Тип 2С дефекта вертлужной впадины представляет собой дальнейшее прогрессирование дефекта 2 типа. Вертлужный компонент мигрирует медиально и немного вверх, подобно тому, что наблюдается при 2А типе, немного не переходя порог 3 см выше линии запирательного отверстия. Медиальное смещение выражено в большей степени - дефект распространяется за линию Келера, образуя дефект внутренней стенки вертлужной впадины. В связи с медиальным распространением остеолиза степень разрушения "фигуры слезы" достигает средней или тяжелой степени, в большинстве случаев с полным ее рассасыванием. Остеолиз седалищной кости остается минимальным, что указывает на сохранение задней колонны вертлужной впадины. Реконструкция вертлужной впадины предполагает заполнение центрального дефекта костной стружкой и только в случае больших размеров применяют костную пластику из головки бедренной кости (аллотрансплантат), подготовленной в виде тонкой полусферы и уложенной на дно, другим вариантов заполнения прорузионного дефекта является имплантация спонгиозного блока из метаэпифиза донорской большеберцовой кости.
Ацетабулярное кольцо сохраняет свою опорную функцию, поэтому может быть использована чашка бесцементной фиксации с пористым покрытием, ее контакт с костной тканью вертлужной впадины составляет более 60%. По данным J.T. Dearbon и W.H. Harris даже при больших дефектах вертлужной впадины применение чашек бесцементной фиксации обеспечивает очень прочную механическую стабильность имплантата (Рис. 11.4) [Dearbon JT, Harris WH 2000].
|


а) б)


в) г)
Рис. 11.4. Схематическое изображение (а) дефекта вертлужной впадины (тип 2С) и рентгенограммы левого тазобедренного сустава б-й П., 53 лет: б) нестабильность вертлужного компонента с дефектом дна вертлужной впадины через 6 лет после первичной артропластики; в) ревизионная артропластика: дно впадины заполнено массивным аллотрансплантатом, установлен вертлужный компонент бесцементной фиксации (Duraloc, J&J, DePuy) больших размеров (68 мм) с дополнительной фиксацией 2-я винтами и полнопокрытая ревизионная ножка AML Solution с калькаром (J&J, DePuy); г) через 2 года после операции.
Тип 3 дефекта вертлужной впадины отличается от предыдущего типа значительным прогрессированием остеолиза и массивным разрушением костного вещества. Крыша вертлужной впадины становится неопорной, и поскольку остеолиз распространяется также на переднюю и заднюю колонны они также теряют свою способность удерживать имплантат. Этот тип дефекта представляет собой тяжелое разрушение вертлужной впадины и при оперативном вмешательстве предполагает использование массивных аллотрансплантатов для восполнения потери костной ткани.
Тип 3А включает в себя преимущественное разрушение крыши вертлужной впадины со смещением вертлужного компонента на 3 см выше линии запирательного отверстия или на 2 см выше уровня нормального центра ротации тазобедренного сустава. Лизис "фигуры слезы" имеет среднюю степень с поражением всего наружного края. Степень разрушения седалищной кости остается на уровне легкой - средней с остеолизом на протяжении менее 15 мм от верхнего края запирательного отверстия. Вертлужный компонент мигрирует больше вверх чем медиально, поэтому линия Келера остается либо интактной, либо имплантат слегка заходит за ее край. При этом типе дефекта крыша вертлужной впадины теряет опору, но передняя и задняя колонны способны фиксировать чашку с пористым покрытием. Нижняя часть вертлужной впадины сохранена и возможна остеоинтеграция с пористой поверхностью чашки. Площадь контакта имплантата с костной тканью составляет 40-60%, однако для обеспечения длительной фиксации чашки необходимо выполнить костную пластику верхнего отдела вертлужной впадины костным аллотрансплантатом из головки или мыщелков бедренной кости.
Надо иметь в виду, что использование массивных аллокостных трансплантатов таит в себе опасность остеолиза и, как следствие, развитие нестабильности эндопротеза. Результаты операции во многом зависят от хирургической техники, размеров трансплантатов и сроков, прошедших после операции. Наибольшее признание получила хирургическая техника, суть которой заключается в ориентации головки бедренной кости по ходу силовых линий, введении спонгиозных винтов под углом 45°, окончательной обработке вертлужной впадины после прочной фиксации аллотрансплантата. Однако даже при таких условиях выполнения костной пластики наблюдается большой разброс результатов операций у разных авторов. По данным B.P.Lee с соавт. (1997) частота ревизий вертлужного компонента через 5 лет составила 8%, через 10 лет - 26%. Исследования S.Avci с соавт. (1998) показали, что при средних сроках наблюдения 5 лет после операции удовлетворительные результаты наблюдались у 17% больных и плохие - у 19%. Самую неудовлетворительную статистику приводят J.T.Dearbon и W.H.Harris (2000) - через 16 лет после имплантации массивных аллотрансплантатов в 66% случаев потребовалась повторная операция связанная с нестабильностью вертлужного компонента. Имея столь плачевную статистику, авторы очень осторожно подходят к применению аллотрансплантатов и рекомендуют по возможности использовать ацетабулярные компоненты больших размеров (Jumbo cup). И, тем не менее, дефекты костной ткани настолько велики, что невозможно обойтись без костной пластики, в качестве имплантатов чаще других мы применяем опорное кольцо Bursh-Schneider’a, которое защищает костные трансплантаты на время их перестройки (рис. 11.5)
|

а)


б) в)
Рис. 11.5. Схематическое изображение (а) дефекта вертлужной впадины (тип 3А) и рентгенограммы правого тазобедренного сустава б-й С., 56 лет: б) нестабильность вертлужного компонента с дефектом дна вертлужной впадины через 6 лет после первичной и 3 года после ревизионной артропластики; в) ревизионная артропластика: костный дефект впадины заполнен измельченым аллотрансплантатом, установлено опорное кольцо Bursh-Schneider’a (Zimmer, Warsaw) .
Тип 3 В представляет массивный дефект с полной потерей опоры всех структур вертлужной впадины. Как и в предыдущем случае разрушается крыша вертлужной впадины и имплантат смещается вверх на 3 см выше верхнего края запирательного отверстия. Кроме того, наблюдается и смещение чашки вовнутрь в полость малого таза с захождением ее за линию Келера и полной облитерацией внутреннего отдела "фигуры слезы". Задняя колонна также имеет признаки повреждения и теряет свою опороспособность, рентгенологически это проявляется распространением зоны остеолиза ниже 15 мм от верхнего края запирательного отверстия. Таким образом, при этом типе поражаются крыша вертлужной впадины, обе колонны и дно, менее 40% костной ткани сохраняет свою способность фиксировать вертлужный компонент с пористым покрытием.
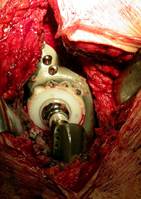
Существуют различные способы лечения больших дефектов вертлужной впадины. На начальных этапах ревизионной артропластики применяли установку вертлужных компонентов цементной фиксации с использованием большого количества костного цемента, однако это приводило к развитию ранней нестабильности чашки, прогрессу дефицита костной ткани. По наблюдениям H.C. Amstutz с соавт. (1982) нестабильность вертлужного компонента появилась у 9,1% больных в течение 2-х лет после операции, поэтому от этой практики практически повсеместно отказались. Применение комбинации массивных аллотрансплантатов и чашек бесцементной фиксации также таит в себе повышенный риск ранних и поздних осложнений. Частота неудовлетворительных результатов составляет от 17 до 60% через 2-14 лет после операции (Callaghan J.J. et al., 1985, Kavanagh B.F. et al., 1989), в связи с чем в большинстве зарубежных клиник эта методика применяется крайне редко. Поэтому большинство хирургов при лечении больших дефектов вертлужной впадины рекомендуют использовать либо пересадку всей вертлужной впадины и установку чашки цементной фиксации (преимущественно у лиц молодого возраста), либо опорное антипротрузионное кольцо и чашку цементной фиксации (у больных старших возрастных групп). Применение антипротрузионных колец (АПК) создает условия для защиты костных трансплантатов и восстановления костной основы вертлужной впадины, обеспечивает хорошие результаты артропластики (Аль-Танани, А.С., 2005; Allen, P.W, 2003; Bradford M.S., 1995; Goldberg, V.M, 2000). Особенности хирургической техники установки АПК заключаются в том, что после удаления старых имплантатов, рубцовой ткани и дебриса, вертлужную впадину обрабатывают фрезами только для сглаживания костных неровностей. После этого необходимо провести предварительную примерку АПК. Мы в своей практике пользуемся кольцами Bursh-Schneider'a, которые имеют правую и левую ориентацию и три размера – 44, 50 и 56 мм. Указанные размеры соответствуют внутреннему диаметру, тогда как наружные - на 4 мм больше. При установке АПК опирается на верхний, задний край вертлужной впадины и седалищную кость. Наличие дефекта передней и латеральной стенок вертлужной впадины не является препятствием для использования АПК. При наличии дефекта задней опорной колонны и отсутствии опоры для кольца необходимо предусмотреть костную пластику заднего отдела впадины губчатым аллотрансплантатом с последующей установкой АПК. Существуют разные взгляды на положение нижнего клюва АПК, мы предпочитаем внедрять его в паз, сформированный в ветви седалищной кости. Эта манипуляция несколько удлиняет операцию, однако создает дополнительную стабильность конструкции. После того, как произведена адаптация костной основы вертлужной впадины к кольцу, все дефекты тщательно заполняют измельченной губчатой костной тканью. Если определяется большой центральный дефект, то предварительно на дно впадины укладывают трансплантат, изготовленный из головки бедренной кости и имеющий слегка вогнутую форму. В процессе укладки и импакции аллотрансплантатов производят неоднократные проверки соответствия конгруэнтности подготовленной вертлужной впадины и АПК. Избыточное заполнение впадины трансплантатом может привести к тому, что кольцо займет вертикальное положение и сместится латерально, что является нежелательным. После того, как АПК получила опору на периферическую и центральную части вертлужной впадины производят фиксацию ее 4-5 спонгиозными винтами через отверстия в верхней опорной пластинке и задне-верхней дуге кольца. Винты проходят в медиальном направлении примерно под углом 10-15° снизу вверх с обязательной перфорацией внутренней кортикальной стенки. В некоторых случаях винты проходят через аллотрансплантат, что не является ошибкой. При необходимости, можно провести 1-2 винта со стороны внутренней поверхности кольца. После прочной фиксации кольца, на костный цемент устанавливают полиэтиленовый компонент эндопротеза. Анализ литературы по проблеме показал, что неудовлетворительные результаты применения АПК наблюдаются у 5,4% больных при средних сроках наблюдений 6,6 лет (Schatzker J., 1999), хорошие и отличные - у 65%. Таким образом, применение АПК позволяет у подавляющего большинства больных с тяжелым разрушением вертлужной впадины обеспечить хорошие отдаленные результаты (рис. 11.6).
|

а)



б) в) г)


д) е)
Рис. 11.6. Схематическое изображение (а) дефекта вертлужной впадины (тип 3А) рентгенограммы и интраоперационные фотографии левого тазобедренного сустава б-й Р., 53 лет: б,в) нестабильность вертлужного компонента, после ранее перенесенных 6 оперций сохранилась задняя стенка вертлужной впадины (отмечена стрелкой); г,д,е) ревизионная артропластика: костный дефект впадины восстановлен аллотрансплантатом вертлужной впадины, и защищен антипротрузионным кольцом Bursh-Schneider'a (Zimmer, Warsaw); е) через 2 года после операции.
Ревизионная артропластика бедренного компонента эндопротеза
Целью ревизионной артропластики является создание прочной конструкции сустава, включающей хорошую фиксацию ножки, стабильный сустав и восстановление костной основы бедренной кости. Однако существует множество факторов, затрудняющих выполнение поставленных задач. Среди них наиболее важными являются следующие: большой дефект костной ткани, нестабильность сустава, инфекция, перелом бедренной кости (в результате массивного остеолиза), отсутствие сращения большого вертела. В отличие от ревизионной артропластики вертлужного компонента при замене бедренного компонента хирург может столкнуться с проблемой удаления имплантата и остатков цемента, переломом бедренной кости, перфорацией кортикальной стенки, отсутствием прочной фиксации имплантата и т.д.
Поэтому при предоперационном планировании необходимо ответить на следующие ключевые вопросы, в частности: какой доступ к тазобедренному суставу лучше использовать; как лучше удалить имплантат с минимальной травматизацией костной ткани; какой тип реконструкции лучше использовать, и какой тип ножки должен быть для этого выбран; как добиться прочной фиксации ножки; как заместить дефект костной ткани.
Предоперационное планирование. При предоперационном планировании необходимо тщательным образом проанализировать историю заболевания и ответить на вышеперечисленные вопросы. Важно иметь в своем распоряжении детали предшествующей операции, описание операционных и послеоперационных осложнений, а также уточнить жалобы, заставившие пациента обратиться за консультацией.
Важность детального сбора анамнеза трудно переоценить. К примеру, если у больного после первичной артропластики все время сохранялся болевой синдром, или боль появилась спустя короткое время, наблюдалось повышение температуры тела, в этом случае можно предположить наличие латентной инфекции. При таком течении заболевания усилия хирургов должны быть направлены на поиск очага воспаления. Этому могут помочь исследования крови (наличие лейкоцитоза, СОЭ, С-реактивный белок, исследование уровня провоспалительных цитокинов, в частности, интерлейкинов 1α, 1β, фактора 8, фактора некроза опухоли), аспирация содержимого из полости тазобедренного сустава и микробиологическое исследование.
Желательно определить механизм развития нестабильности бедренного компонента, еще до операции хирург должен знать тип и размер установленного ранее протеза.
Клинически нестабильность ножки эндопротеза проявляется болью в области бедра, которая усиливается при физической нагрузке и проходит после отдыха. При обследовании болезненность можно вызвать, создав форсированную осевую нагрузку на конечность или путем проведения ротационных движений в положении разгибания или сгибания в тазобедренном суставе.
Следующим этапом обследования больного является изучение рентгенограмм таза, бедра (с захватом всего бедренного компонента) в прямой и боковой проекциях и вертлужной впадины в боковой проекции. Изменения на рентгенограммах должны быть оценены в динамике в сравнении с первичными, при этом важно обращать внимание на оседание и другие изменения положения имплантата, протяженность и выраженность остеолиза, качество костной ткани, наличие дефектов кости, расположение цементной мантии и цементной пробки, состояние кортикальных стенок. Возможно наличие и других патологических изменений, таких как перипротезный перелом, гетеротопические оссификаты, несращение большого вертела на месте остеотомии.
Целесообразно проводить предоперационное планирование вместе со всей хирургической бригадой. Хотя это и не всегда возможно, тем не менее, нужно стремиться к созданию целостной картины зоны поражения костной ткани, иметь план доступа к тазобедренному суставу и бедренной кости для удаления имплантата и костного цемента с сохранением костной ткани и окружающих мышц. Всегда, наряду с основным, необходимо иметь несколько альтернативных вариантов проведения операции.
Все пациенты с нестабильностью ножки имеют дефицит костной ткани различной степени выраженности. Результаты ревизионной артропластики часто зависят от размера поражения кости и возможности хирурга восстановить костную основу бедренной кости. Выбор способа операции также зависит от степени разрушения кости. Поэтому важным элементом выработки стратегии лечения является классификация дефектов костной ткани, которая предполагает не только описание протяженности и локализации зоны остеолиза, но и определенную лечебную тактику. Мы в своей практике пользуемся классификацией Mallory (1988), в которой различают четыре категории дефектов бедренной кости при нестабильности бедренного компонента.
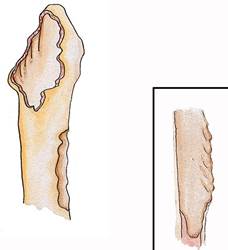
I тип - интактная губчатая костная ткань проксимального отдела бедра без истончения стенок и дефицита костной ткани, интактная кортикальная трубка.
II тип - дефицит губчатой костной ткани проксимального отдела бедренной кости при сохраненной кортикальной трубке. Возможно наличие небольших дефектов в метафизе и истончение кортикальной стенки диафиза бедренной кости. Однако метафизарная часть способна обеспечить хорошую фиксацию и врастание костной ткани в пористое покрытие ножки эндопротеза.
III тип - дефицит губчатой костной ткани проксимального отдела бедра и нарушение целостности кортикальной трубки. Стабильная фиксация эндопротеза невозможна из-за дефектов костной ткани метафиза и перфорации диафизарного отдела бедра. W.G. Paprosky подразделяет этот тип дефекта бедренной кости на две подгруппы в зависимости от состояния кортикальной костной ткани в области перешейка: подтип А - сохранено минимум 4 см диафизарной трубки и на этом протяжении возможна фиксация ножки протеза, подтип В - протяженность сохраненной костной ткани в области перешейка менее 4 см и возможна фиксация имплантата лишь в дистальных отделах бедренной кости.
IY тип - отсутствие губчатой и кортикальной костной ткани проксимального отдела бедренной кости с образованием сегментарного дефекта.
Доступ к тазобедренному суставу. Выбор доступа определяется опытом и степенью удобства для оперирующего хирурга. В своей практике при ревизионной артропластике мы использовали прямой наружный доступ (даже если при первой операции применялся задний доступ), аналогичный описанному ранее при первичной артропластике. Однако в некоторых случаях, при обширном рубцовом процессе, возможных трудностях с удалением костного цемента, мы используем доступ с расширенной остеотомией проксимального отдела бедренной кости. При всей своей кажущейся травматичности, он обеспечивает максимальную сохранность оставшихся мягких тканей и хороший обзор операционного поля.
Удаление имплантата. Важным этапом оперативного вмешательства является удаление эндопротеза. При цементной фиксации ножки необходимо определить степень подвижности имплантата, размеры цементной мантии и прочность связи последней с костью. По данным рентгенологического обследования можно определить форму ножки (прямая или изогнутая), локализацию расшатывания (на границе кость-цемент или цемент-имплантат), глубину расположения цементной пробки. При бесцементной фиксации ножки основным вопросом является степень остеоинтеграции с поверхностью имплантата, т.к. при наличии прочной фиксации ножки необходима принципиально иная хирургическая техника для ее удаления (в отличие от варианта, когда имплантат нестабилен).
При удалении эндопротеза необходимо всячески избегать дополнительного повреждения костной ткани. Операцию начинают с тщательного удаления мягких тканей, костных напластований и цемента вокруг проксимальной части ножки таким образом, чтобы не произошло ее заклинивания при выбивании. После успешного удаления ножки необходимо освободить костный канал от остатков цементной мантии и дистальной цементной пробки. Для этого существуют различные специальные инструменты: изогнутые и прямые долота, кусачки, высокоскоростные боры, ультразвуковые насадки и т.д. При работе с этими инструментами необходимо соблюдать особое внимание, чтобы не перфорировать стенку бедренной кости. В качестве контроля за положением инструментов и лучшей визуализации полноты удаления цемента иногда рекомендуется сделать трепанационное отверстие кортикальной стенки бедра на протяжении 2-3 см ниже пробки. Это позволяет хирургу контролировать положение сверла при перфорации цементной пробки (для ее последующего удаления при помощи штопора), а также быть уверенным в полном освобождении костного канала от остатков цемента и костной крошки. Если же костный цемент фиксирован очень прочно, или цементная пробка располагается далеко в дистальном направлении, применяют хирургическую технику, аналогичную той, которая используется для удаления бесцементной ножки с пористым покрытием. Суть операции заключается в продольной остеотомии проксимального отдела бедренной кости, как правило, до середины ножки эндопротеза или дистального края пористого покрытия бедренного компонента, что составляет примерно 10-12 см от верхушки большого вертела, с таким расчетом, чтобы бедренная кость оставалась интактной на протяжении, как минимум, 4-6 см ниже остеотомии для последующей фиксации ревизионной ножки. В качестве примера ревизионной артропластики с продольной остеотомией бедренной кости приводим клиническое наблюдение.
Б-й Л., 40 лет, впервые обратился в клинику в 1992 году. При обследовании установлен диагноз: двусторонний коксартроз на почве асептического некроза головок бедренных костей. В 1992 г. слева была выполнена первичная артропластика тазобедренного сустава с имплантацией эндопротеза АРЕТЕ, в 1993 г. - справа – лечебная межвертельная остеотомия. Боль в левом тазобедренном суставе вновь появилась в 1995 году, постепенно стала прогрессировать. При рентгенологическом обследовании был выявлен перелом ножки эндопротеза, остеолиз проксимального отдела бедренной кости (рис.11.7 а). 5.02.98 была выполнена операция – ревизионная артропластика левого тазобедренного сустава. Остеотомия проксимального отдела бедренной кости выполнена из заднего доступа остеотомом по линии прикрепления мышц, с последующей поперчным пересечением бедренной кости и после приподнимания костного фрагмента – завершение остеотомии передней кортикальной стенки. При ревизии тазобедренного сустава выявлено: вертлужный компонент стабилен, однако между чашкой и дном вертлужной впадины находилось большое количество продуктов стирания полиэтилена, грануляционная ткань. Удалены оба фрагмента ножки эндопротеза, весь проксимальный отдел тщательно обработан костной ложкой, иссечена грануляционная ткань. Вертлужный компонент удален, после обработки впадины фрезами установлена чашка бесцементной фиксации диаметром 66 мм и дополнительно фиксирована винтом. Дистальный отдел бедренной кости обработан сверлами (до 13 мм), после чего введена ревизионная ножка эндопротеза диаметром 13,5 мм с полным пористым покрытием (длина ножки 200 мм). Длина ножки выбрана с учетом того, чтобы, как минимум, 6-8 см имплантата располагались в неповрежденном участке бедренной кости. Пространство между эндопротезом и эндостальной поверхностью проксимальной части бедренной кости было плотно заполнено костной стружкой. Линия остеотомии и истонченные стенки проксимального отдела бедра укреплены кортикальным аутотрансплантатом малоберцовой кости (рис.11.7 б,в). При осмотре через 4 года – жалоб нет, ходит с полной нагрузкой на оперированную ногу.



а б в
Рис. 11.7. Рентгенограммы левого тазобедренного сустава б-го Л.: а) перелом ножки эндопротеза, остеолиз проксимального отдела бедра; б) установлена длинная ревизионная ножка эндопротеза, костная пластика дефектов губчатой костной тканью, линия остеотомии и истонченные стенки проксимального отдела бедренной кости укреплены кортикальными аллотрансплантатами; в) 4 года после операции – стабильная фиксация эндопротеза, перестройка костных трансплантатов.
Стабильная фиксация ножки эндопротеза. Существует большое количество операций, направленных на достижение стабильной фиксации ножки эндопротеза при ревизионной артропластике. Наибольшее распространение получили методы цементной, бесцементной фиксации имплантата с использованием различных вариантов костной пластики (кортикальные аллотрансплантаты, импакция губчатой костной ткани, пересадка всего проксимального отдела бедренной кости).
1.Ревизионная артропластика с применением ножки цементной фиксации. Применение ножек цементной фиксации при ревизионной артропластике имеет как положительные, так и отрицательные стороны. Основное преимущество заключается в достижении практически немедленной стабильности имплантата и обеспечении ранней мобилизация больного. Тем не менее, надо отдавать себе отчет, что зачастую эндостальная поверхность бедренной кости бывает настолько склерозированной и гладкой, что невозможно добиться такой же прочной фиксации цемента, как и при первичной артропластике. Исследования Dohmae с соавт.(1988) показали, что при ревизионной цементной артропластике сила сцепления между ножкой эндопротеза и костной тканью уменьшается на 20,6%. Кроме того, имеются технические проблемы, препятствующие достижению хорошей "прешуризации" костного цемента при использовании длинных ножек, появляется опасность потери еще большего количества костной ткани при нестабильности вновь имплантированной ревизионной ножки и необходимость выполнения ревизионной артропластики. Результаты применения ножек цементной фиксации крайне противоречивы. Частота повторных операций колеблется от 3 до 38% (Kavanagh B.F., с соавт. 1989; Stromberg C.N., с соавт.1992), а если принимать во внимание рентгенологические признаки нестабильности имплантата, то эта цифра увеличится до 53% (Morrey B.F., 1992). Современная цементная техника (тщательная подготовка канала, применение дистальных пробок и "прешуризация") улучшили результаты операций, однако даже в этом случае частота повторных хирургических вмешательств остается достаточно высокой и составляет приблизительно 10% при средних сроках наблюдения 9 лет (Estok D.M., Harris W.H., 1994.; Katz R.P., Callaghan J.J., 1995; Pierson J.L., Harris W.H., 1995). Иногда, особенно у пожилых больных, и в случаях, когда ножку удаляли для облегчения ревизии ацетабулярного компонента, возможна установка нового имплантата на цемент без удаления старой цементной мантии. Lieberman с соавт. (1993) доложили о 19 больных без признаков остеолиза при сроках наблюдения не менее 59 месяцев. В качестве примера использования ножки цементной фиксации при ревизионной артропластике приводим клиническое наблюдение.
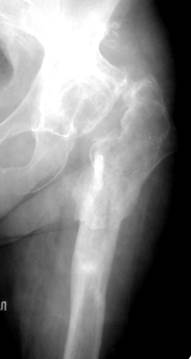
Больная Ш., 65 лет впервые была оперирована в 1992 году, когда ей по поводу левостороннего коксартроза был имплантирован эндопротез Герчева. Боль рецидивировала в 1996 году, тогда же был выявлен перелом ножки эндопротеза (рис.11.8 а). В ноябре 1996 г. в одной из городских больниц была выполнена операция – укрепление ножки эндопротеза при помощи костных аутотрансплантатов. В послеоперационном периоде развилось нагноение раны, в связи с чем в клинике протез был удален. Через год после купирования воспалительного процесса было выполнено ревизионное эндопротезирование (23.12.98). Доступом с отсечением большого вертела обнажен левый тазобедренный сустав, вертлужная впадина обработана фрезами до 55 мм, установлена чашка бесцементной фиксации 58 мм и дополнительно укреплена двумя винтами. Вскрыт костномозговой канал и обработан конической разверткой. При этом выявлено, что большой вертел сросся в положении отведения и ротации, канал бедренной кости резко деформирован, а на передней стенке бедренной кости имеется дефект костной ткани клиновидной формы на протяжении 8 см (рис. 11.8 б). Целостность кортикальной трубки восстановлена при помощи кортикальных аллотрансплантатов, фиксированных серкляжными швами. Канал бедренной кости обработан рашпилями, введена костная пробка, после чего установлена ревизионная ножка цементной фиксации. Большой вертел низведен и фиксирован винтом (рис. 11.8 в). При осмотре через 3 года – жалоб нет, ходит с полной нагрузкой на ногу, тростью пользуется при передвижении на большие расстояния. Выбор цементной ножки был обусловлен выраженной деформацией костного канала и необходимостью проведения операции с минимальной кровопотерей в кратчайшие сроки в связи с заболеванием почек.


а б в
Рис. 11.8. Рентгенограммы левого тазобедренного сустава б-й Ш., 65 лет: а) перелом ножки эндопротеза, остеолиз проксимального отдела бедра; б) область тазобедренного сустава после удаления эндопротеза: выраженная деформация бедра, большой вертел сросся с отведением и ротацией; в) гибридный эндопротез с костнопластическим восстановлением непрерывности кортикальной стенки.
2. Ревизионная артропластика с применением ножки бесцементной фиксации. В связи с высоким процентом неудовлетворительных результатов после цементного ревизионного эндопротезирования, предпочтительно применение ножек, рассчитанных на врастание костной ткани. Хотя сроки наблюдения за больными не столь продолжительны как после цементной ревизионной артропластики, однако результаты операций лучше (в сравнении в одни и те же сроки) и это преимущество прогнозируется и на более длительное время. При выборе имплантатов для бесцементной фиксации необходимо помнить, что они подразделяются на ножки, рассчитанные на проксимальную и дистальную фиксацию. Неудовлетворительные результаты первых операций были связаны с тем, что при дефектах проксимального отдела бедренной кости применялись ножки, которые могли обеспечить остеоинтеграцию только в своей проксимальной части. Анализ осложнений привел к созданию так называемых полнопокрытых ревизионных ножек, рассчитанных на фиксацию на всем их протяжении, и прежде всего, в диафизарной части (Head W.C. с соавт., 1994, Mulliken B.D., Rorabeck C.H., Bourne R.B.: 1996, Peters C.L. с соавт., 1995).
Отдаленные результаты применения современных ревизионных ножек показали, что частота повторных операций колеблется между 1%-5% при средних сроках наблюдения 8 лет (Aribindi R., Barba M., Solomon M.I., Arp P., 1998; Engh C.A., Culpepper II W.J., Kassapidis E., 1998; Krishnamurthy A., MacDonald S., Paprosky W.G., 1997; Moreland J.R., Bernstein M.L., 1995 Paprosky W.G., Greidanus N.V., Antoniou J.., 1999). Для сравнения, частота ревизий при использовании имплантатов проксимальной фиксации составляет 42% (Mulliken B.D., Rorabeck C.H., Bourne R.B., 1996; Peters C.L., Rivero D.P., Kull L.R., 1995), что еще раз подчеркивает важность дистальной фиксации.
В последние годы в клиническую практику активно внедряются модульные ножки, предполагающие раздельную фиксацию диафизарной и метафизарной частей. Преимущество применения таких имплантатов заключается в возможности индивидуального раздельного подбора и установки диафизарной и проксимальной частей, каждая из которых может иметь несколько типов дизайна и размеров, что позволяет легко регулировать длину ножки, шейки, стабильность фиксации и антеверсию. Пористое покрытие протеза обеспечивает хорошую интеграцию костной ткани. Свободная ротация проксимальной части ножки обеспечивает выбор оптимального положения шейки протеза и этим значительно увеличивает стабильность эндопротеза. К недостаткам имплантатов этого типа необходимо отнести возможность подвижности и образования титановых микрочастиц на месте соединения дистальной и проксимальной частей эндопротеза. Наибольший срок клинических наблюдений имеют модульные эндопротезы системы S-ROM (DePuy, Warsaw, Indiana), которые начали использоваться с 1984 года. Как показали наблюдения, частота хороших результатов колеблется от 87 до 96% при сроках наблюдения до 4-6 лет (Cameron H.U., 1994; Chandler H. P. et al, 1995; Bono et al., 1999). Подобные системы ревизионных эндопротезов становятся все более и более популярными, существует несколько их разработок в исполнении различных фирм, в том числе модульный эндопротез системы ZMR фирмы Zimmer (рис.11.9).


а б
Рис.11.9. Рентгенограммы правого тазобедренного сустава б-го Б.83 лет с нестабильностью и переломом ножки эндопротеза, дистрофическими изменениями в вертлужной впадине (а). Ревизионное эндопротезирование с использованием расширенной остеотомии бедренной кости и установкой модульного эндопротеза ZMR (б).
В качестве иллюстрации приводим клинический пример применения ревизионной ножки бесцементной фиксации.
Б-й Б., 69 лет, в результате падения в 1994 году получил перелом шейки правой бедренной кости. Лечился консервативно, в связи с развитием ложного сустава шейки бедра в 1995 г выполнена операция: первичная артропластика тазобедренного сустава с установкой эндопротеза АРЕТЕ. Боль в области тазобедренного сустава появилась в 1997 году, а в результате падения на ногу на фоне остеолиза бедренной кости был выявлен патологический перелом бедра (рис. 11.10 а). Учитывая наличие перелома, изменения в костной ткани на большом протяжении, для ревизионной артропластики (22.04.98) была использована полнопокрытая ножка Solution 254 мм с изгибом в сагиттальной плоскости (диаметр ножки 16,5 мм). Кроме того, истонченные кортикальные стенки были укреплены кортикальными аллотрансплантатами (рис. 11.10 в,г). Выбор столь длинной ножки обусловлен тем, что зона остеолиза располагалась на протяжении всей ножки эндопротеза АРЕТЕ (а ее длина составляет 180 мм), и первичную дистальную фиксацию можно было обеспечить лишь за счет дополнительного удлинения имплантата. При выборе длинных ревизионных ножек (200 мм и более) нужно помнить о существовании реальной опасности перфорации кортикальной стенки (рис. 11.11 а,б,в).





а) б) в) г)
Рис. 11.10. Рентгенограммы правого тазобедренного сустава б-го Б., 69 лет: объяснения в тексте.



а б в
Рис. 11.11. Рентгенограммы правого тазобедренного сустава б-го Г., 67 лет: а,б) перфорация передней стенки бедренной кости при установке ревизионной ножки (длина 200 мм); в) место выхода ножки укреплено кортикальным аллокостным трансплантатом.
3. Ревизионная цементная артропластика бедренного компонента с применением импакции костной ткани. Эта техника ревизионной артропластики была разработана в Великобритании Gie G.A. в 1985 году как альтернатива цементной артропластике (по аналогии с костной пластикой вертлужной впадины). Спустя два года этот же хирург стал выполнять эту же операцию, но уже с применением костного цемента. В качестве имплантатов первоначально использовали ножку Exeter (двойной конус, полированная,
без воротничка), в настоящее время чаще применяется ножка СРТ, которая имеет похожий дизайн. Цель операции заключается в восстановлении костной основы бедренной кости (за счет плотного заполнения дефектов бедренной кости размельченной губчатой аллокостью) и прочной фиксации ножки эндопротеза с использованием костного цемента. К преимуществам оперативного вмешательства можно отнести формирование нового костномозгового канала с плотным заполнением всех полостей костной тканью. В некоторых случаях кортикальные стенки бедренной кости бывают настолько тонкими, что требуют предварительного укрепления кортикальными аллокостными трансплантатами. Техника операции заключается в следующем. После удаления нестабильной ножки эндопротеза, остатков костного цемента и грануляционной ткани, в канал бедренной кости устанавливают пробку и направляющий стержень, на который надевают гладкий шаблон эндопротеза. Этот шаблон полностью повторяет форму ножки, однако его размеры на 2 мм превышают размеры истинного имплантата (для создания цементной мантии). После правильной ориентации шаблона вокруг него укладывают и плотно забивают костную стружку. В качестве трансплантата предпочтительнее использовать аллокостную ткань головок бедра. Если имеется перфорация кортикальной стенки, предварительно вокруг бедренной кости укладывают кортикальные аллотрансплантаты и фиксируют серкляжными швами таким образом, чтобы укрепить кость и закрыть отверстие. Завершив импакцию костной ткани, шаблон удаляют, при помощи пистолета ретроградно вводят костный цемент и устанавливают оригинальную ножку эндопротеза. Технически сложным моментом операции является создание плотной импакции аллокостной ткани в дистальном отделе ножки и соблюдение правильной пространственной ориентации имплантата (J.L.Knight, C.Helming, 1999).
Теоретически, в случае успеха, происходит восстановление бедренной кости с ремоделированием кортикальных стенок. По данным различных авторов хорошие результаты операции достигнуты в 78-91% случаев (Elting et al., 1995; Meding et al., 1997; Knight, 1999, Ornstein et al., 2001), однако надо иметь в виду сравнительно небольшие сроки отдаленных наблюдений (13-32 месяца). При всей относительной простоте и привлекательности этой методики операции необходимо иметь в виду большое количество осложнений, возникающих в отдаленном периоде после операции. Наиболее типичным и частым является оседание ножки. Оседание происходит в основном на границе костного аллотрансплантата и цемента, частота смещения ножки вниз колеблется от 23 до 79%, большое оседание (более 10 мм) наблюдается в 10-15%. Степень оседания зависит от многих факторов. Происходит оно в первые 2 года после операции, небольшое смещение (5-8мм), как правило, не сопровождается болевым синдромом, тогда как смещение более 10 мм, приводит к развитию боли в бедре. Кроме того, наблюдается оседание ножки на границе цемент-имплант (в 10% случаев). Частота переломов бедренной кости колеблется от 5 до 24%, вывихов бедра - от 3 до 6%.
Учитывая достаточно большое число возможных осложнений, небольшой опыт проведения этих операций и малые сроки наблюдений, показаниями к костно-пластической реконструкции бедренной кости с использованием ножки цементной фиксации служат дефекты бедренной кости II типа у пациентов молодого возраста или большая зона поражения бедра, когда сложно выполнить другую операцию.
Алгоритм выбора способа ревизионной артропластики бедренного компонента. Выбор ножек в пользу бесцементной или цементной фиксации зависит от многих факторов, таких как возраст больного, функциональные запросы пациента, состояние костной ткани проксимального отдела бедренной кости. В целом, мы придерживаемся следующего правила, у молодых пациентов с высокими функциональными запросами предпочтительнее использовать ножки бесцементной фиксации, в то же время у пожилых больных с невысокими функциональными запросами и явлениями остеопороза – цементной фиксации.
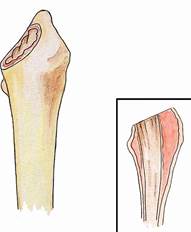
Важнейшим фактором, непосредственно определяющим выбор вида имплантата, является тип дефекта бедренной кости. При I типе с одинаковым успехом возможно применение ножки бесцементной фиксации с покрытием в проксимальном отделе и полным покрытием, а также ножки цементной фиксации. При этом типе дефекта можно применять такие же имплантаты, как и при первичной артропластике (рис. 11.12).
|
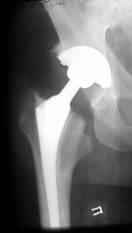


а) б) в) г)
Рис. 11.12. Схематическое изображение (а) дефекта проксимального отдела бедренной кости (тип 1) и рентгенограммы правого тазобедренного сустава б-го А, 51 года: б) первичная артропласика с установкой эндопротеза бесцементной фиксации; в) через 8 месяцев развилась глубокая перипротезная инфекция, выполнена санация очага воспаления с удалением имплантата и установкой «спейсера» из костного цемента с антибиотиком; г) через 4 месяца – удаление «спейсера» и устновка ревизионного эндопротеза
При II типе дефекта имеется недостаток губчатой костной ткани в проксимальном отделе бедренной кости, поэтому нецелесообразно применение ножки цементной фиксации, предпочтение также отдается ножкам бесцементной фиксации с полным пористым покрытием. Интактная диафизарная часть бедренной кости создает условия для прочной дистальной фиксации имплантата. На усмотрение хирурга, возможно применение техники импакции губчатой аллокостной ткани с установкой ножки на костный цемент (рис. 11.13).
|

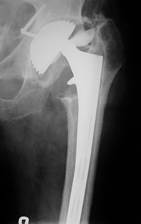

а) б) в)
Рис. 11.13. Схематическое изображение (а) дефекта проксимального отдела бедренной кости (тип 2) и рентгенограммы левого тазобедренного сустава б-го Ф., 50 лет: б) первичная артропласика с установкой эндопротеза бесцементной фиксации – нестабильность обоих компонентов с разрушением керамической головки; в) ревизионная артропластика: вертлужный компонент Duraloc с пластикой дефекта вертлужной впадины, бедренный компонент AML Solution с калькаром (J&J, DePuy) и укреплением внутренней стенки бедренной кости кортикальным аллотрансплантатом.
Существует несколько вариантов оперативного вмешательства при III типе дефекта бедренной кости, когда скомпрометирована и метаэпифизарная часть и диафиз бедренной кости вплоть до перфорации кортикальных стенок. В основе операции лежит применение длинных ревизионных ножек бесцементной фиксации с полным пористым покрытием. Длина имплантата должна быть такой, чтобы обеспечить плотную дистальную фиксацию в костном канале на протяжении 4-6 см. Как правило, длина ревизионных ножек составляет 200 и 256 см, при этом надо помнить об опасности перфорации передней стенки бедренной кости. Поэтому сверхдлинные протезы имеют изгиб в сагиттальной плоскости для профилактики выхода конца ножки за пределы кости и разделяются на “левые” и “правые”. Кроме того, при дефектах проксимального метаэпифиза целесообразно применять ножки со специальной площадкой (т.н. ножки с “калькаром”), указанный выступ не только компенсирует костный дефект, но и обеспечивает хорошую ротационную стабильность протеза. Имеющиеся полости в кости плотно заполняются губчатой аллокостной тканью, а при больших перфоративных дефектах кортикальных стенок целесообразно укрепить бедренную кость кортикальными аллокостными трансплантатами. При этом типе дефектов проксимального отдела бедренной кости возможно применение модульных ножек с раздельным подбором дистальной и проксимальной части (рис. 11.14).
|



а) б) в)
Рис. 11.14. Схематическое изображение (а) дефекта проксимального отдела бедренной кости (тип 3) и рентгенограммы правого тазобедренного сустава б-й К., 71 года: б) результаты третье операции по замене эндопротеза право тазобедренного сустава: нестабильность и перелом бедренного компонента; в) ревизионная артропластика: модульный бедренный компонент ZMR (Zimmer, Warsaw) доступ с расширенной остеотомией проксимального отдела бедра и костной пластикой дефекта костной ткани.
Дефект IY типа представляет наибольшие трудности для лечения, т.к. характеризуется сегментарным дефектом всего проксимального отдела бедренной кости. Основная задача хирурга – добиться прочной фиксации ножки в дистальном отделе на протяжении 4-6 см. Применение имплантата бесцементной фиксации возможно в том случае, если сохранена кортикальная трубка на уровне перешейка бедренной кости. Если же дефект кости распространяется дистальнее (там, где начинается расширение костного канала кости) и добиться первичной стабильной фиксации не удается, целесообразно использовать длинные ревизионные ножки цементной фиксации (цементируют дистальный отдел бедренной кости). Дефект проксимального отдела бедра восстанавливают массивным аллокостным трансплантатом, который фиксируют на проксимальной части ножки при помощи костного цемента (не зависимо от типа протеза). Место контакта массивного трансплантата и дистальной части бедренной кости дополнительно укрепляют кортикальными аллотрансплантатами (рис. 11.15.).
|

а) б)



в) г) д)
Рис. 11.15. Схематическое изображение (а) дефекта проксимального отдела бедренной кости (тип 4) и рентгенограммы правого тазобедренного сустава б-й Г., 63 лет: б) первичная артропласика с установкой однополюсного эндопротеза; в,г) ревизионная артропластика: вертлужный компонент Duraloc (J&J, DePuy), бедренный компонент AML Solution (J&J, DePuy) длиной 254 см, укрепление стенок бедренной кости кортикальными аллотрансплантатами, д) через год после операции – положение эндопротеза стабильное
Справочная информация
1. Аль-Танани, А.С. Эндопротезирование тазобедренного сустава с применением укрепляющих колец при заболеваниях и повреждениях вертлужной впадины / А.С. Танани, Н.В. Загородний, Ю.О. Кузьмина // Современные технологии в травматологии и ортопедии : сб. тез. всерос. науч.-практ. конф. – М., 2005. – С. 9.
2. Волокитина, Е.А. Причины раннего ревизионного эндопротезирования тазобедренного сустава / Е.А. Волокитина, И.А. Атаманский, А.Е.-Х. Югай, А.В. Каминский // Эндопротезирование в России : всерос. сб. науч. статей. – Казань ; СПб., 2005. – Вып. 1. – С. 247–252.
3. Денисов - Никольский, Ю.Н. Актуальные проблемы теоретической и клинической остеологии / Ю.Н. Денисов - Никольский, С.П. Миронов, Н.П. Омельяненко, И.В. Матвейчук // Методические рекомендации для врачей. –М., 2005. –С. 335.
4. Донченко, С.В. Ревизионное эндопротезирование тазобедренного сустава / С.В. Донченко, В.В. Кузин, В.Ю. Мурылев, М.Ю. Холодаев // Современные технологии в травматологии и ортопедии : сб. тез. всерос. науч.-практ. конф. – М., 2005. – С. 122–124.
5. Каграманов, С.В. Ревизионное эндопротезирование тазобедренного сустава / С.М. Каграманов, В.И. Нуждин // XIII научно-практическая конференция SICOT : тез. докл. – СПб., 2002. – С. 54–55.
6. Надеев А.А.,Иванников С.В. Эндопротезы тазобедренного сустава в России. –М.:БИНОМ. Лаборатория знаний.-2006. -177 с.ил.
7. Неверов В.А., Закари С.М. Ревизионное эндопротезирование тазобедренного сустава - СПб.: Образование.-1997. – 112 с.
8. Тихилов Р.М. Ревизионная артропластика при асептической нестабильности вертлужного компонента тотального эндопротеза тазобедренного сустава с использованием костной пластики и имплантатов бесцементной фиксации. Р.М. Тихилов, А.В. Цыбин, В.С. Сивков, М.Ю. Гончаров, А.В. Сементковский, Р.В. Малыгин. Травматология и ортопедия России – 2006 -№ 2 – С. 294-295.
9. Тихилов Р.М. Сравнительная характеристика различных методик ревизионной артропластики при асептической нестабильности вертлужного компонента эндопротеза тазобедренного сустава. Р.М Тихилов, В.М. Машков, А.В. Цыбин, В.С. Сивков, М.Ю.Гончаров, А.В. Сементковский, Р.В. Малыгин. -Травматология и ортопедия России – 2007 – №1 – С. 5-11.
10. Цыбин А.В. Ревизионная артропластика при асептической нестабильности вертлужного компонента тотального эндопротеза тазобедренного сустава : Диссертация конд. мед. наук: 14.00.22. – Санкт-Петербург – 2007 - С. 3-10.
11. Allen, P.W. Results of impaction grafting in revision hip arthroplasty at two to seven years using fresh and irradiated allograft bone / P.W. Allen, C.H. Aldam // Hip. – 2003. – Vol. 13. – P. 1–11.
12. Amstutz H.C., Ma S.M., Jinnah R.H., Mai L. Revision of aseptic loose total hip arthroplasties // Clin. Orthop. 170: 21-33, 1982.
13. Aribindi R, Barba M, Solomon MI, Arp P, Paprosky WG: Bypass fixation. Orthop Clin North Am 29:319-329, 1998.
14. Avci S., Connors N., Petty W. 2- to 10-year follow-up study of acetabular revisions using allograft bone to repair bone defects // J Arthroplasty 1998.-Vol.13.-N1.-P.61-69.
15. Bohm P; Bischel O Femoral revision with the Wagner SL revision stem : evaluation of one hundred and twenty-nine revisions followed for a mean of 4.8 years // J Bone Joint Surg 2001 Jul;83-A(7):1023-31
16. Boldt, J.G. Revision total hip arthroplasty using impaction bone grafting with cemented nonpolished stems and Charnley cups / J.G. Boldt, P. Dilawari, S. Agarwal, K.J. Drabu // J. Arthroplasty. – 2001. – Vol.16. – P. 943–952.
17. Bono JV, McCarthy JC, Lee J-A, et al Fixation with a modular stem in revision total hip arthroplasty // J Bone Joint Surg 1999;81-A, N9 P.1326-1334.
18. Bradford M.S., Paprosky W.G. Acetabular defect classification: a detailed radiographic approach // Seminars in Arthroplasty, Vol.6, N2.-1995.-P.76-85.
19. Callagan J.J., Salvati E.A., Pellicci P.M., et al. Results of revision for mechanical failure after cemented total hip replacement // J Bone Joint Surg [Am] 1985; 67-A, N89 P.1074-1085.
20. Callaghan, J.J. Charnley total hip arthroplasty with cement. Minimum twenty-five-year follow-up / J.J. Callaghan, J.C. Albright, O.D. Goetz, R.C. Johnston // J. Bone Joint Surg. – 2000. – Vol. 82-A. – P. 487–497.
21. Cameron, H. U.: The two- to six-year results with a proximally modular noncemented total hip replacement used in hip revisions. Clin. Orthop., 298: 47-53, 1994
22. Chandler, H. P.; Ayres, D. K.; Tan, R. C.; Anderson, L. C.; and Varma, A. K.:Revision total hip replacement using the S-ROM femoral component. Clin. Orthop., 319:130-140, 1995
23. Dearbon JT, Harris WH Acetabular revision arthroplasty using so-called Jumbo cementless components. An average 7-years follow-up study // J.of Arthroplasty.- 2000.-Vol.15.-N1.-P.8-15.
24. Dearborn, J.T. High placement of an acetabular component inserted without cement in a revision total hip arthroplasty. Results after a mean of ten years / J.T. Dearborn, W.H. Harris // J. Bone Joint Surg. – 1999 – Vol. 81-A. – P. 469.
25. DeLee, J.G. Radiological demarcation of cemented sockets in total hip replacement / J.G. DeLee, J. Charnley // Clin. Orthop. – 1976. – N 121. – P. 20–32.
26. Dohmae Y, Bechtold JE, Sherman RE, et al: Reduction of cement-bone interface shear strength between primary and revision arthroplasty. Clin Orthop 236:214-220, 1988.
27. Dorr LD, Wan Z. Ten years of experience with porous acetabular components for revision surgery // Clin Orthop 319:191-200, 1995.
28. Elting JJ, Zicat BA, Mikhail WE, et al. Impaction grafting: preliminary report of a new method for exchange femoral arthroplasty // Orthopaedics 1995.- Vol.18.-P.107-110.
29. Engh CA, Culpepper II WJ, Kassapidis E: Revision of loose cementless femoral prostheses to larger porous coated components. Clin Orthop 347:168-178, 1998.
30. Estok DM, Harris WH: Long term results of cemented femoral revision using second generation techniques. An average 11 year follow-up evaluation. Clin Orthop 299:190-202, 1994
31. Fender D., Harper W.M., Paul J. Gregg The results at five years from a regional hip register // J Bone Joint Surg [Br] 1999;81-B:577-81.
32. Goldberg, V.M. Selection of bone grafts for revision total hip arthroplasty / V.M. Goldberg // Clin. Orthop. – 2000. – N 381. – P. 68–76.
33. Head WC, Wagner RA, Emerson Jr RH, et al: Revision total hip arthroplasty in the deficient femur with a proximal load bearing prosthesis. Clin Orthop 298:119-126, 1994
34. Harris WH.: An integrated solution to acetabular revision surgery. Clin Orthop Relat Res. 2006 Dec;453:178-82.
35. Isacson J, Stark A, Wallensten R The Wagner revision prosthesis consistently restores femoral bone structure // Int Orthop 2000;24(3):139-42.
36. Katz RP, Callaghan JJ, Sullivan PM, et al: Results of cemented femoral revision total hip arthroplasty using improved cementing techniques. Clin Orthop 319:178-183, 1995
37. Kavanagh BF, Ilstrup DM, Fitzgerald Jr RH, et al: Revision total hip arthroplasty. J Bone Joint Surg 67A:517-526, 1989.
38. Kligman, M. Cortical and cancellous morselized allograft in revision total hip replacement / M. Kligman, V. Con, M. Roffman // Clin. Orthop. – 2002. – N 401. – P. 139–148.
39. Knight J.L., Helming C. Collarless polished tapered impaction grafting of the femur during revision total hip arthroplasty. Pitfalls of surgical technique and follow-up in 31 cases. J Arthroplasty 1999, Vol.15, N2, P.159-165.
40. Kolstad K., Adalberth G., Mallmin H. The Wagner revision stem for sever osteolysis. 31 Hip followed for 1,5-5 years // Acta Orthop. Scand. 1996.-Vol 67,№ 6.-P.541-544.
41. Krishnamurthy A, MacDonald S, Paprosky WG: Five to 13-year follow up on cementless femoral components in revision surgery. J Arthroplasty 12:839-847, 1997.
42. Lee B.P., Cabanela M.E., Wallrichs S.L. et al. Bone-graft augmentation for acetabular deficiencies in total hip arthroplasty // J. Arthroplasty 1997.-Vol.12.-N5.- P.503-510.
43. Leopold SS., Rosenberg AG, Bhatt RD, et al. Cementless acetabular revision. Evaluation at an average of 10,5 years // CORR 1999, N369.-P.179-186.
44. Lieberman JR, Moekel BH, Evans BG, et al: Cement-within-cement revision hip arthroplasty. J Bone Joint Surg 75B:869-871, 1993. <!--plsfield:MISC-->
45. Malhau H., Herberts P. Prognosis of total hip replacement. Revision and re-revision rate in THR: a revision risk study of 148.359 primary operations. Scientific Exhibition, 65th AAOS Meeting, Feb.19-23, New Orleans, USA.
46. Malchau H, Herberts P, Eisler T, Garellick G, Söderman P.: The Swedish Total Hip Replacement Register. J Bone Joint Surg Am. 2002;84-A Suppl 2:2-20.
47. Mallory T.H. Preparation of the proximal femur in cementless total hip revision. Clin Orthop Relat Res. 1988 Oct;(235):47-60.
48. Maurer TB, Ochsner PE, Schwarzer G Increased loosening of cemented straight stem prostheses made from titanium alloys. An analysis and comparison with prostheses made of cobalt-chromium-nickel alloy // Int Orthop 2001;25(2):77-80
49. Meding J.B., Ritter M.A., Keating E.M., Faris P.M. Impaction bone-grafting before insertion og a femoral stem with cement in revision total hip arthroplasty: a minimum two-year follow-up study // J. Bone Joint Surg.-1997.-Vol 79A.-P.1834-1838.
50. Moreland JR, Bernstein ML: Femoral revision hip arthroplasty with uncemented, porous-coated stems. Clin Orthop 319:141-150, 1995.
51. Morrey BF, Kavanagh BF: Complications with revision of the femoral component of total hip arthroplasty. Comparison between cemented and uncemented techniques. J Arthroplasty 7:71-79, 1992
52. Mulliken BD, Rorabeck CH, Bourne RB: Uncemented revision total hip arthroplasty: A 4-to-6 year review. Clin Orthop 325:156-162, 1996.
53. Ornstein E., Atroshi I., Franzin H., et al. Results of hip revision using the Exeter stem, impacted allograft bone, and cement Clin. Orthop 2001; Vol.2001(389), P.126-133.
54. Paprosky W.G., Lawrence J., Cameron H.U. Classification and treatment of the failed acetabulum: A systematic approach // Contemp. Orthop. 1991.-Vol.2.- P.121-129.
55. Paprosky WG, Greidanus NV, Antoniou J. Minimum 10-Year-Result of extensively porous-coated stems in revision hip arthroplasty: Clin Orthop 369:230-242, 1999.
56. Pellicci PM.: Results of revision total hip replacement. Instr Course Lect. 1986;35:150-1.
57. Pellicci PM, Wilson PD Jr, Sledge CB, Salvati EA, Ranawat CS, Poss R, Callaghan JJ.: Long-term results of revision total hip replacement. A follow-up report. J Bone Joint Surg Am. 1985 Apr;67(4):513-6.
58. Peters CL, Rivero DP, Kull LR, et al: Revision total hip arthroplasty without cement: Subsidence of proximally porous coated femoral components. J Bone Joint Surg 77A:1217-1226, 1995.
59. Pierson JL, Harris WH: Effect of improved cementing techniques in the longevity of fixation in revision cemented femoral arthroplasties. Average 8.8-year follow-up period. J Arthroplasty 105:581-591, 1995
60. Ranawat CS, Deshmokh RG, Peters LE, Umlas ME. Prediction of the long-term durability of all-polyethylene cemented sockets // Clin Orthop. 1995.-Vol.317.-P.89-105.
61. Safdar, N. Kban. The biology of bone grafting / N. Kban. Safdar // J. Am. Acad. Orthop. Surg. – 2005. – Vol. 13, N 1. – P. P 77–86.
62. Schatzker J., Wong M.K. Acetabular revision. The role of rings and cages // Clin Orthop. 1999.-Vol.369.-P.187-197.
63. Stromberg CN, Herberts P, Palmertz B: Cemented revision hip arthroplasty: A multicenter 5-9 year study of 204 first revisions for loosening. Acta Orthop Scand 63:111-119, 1992.
64. Templeton, J.E. Revision of a cemented acetabular component to a cementless acetabular component. A ten to fourteen-year follow-up study / J.E. Templeton [et al.] // J. Bone Joint Surg. – 2001. – Vol. 83-A. – P. 1706–1711.
65. Ullmark, G. Bigger size and defatting of bone chips will increase cup stability / G. Ullmark // Arch. Orthop. Trauma Surg. – 2000. – Vol. 120. – P. 445–447.
66. Whaley, A.L. Extra-large uncemented hemispherical acetabular components for revision total hip arthroplasty / A.L. Whaley, D.J. Berry, W.S. Harmsen // J. Bone Joint Surg. – 001. – Vol. 83-A. – P. 1352–1357.
Дата добавления: 2019-07-15; просмотров: 276; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
