ИК-СПЕКТРОСКОПИЯ (или КОЛЕБАТЕЛЬНАЯ СПЕКТРОСКОПИЯ)
СПЕКТРОСКОПИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
СПЕКТРОСКОПИЧЕСКИЕ МЕТОДЫ
Классификация спектроскопических методов анализа
К спектроскопическим методам анализа относят методы, основанные на взаимодействии вещества с электромагнитным излучением.
К настоящему времени разработано несколько десятков различных спектроскопических методов анализа. Их классифицируют по трем основным признакам.
По типу частиц, взаимодействующих с излучением, различают методы атомной и молекулярной спектроскопии. В методах первой группы с излучением взаимодействуют отдельные атомы (или одноатомные ионы) независимо друг от друга. Такие методы позволяют определить лишь элементный состав вещества. В методах второй группы с излучением взаимодействуют многоатомные частицы (молекулы, многоатомные ионы) как единое целое. С помощью молекулярных методов возможно определение молекулярного состава вещества, изучение характера химических связей.
По диапазону электромагнитного спектра, к которому относится излучение, взаимодействующее с веществом, различают спектроскопию в видимой, ультрафиолетовой, инфракрасной, микроволновой и рентгеновской областях.
По физическому характеру процесса взаимодействия излучения с веществом различают эмиссионные, абсорбционные и другие методы. Методы анализа, основанные на испускании излучения, называются эмиссионными, а на его поглощении — абсорбционными.
|
|
|
МОЛЕКУЛЯРНАЯ СПЕКТРОСКОПИЯ
СПЕКТРОФОТОМЕТРИЯ
Метод основан на поглощении излучения видимой, ближней УФ или ближней ИК части спектра молекулами вещества, как правило, находящимися в растворе. Спектрофотометрия позволяет определять окрашенные неорганические и органические вещества на уровне концентраций 10-5-10-6 моль/л и выше. Можно определять и неокрашенные соединения, но в этом случае к ним необходимо добавить реагенты для образования окрашенных продуктов. В основе метода лежит закон Бугера-Ламберта-Бера. Рассмотрим его сущность. Возьмем кювету с окрашенным раствором. Направим на нее монохороматическое излучение с длиной волны l и интенсивностью Io. После прохождения излучения через кювету его интенсивность уменьшится до I. Закон Бугера-Ламберта-Бера связывает интенсивность излучения после выхода из кюветы с толщиной поглощающего слоя, равного толщине кюветы, концентрацией поглощающих частиц и интенсивностью падающего монохроматического излучения.
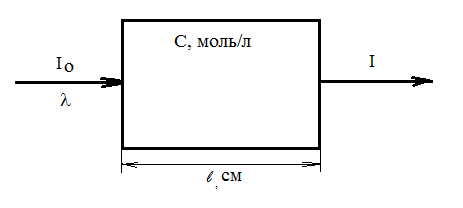
Закон Бугера-Ламберта-Бера в исходной форме можно записать в следующем виде:
I = Io×10-elc,
где Io – интенсивность падающего на кювету монохроматического излучения, I – интенсивность прошедшего через кювету монохроматического излучения, l – толщина поглощающего слоя, см; с – концентрация поглощающего вещества, моль/л; e - молярный коэффициент светопоглощения, размерность л/(моль×см). e зависит от природы поглощающего вещества и от длины волны.
|
|
|
В аналитической химии для анализа стараются использовать прямолинейные зависимости. Поэтому закон Бугера-Ламберта-Бера преобразовывают в следующую форму:
А = elc,
где А – это оптическая плотность раствора. Именно эту величину измеряет прибор – спектрофотометр.
А = lg Io/I
Если раствор не поглощает падающее излучение при длине волны l, то I = Io и оптическая плотность А = lg Io/Iо = 0.
Если раствор поглощает все падающее излучение при длине волны l, то I = 0 и оптическая плотность А = lg Io/0 = ¥.
Таким образом, оптическая плотность теоретически изменяется от 0 до бесконечности. На практике работают в области оптических плотностей от 0.15 до 1.4. Именно эти оптические плотности прибор способен измерить с погрешностью не более 5%.
Из закона Бугера-Ламберта-Бера видно, что зависимость А от с линейна:
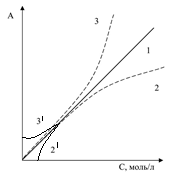
Рис. Связь между оптической плотностью и концентрацией светопоглощающих частиц.
На практике возможно отклонение этой зависимости от линейной, как в большую сторону (положительное отклонение, случай 3 и 3’), так и в меньшую сторону (отрицательное отклонение, случай 2 и 2’), как в области больших (случаи 2 и 3), так и в области малых (случаи 2’ и 3’) концентраций. Эти отклонения вызваны физическими и химическими причинами, приводящими к изменению e.
|
|
|
Для анализа используют линейный участок. Широко применяют метод градуировочного графика. В этом случае перед анализом готовят серию стандартных растворов с известным содержанием определяемого компонента, добавляют все необходимые реагенты и измеряют оптическую плотность в каждом из полученных растворов. На основании экспериментальных данных строят зависимость А от С.
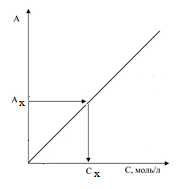
Затем к анализируемому раствору прибавляют все необходимые реагенты и измеряют оптическую плотность Ах. Используя эту величину далее по градуировочному графику определяют концентрацию определяемого вещества в анализируемом растворе Сх.
Все измерения проводят при определенной длине волны. Эту длину волны устанавливают предварительно. Для этого перед проведением анализа изучают зависимость А или e от l. Эта зависимость получила название спектра поглощения, она имеет следующий вид:
|
|
|
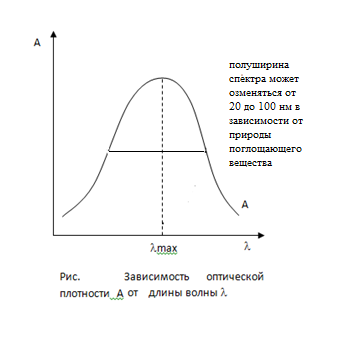
Для анализа выбирают длину волны lmax, соответствующую максимальному поглощению, так как она обеспечивает наибольшую чувствительность.
Для анализа кроме прямого метода (метода градуировочного графика) используют косвенный метод – метод спектрофотометрического титрования. В этом случае к аликвоте анализируемого раствора небольшими порциями приливают стандартный раствор титранта. После добавления каждой порции титранта и перемешивания раствора измеряют оптическую плотность. По результатам титрования строят зависимость оптической плотности А от объема титранта V. Для титрования можно использовать только такую реакцию, в которой хотя бы один из участников реакции окрашен. Окрашенным может быть исходное вещество М, продукт MR или титрант R. Вид кривой титрования зависит от того, какое вещество окрашено. Допустим, что в основе титрования лежит следующая реакция:
М + R = MR
(М – исходное определяемое вещество, R – титрант, MR – продукт).
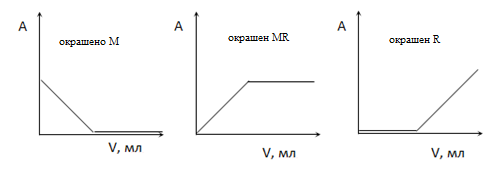
По пересечению линейных участков кривой титрования находят точку эквивалентности, а затем рассчитывают концентрацию определяемого вещества по основному уравнению титрования.
Сравнение метода градуировочного графика и спектрофотометрического титрования.
1. По чувствительности. Более чувствительным является метод градуировочного графика, так как для анализа достаточно даже маленькое значение оптической плотности.
2. По точности. Более точным является метод спектрофотометрического титрования, так как объем раствора можно измерить точнее, чем оптическую плотность.
3. По селективности. Более селективным является метод спектрофотометрического титрования, поскольку селективность можно повысить выбором подходящего титранта.
Оптическую плотность измеряют с использованием специальных приборов – спектрофотометров. Блок-схема спектрофотометра представлена ниже.

В качестве источника видимого излучения выступает лампа накаливания с вольфрамовой нитью. Она дает сплошной спектр в видимой части спектра. Для того чтобы выделить монохроматическое излучение с определенной длиной волны используется монохроматор. Он состоит из диспергирующего устройства и щели. Диспергирующее устройство, в качестве которого чаще используют дифракционную решетку или призму, раскладывает полихроматическое излучение в спектр. Щель позволяет выделить узкую полосу монохроматического излучения с погрешностью ±0.1 нм. Например, (620.0±0.1) нм. Это излучение является монохроматическим для спектров поглощения молекулярных веществ, ширина которых может изменяться в интервале 20-100 нм. Кювету изготавливают из полированного стекла или кварца. В качестве детектора используют фотоэлементы. Это устройства, которые преобразуют световую энергию в электрическую.
ИК-СПЕКТРОСКОПИЯ (или КОЛЕБАТЕЛЬНАЯ СПЕКТРОСКОПИЯ)
Метод основан на поглощении излучения фундаментальной инфракрасной области спектра определяемым веществом. ИК-спектроскопия широко используется для идентификации органических веществ. Может быть использована и для анализа неорганических объектов. В основе лежит закон Бугера-Ламберта-Бера, однако, для количественного анализа метод используется редко.
 Результатом эксперимента в ИК-спектроскопии является зависимость светопропускания Т от волнового числа n (черточка сверху). Светопропускание определяется соотношением Т = I/Io. Волновое число – это величина обратная длине волны n = 1/l, в ИК-спектроскопии ее размерность принято выражать в см-1. Измерения проводят в интервале волновых чисел 400-4000 см-1 или 200-4000 см-1 в зависимости от типа спектрометра.
Результатом эксперимента в ИК-спектроскопии является зависимость светопропускания Т от волнового числа n (черточка сверху). Светопропускание определяется соотношением Т = I/Io. Волновое число – это величина обратная длине волны n = 1/l, в ИК-спектроскопии ее размерность принято выражать в см-1. Измерения проводят в интервале волновых чисел 400-4000 см-1 или 200-4000 см-1 в зависимости от типа спектрометра.
Для каждого соединения ИК-спектр уникален. Идентификацию вещества проводят сравнивая ИК-спектр образца с ИК-спектром эталона. Последний можно получить экспериментально, а можно позаимствовать в базе данных. При анализе сложных смесей идентифицировать все вещества зачастую не удается. В этом случае можно ограничиться функциональным анализом, то есть установить какие функциональные группы входят в состав компонентов смеси. Так можно идентифицировать такие группы, как –ОН, -СООН, -С(О)-, -С=С- и целый ряд других. Идентификация основана на том, что соединения с одинаковыми функциональными группы имеют полосы поглощения при близких волновых числах, которые получили названия характеристических частот. Например, полоса поглощения карбонильной группы С=О в альдегидах и кетонах наблюдается в интервале 1710-1750 см-1 независимо от заместителей
R-C(O)-R.
АТОМНАЯ СПЕКТРОСКОПИЯ
В этом разделе рассмотрим два метода – атомно-адсорбционный метод и атомно-эмиссионный метод. Оба метода позволяют проводить элементный анализ.
Дата добавления: 2019-07-15; просмотров: 534; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
