Галогены обладают высокой реакционной способностью, поэтому встречаются только в связанном виде, т.е. в виде соединений.
Наиболее важным источником фтора является флюорит (другое название – плавиковый шпат). Другие известные минералы – криолит Na3AlF6 и фторапатит Ca5(PO4)3F – промышленного значения для получения фтора не имеют.
Промышленное значения имеют такие соединения хлора, как галит (другое название – каменная соль), а также сильвин и сильвинит. Крупные пласты NaCl найдены в местах высохших древних морей. Современные моря содержат примерно 1,9% хлорид-ионов из 3,4% солености, однако существуют соленые озера с более высокой концентрацией. Большое Соленое озеро 23% NaCl (Юта, США), Мёртвое море (8% NaCl, 13% MgCl2, 3,5% CaCl2).

| 
| 
| 
|
| Флюорит CaF2 | Галит NaCl | Сильвин KCl | Сильвинит KCl·NaCl |
Напротив, бром и иод собственных минералов практически не образуют и находятся в рассеянном состоянии. Вследствие хорошей бромидов и иодидов, эти элементы в заметных количествах содержатся в морской воде 6·10-3 % (Br) или накапливаются живущими в море организмами (I , до 0,45% сухой массы).
Месторождения иодидных (иодид серебра) и иодатных (иодат кальция, иодат калия) руд известны, но они очень редки. В настоящее время иод получают из природных подземных соленых вод.
Получение
Выделение галогенов из природного сырья основано на следующих реакциях.
Очевидно, что единственный приемлемый метод получения фтора, что в промышленности, что в лаборатории – электролиз.
При обработке флюорита кальция концентрированной серной кислотой образуется газообразный фтороводород.
|
|
|
CaF2 (тв.) + H2SO4 (конц.) = CaSO4 (тв.) + 2 HF↑
Непосредственно фтор получают электролизом гидрофторида калия KF·HF – раствора фторида калия в безводном фтороводороде. Как правило, компоненты берут в соотношении 1 : 3 и электролиз проводят не до конца, а лишь до момента расходования некоторого количества фтороводорода.
KF·3HF " KF·HF + H2↑ + F2↑ (электролиз)
Материал электролизера – нержавеющая сталь, с разделенным анодным и катодным пространством. Нержавеющая сталь, конечно, реагирует со фтором, однако лишь в поверхностном слое, который затем предохраняет стенки реактора от разрушения, т.е. происходит пассивация.
В 1986 году, когда праздновали 100-летие препаративного получения фтора Анри Муассаном (электролиз фтороводорода в U-образной трубке с платиновыми электродами, отверстия которой были закрыты пробками из флюорита со смазкой оксида свинца), была обнаружена химическая реакция, в результате которой выделяется газообразный фтор. Таким образом, была показана возможность химического получения фтора, однако данный процесс имеет исключительно теоретическое, а не практическое значение.
В случае хлора между промышленными и лабораторными методами получения существуют различия.
|
|
|
В основе промышленного метода лежат доступное сырье невысокой стоимости (подразумевается, имеющееся в распоряжении в больших количествах, пусть даже не очень высокого качества), многотоннажные объемы производства, дешевая энергия, утилизация или переработка отходов.
Одним из наиболее распространенных способов получения хлора является электролиз водных растворов хлоридов металлов. Особенностью процесса является наличие диафрагмы, разделяющей катодное и анодное пространство и проточный характер реактора (от анода к катоду), с тем чтобы избежать смешения продуктов электролиза. В отсутствии диафрагмы выделяющийся на аноде хлор реагирует с гидроксидом натрия, образовавшемся в катодном пространстве.
2 NaCl + 2 HOH " 2 NaOH + H2↑ + Cl2↑ (электролиз)
Из истории. Ранее хлор в промышленности получали посредством окисления. Так, в 1867 году было предложен процесс окисления хлороводорода кислородом воздуха:
2 HCl + O2 " H2O + Cl2.
Данный процесс имеет практическое значение для очистки производственных газов от хлороводорода.
Таким образом, в простейшем случае в лаборатории может быть установлен баллон с хлором. Если такого источника хлора нет, его получают окислением хлороводородной кислоты и её солей.
|
|
|
2 KMnO4 (тв.) + 16 HCl (конц.) = 3 Cl2# + 2 KCl + 2 MnCl2 + H2O.
MnO2 (тв.) + 4 HCl (конц.) = Cl2# + MnCl2 + 2 H2O.
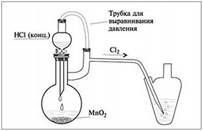
| Установка для получения хлора в лаборатории: к твердому окислителю (KMnO4 или MnO2) из капельной воронки с компенсатором давления осторожно по каплям прибавляют концентрированную соляную кислоту. Хлор выделяется в виде тяжелых, зеленых паров, которые по трубке поступают в приемник (или в реакционную смесь). |
В промышленности иод и бром получают окислением водных растворов их бескислородных солей, в качестве окислителя чаще всего используется хлор по причине низкой стоимости, высокой реакционной способности, простоте утилизации продуктов реакции (хлоридов).
2Hal- + Cl2 = Hal2 + 2Cl- , Hal = Br, I.
В лаборатории методы получения иода и бром также основаны на реакциях окисления галогенидов. Например, бром получают окислением бромида калия дихроматом калия в кислой среде или броматом калия в кислой среде, выделяющийся бром отгоняют.[1]
6 KBr + K2Cr2O7 + 7 H2SO4 = 3 Br2 + 4 K2SO4 + Cr2(SO4)3 + 7 H2O.
5 KBr + KBrO3 + 3 H2SO4 = 3 Br2 + 3 K2SO4 + 3 H2O.
При этом иодид-ион превращается в иод даже под действием относительно слабых окислителей, например, катионов Cu2+, Fe3+, вследствие чего получить иодиды меди(II) и железа(III) традиционными способами невозможно.
|
|
|
4 KI + 2 CuSO4 = 2 K2SO4 + I2 + 2 CuI.
2 Cu2+ + 4 I- = 2 CuI$ + I2; 2 Fe3+ + 6 I- = 2 FeI2 + I2.
Иодаты, например, иодат натрия, восстанавливают гидросульфитом, а затем образовавшийся раствор иодида окисляют иодатом.
Дата добавления: 2019-03-09; просмотров: 204; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
