Задание для самостоятельной работы.
При выполнении самостоятельной работы необходимо полностью приводить обоснования правильности выбора номера верного ответа (посмотрите примеры решения теста выше).
1) Согласно уравнению Нернста потенциал электрода…
1) Зависит от его массы
2) Зависит от его природы
3) Не зависит от температуры
4) Не зависит от концентрации электролита
ЭДС гальванического элемента, состоящего из медного и цинкового электродов, погруженных в 0,01 М растворы их сульфатов
(Е0Сu2+/Cu=0,34B, Е0Zn2+/Zn=-0,76B) равна___ В.
1) 1,10
2) 0,70
3) 0.28
4) 0,43
3) Если при электролизе водного раствора соли значение рН в катодном пространстве возросло, то электролизу подвергался раствор…
1) Cu(NO3)2
2) KCl
3) CuCl2
4) ZnCl2
4) В гальваническом элементе, состоящем из никелевого  и железного
и железного  электродов, погруженных в 1 М растворы их солей, на аноде протекает процесс …
электродов, погруженных в 1 М растворы их солей, на аноде протекает процесс …
1) 
2) 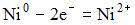
3) 
4) 
5) Сумма коэффициентов в суммарном уравнении процесса электролиза водного раствора AgNO3 равна…
1) 11
2) 15
3) 3
4) 7
При электролизе раствора хлорида меди (II) на катоде выделилось 2,7 г меди. Объем газа (н.у.), выделившегося на аноде равен _______ л.
1) 4,48
2) 8,96
3) 2,24
4) 6,72
7) Сумма коэффициентов в левой части уравнения реакции KMnO4 + Na2SO3 + H2SO4 ®… составляет…
1) 6
2) 8
3) 12
4) 10
8) При прохождении через раствор нитрата серебра количества электричества величиной 48250Кл на катоде образуется ___граммов чистого серебра (F=96500Кл/моль).
|
|
|
1) 27
2) 54
3) 18
4) 108
9) Коэффициент перед молекулой восстановителя в уравнении реакции KMnO4 + Na2SO3 + H2SO4 = MnSO4 + Na2SO4 + K2SO4 + H2O равен.
1) 5
2) 3
3) 2
4) 1
10) Если гальванический элемент составлен из двух серебряных электродов, один из которых стандартный, то для достижения наибольшего ЭДС другой электрод следует погрузить в раствор AgNO3 c концентрацией
1) 0,5 М
2) 0,2 М
3) 0,4 М
4) 0,1 М
11) ЭДС гальванического элемента состоящего из железного и серебрянного электродов, погруженных в 0,1 М растворы их нитратов Е0(Fe+2/ Fe)= -0,44 В, Е0(Ag+/ Ag)= 0,80 В, равна_______В.
1) 1,21
2) 1,24
3)– 1,21
4)– 1,24
12) Для получения 54 г серебра электролизом водного раствора нитрата серебра (выход по току 100%), необходимо чтобы в растворе содержалось___граммов чистой соли
1) 255
2) 85
3) 340
4) 170
При электролизе воды на аноде выделилось 11,2 л (н.у.) кислорода. Объем водорода, выделившегося на катоде равен ____ л (н.у.)
1) 22.4
2) 5.6
3) 44.8
4) 11.2
15) Если гальванический элемент составлен из двух электродов, один из которых стандартный цинковый электрод Е0 = -0,76В, то для достижения наибольшего значения Э.Д.С. другим электродом должен быть стандартный
1) медный Е0=+0,34 В
2) серебряный Е=+0,8 В
|
|
|
3)свинцовый Е=-0,13 В
4) водородный
15) Максимальное значение ЭДС (при одинаковых концентрациях солей) будет у гальванического элемента Ме|Me(NO3)2||Cu(NO3)2|Cu, если стандартный потенциал второго металла равен ___В.
1) – 0,76
2) – 2,36
3) + 1,19
4) +1,50
ЛИТЕРАТУРА
Основная литература
1. Общая химия. Биофизическая химия. Химия биогенных элементов. Учебник для медицинских вузов. (Ю.А. Ершов, В.А. Попков, А.С. Берлянд и др. Ред. Ю.А. Ершов.), 8 изд., 560 с. – М,; Высшая школа, 2010г. (раздел «Электрохимия)
2. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов. Учебное пособие для студентов медицинских вузов (Ред. В.А. Попков). – М., Высшая школа, 4изд., 239 с., 2008 г.
3. Сборник задач и упражнений по общей химии. Учебное пособие. (С.А. Пузаков, В.А. Попков, А.А. Филиппова). М., Высшая школа, 4 изд., 225 с., 2010 г.
Дополнительная литература
1.Общая химия для медицинских вузов. (В.А. Попков, С.А. Пузаков) 976 с. – М, ГЭОТАР Медиа, 2007 г.
2. Химия (С.А.Пузаков и др. Под ред. Ю.А. Ершова, В.А. Попкова) М., ГЭОТАР Медиа. -2007. – 281 с.
| |
Дата добавления: 2019-02-22; просмотров: 210; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
