Определение возможного направления реакции
Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Магнитогорский государственный технический университет им. Г.И. Носова»
Кафедра физической химии и химической технологии
РАСЧЕТНО-ГРАФИЧЕСКОЕ ЗАДАНИЕ 1
по курсу «Физическая химия»
раздел «Термодинамика» вариант 2-9
Выполнил:
Студент гр. (подпись) А.АГуренко
Проверил:
Доц., канд.техн.наук (подпись) А.И.Иванов
Магнитогорск
2017
СПРАВОЧНЫЕ ДАННЫЕ
по термодинамическим параметрам для простых веществ и неорганических соединений
DH0298 - изобарная теплота образования веществ при стандартных условиях (P = 1 атм; T = 298 K); 0 S0298 - стандартное значение энтропии;
Tф.п. - температура фазового перехода;
DHф.п - теплота фазового перехода;
a, b, c / - коэффициенты в уравнении, связывающим изобарную теплоемкость с температурой:
Исследование 1
2SiC(тв)+O2(газ)=2Si(тв)+2Co(газ)
| № п/п | вещество | DH0298 Дж/моль | S0298 Дж/моль*К | коэффициенты в уравнение a+bT+cT-2 , Дж/моль·К a b*10^3 c*10^3 | ||
| 1 | SiC | -51.9 | 16.54 | 37.38 | 12.56 | -12.85 |
| 2 | O2 | 0 | 205.08 | 31.46 | 3.39 | -3.77 |
| 3 | Si | - | - | 31 | 0 | 0 |
| 4 | Co | -110.5 | 197.4 | 28.41 | 4.1 | -0.46 |
|
|
|
3.1.1. Расчет изменения изобарной теплоемкости ( D C p ) и теплового эффекта реакции ( D HT0 )
Зависимость теплового эффекта реакции от температуры определяется законом Кирхгофа:
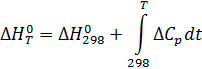
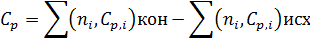
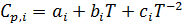
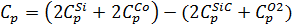
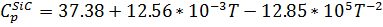
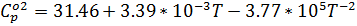
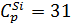
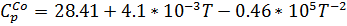
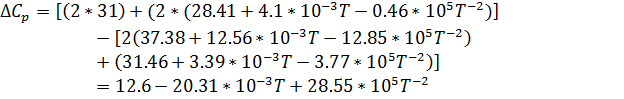
Температурный интервал в K
1350-1600 K ; Шаг по температуре 50 K
| T,K | 298 | 1350 | 1400 | 1450 | 1500 | 1550 | 1600 |
| Cp , Дж/ K | 38.69 | -13.25 | -14.37 | -15.49 | -16.59 | -17.69 | -18.78 |
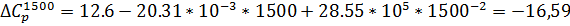
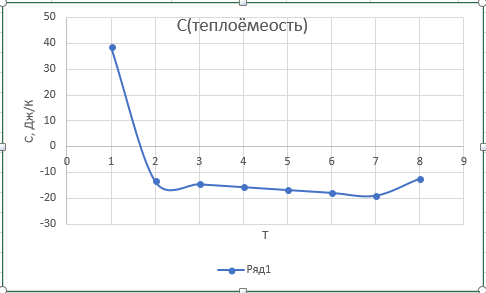
Рис.1. Зависимость изменения изобарной теплоемкости от температуры
Значение 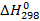 в уравнении (1) по стандартным теплотам образования
в уравнении (1) по стандартным теплотам образования 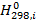
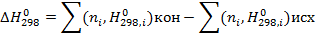
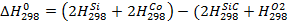 )
)
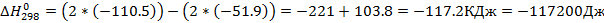
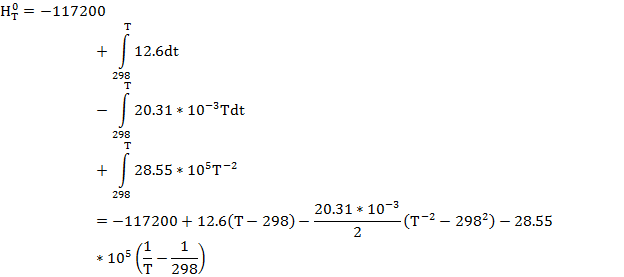
| T,K | 298 | 1350 | 1400 | 1450 | 1500 | 1550 | 1600 |
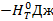
| 117200 | 114085 | 114776 | 115522 | 116325 | 117182 | 118094 |
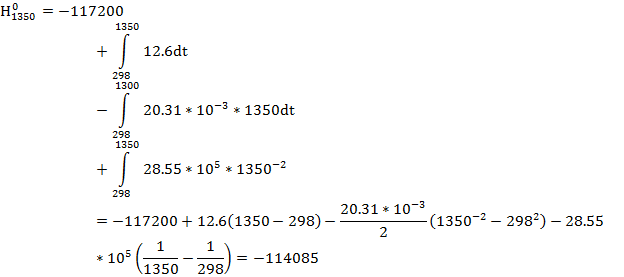
Рис. 2. Зависимость теплового эффекта реакции : 2SiC+O2=2Si+2CO от температуры
Расчёт изменения энтропии реакции
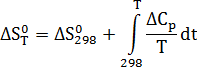
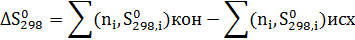
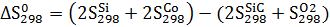
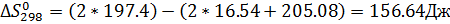
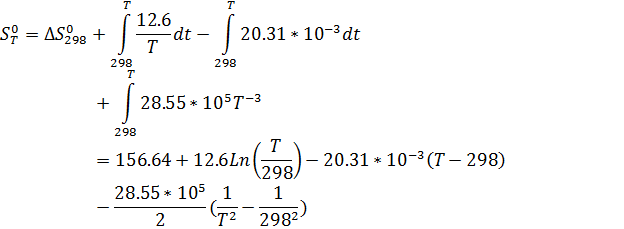
| T,K | 298 | 1350 | 1400 | 1450 | 1500 | 1550 | 1600 |
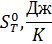
| 156.64 | 169.6 | 169.09 | 168.57 | 168.03 | 167.46 | 166.89 |
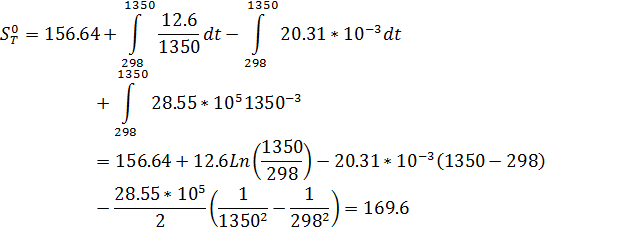
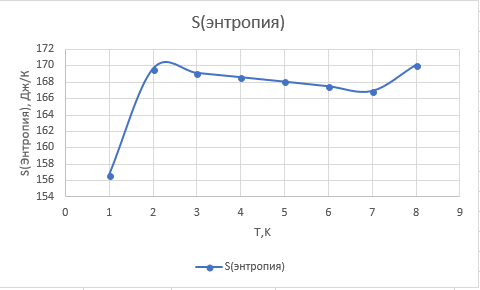
Рис.3. Зависимость изменения энтропии от температуры
Расчёт изменения стандартной энергии Гиббса
При расчёте стандартной энергии Гиббса для реакции воспользуемся уравнением Гиббса-Гельмгольца 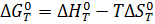
| T,K | 298 | 1350 | 1400 | 1450 | 1500 | 1550 | 1600 |
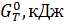
| -163,87 | -343,75 | -351,51 | -359,95 | -368,37 | -376,75 | -385,11 |
|
|
|
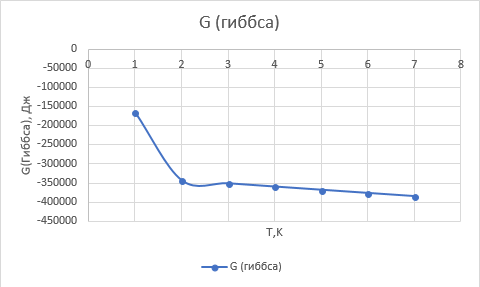
Рис. 4. Зависимость изменения стандартной энергии Гиббса от температуры
В выбранном интервале температур 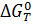 имеет отрицательные значения. Это значит, что при стандартных состояниях веществ возможно протекания слева-направо
имеет отрицательные значения. Это значит, что при стандартных состояниях веществ возможно протекания слева-направо
Вывод уравнения зависимости константы равновесия от температуры
Константа равновесия связана с изменением стандартной энергии Гиббса соотношением 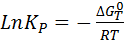
| T,K | 298 | 1350 | 1400 | 1450 | 1500 | 1550 | 1600 |
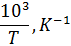
| 3.35 | 0.74 | 0.71 | 0.68 | 0.66 | 0.64 | 0.62 |
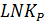
| 66.17 | 30.57 | 30.21 | 29.87 | 29.55 | 29.25 | 28.56 |
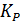
| 5.49*10^28 | 1.9*10^13 | 1.32*10^13 | 9.41*10^12 | 6.83*10^12 | 5.04*10^12 | 3.79*10^12 |
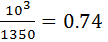 ;
;
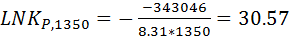
; 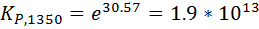
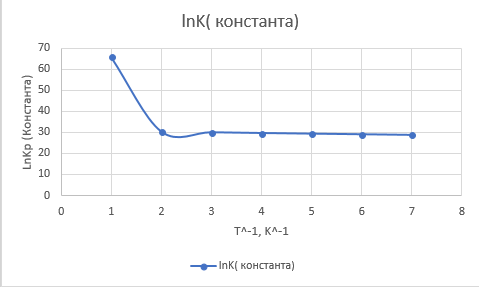
Рис. 5. Зависимость lnKp от обратной температуры для реакции: 2SiC+O2=2Si+2CO
График на рис.5 представляет собой прямую, тангенс угла которой к оси абсцисс численно равен коэффициенту А в уравнении (16). Для нахождения величины тангенса возьмём на прямой, как это показано на рис. 5, произвольно две точки “а” и ”b” и определим численные значения их ординат и абсцисс. Можно записать:
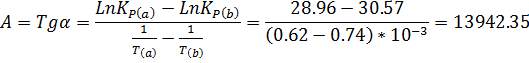
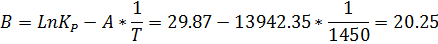
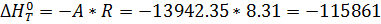
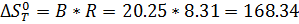
Исследование 2
В этом исследовании нужно для рассматриваемой системы рассчитать число степеней свободы, определить возможное направление протекания реакции при заданных условиях, а также состав газовой фазы системы в состоянии равновесия. 3.2.1. Определение числа фаз, независимых компонентов и степеней свободы
|
|
|
2SiC(тв)+O2(газ)=2Si(тв)+2Co(газ) Ф=3
K=m-r=4-1=3
Число независимых компонентов (k)
общее число веществ в системе (m)
число связей между ними (r).
С = k + n – ф = 3 + 2 - 3 = 2
n – число внешних параметров, влияющих на состояние равновесия системы. Обычно это давление и температура, т.е. n = 2
Если в качестве независимых переменных выбрать давление Р и температуру Т, то концентрации O 2 и CO в состоянии равновесия будут функциями этих переменных. Например: %О2 = (Р, Т). ¦
Определение возможного направления реакции
Для решения этой задачи воспользуемся уравнением изотермы Вант – Гоффа :
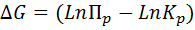
где Пp – произведение фактических парциальных давлений газовых компонентов реакции;
Кp – константа равновесия реакции при данной температуре.
Напомним, что в соответствии со вторым законом термодинамики в изобарно – изотермических условиях возможно самопроизвольное протекания процессов, сопровождающихся уменьшением энергии Гиббса системы:
G D < 0 (23)
В применении к химической реакции это означает, что процесс самопроизвольно может идти слева направо при G D < 0 и справa налево при G D > 0.
|
|
|
Из уравнения (22) следует, что первое условие ( G D < 0) выполняется при Пp < Кp, а второе ( G D > 0) - при Пp > Кp
Расчетаем 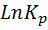 при Т=1300 К и Р=101.3 кПа
при Т=1300 К и Р=101.3 кПа
Расчетаем Пp при CO =50%, O 2=50%
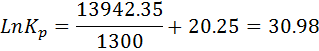
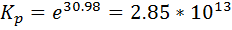
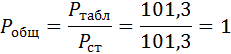
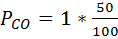 ;
; 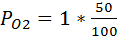
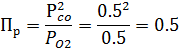
Сравнивая Кр и Пр видно, что Кр > Пр (2.85*1013 > 0.5), то есть при заданных условиях по уравнению (22) D G < 0 и возможное направление реакции – слева направо, т.е. в сторону образования Si и CO
Дата добавления: 2019-02-26; просмотров: 189; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
