Лабораторная работа №6. (Две части)
ИЗУЧЕНИЕ АДСОРБЦИИ ПАВ ИЗ РАСТВОРОВ
НА ТВЕРДОМ АДСОРБЕНТЕ
Цель работы: получение изотерм поверхностного натяжения растворов ПАВ на границе с воздухом; определение предельной адсорбция ПАВ из водного раствора на угле; вычисление удельной поверхности адсорбента.
Общие теоретические положения
В коллоидных (ультрамикрогетерогенных) системах, имеющих огромную поверхность раздела между фазами и обладающих большим запасом свободной поверхностной энергии, большую роль играют процессы, происходящие на поверхности.
Свободная поверхностная энергия − та часть свободной энергии системы, которая обусловлена наличием межфазной поверхности. Источником поверхностной энергии являются силы межмолекулярного взаимодействия, некомпенсированные в поверхностном слое (вследствие различной энергии ван-дер-ваальсова взаимодействия молекул поверхностного слоя с молекулами смежной фазы и между собой). Уменьшение свободной поверхностной энергии системы происходит самопроизвольно и может реализовываться двумя способами: 1) за счет уменьшения площади межфазной поверхности (например, в процессе коагуляции дисперсных систем); 2) путем изменения состава поверхностного слоя − адсорбции.
Адсорбция – это процесс самопроизвольного перераспределения компонентов системы между поверхностным слоем и объемом фазы. Может быть только в многокомпонентной системе. Перераспределяться в первую очередь будет компонент, у которого максимально маленькое σ.
|
|
|
Адсорбент – вещество, на поверхности которого происходит адсорбция.
Адсорбат – вещество, которое перераспределяется.
Десорбция – процесс обратный адсорбции (т.е. переход в объем среды).
Единицы измерения – число молей или массы на единицу поверхности объема или массы адсорбента: моль/м2, моль/кг, моль/м3, кг/м2, кг/кг, кг/м3.
Различают также гиббсовскую адсорбцию – это избыточное количество вещества в поверхностном слое по сравнению с его количеством в объеме фазы. Единицы измерения: моль/м2, кг/м2.
 (6.1)
(6.1)
Адсорбция зависит от температуры (T), давления (p), концентрации адсорбата (c) перераспределенного вещества, а также физико-химического сродства адсорбента и адсорбата (селективности).
На границе раздела раствор-воздух молекулы спиртов (ROH) в поверхностном слое раствора самопроизвольно ориентируются таким образом, что неполярный углеводородный радикал (R) выходит из воды в соседнюю неполярную фазу (в данном случае воздух), а полярная гидрофильная группа (-ОН), интенсивно взаимодействующая с водой, остается в водной фазе (рис.6.1,а).

Рис. 6.1. Структура адсорбционных слоёв ПАВ
|
|
|
Такая ориентация обеспечивает снижение свободной поверхностной энергии раствора, поверхностного натяжения σ. С увеличением общей концентрации раствора величина адсорбции растет, молекулы ПАВ в адсорбционном слое сближаются и в пределе (при С→∞) образуют плотно упакованный (насыщенный) монослой (частокол "Ленгмюра") (рис. 6.1,б).
Величина σ при этом снижается до минимального значения, а адсорбция достигает предельной величины. Вещества, снижающие поверхностное натяжение раствора и образующие адсорбционные слои с повышенной концентрацией, называются поверхностно-активными (ПАВ).
Помимо спиртов к ним относятся другие полярные органические соединения: карбоновые и сульфокислоты и их соли, соли алкиловых эфиров серной кислоты (алкилсульфаты), амины и их соли и т.д. Поверхностно-активные свойства таких веществ обусловлены наличием в их молекулах двух различных по природе (полярности) частей, которые сообщают им сродство к различным по полярности фазам.
Энергия Ван-Дер-Ваальсова взаимодействия углеводородного радикала с полярными молекулами воды меньше, чем энергия взаимодействия молекул воды между собой. Поэтому на границе раздела водный раствор/воздух (или углеводород) радикалы R самопроизвольно переходят (выталкиваются) в соседнюю неполярную фазу, что энергетически выгодно и обнаруживается экспериментально как уменьшение поверхностного натяжения (поверхностной энергии) σ. Полярные группы, напротив, активно взаимодействуют с диполями воды (гидратация) и сообщают молекулам ПАВ гидрофильные свойства (молекулярное сродство к воде), тогда как углеводородные радикалы являются носителями гидрофобных свойств (гидрофобность означает вместе с тем олеофильность − сродство к неполярным фазам − углеводородам, маслам). Поскольку наличие молекул ПАВ в поверхностном слое энергетически выгодно (дσ/дС <0), то происходит самопроизвольное концентрирование растворенного вещества на межфазной границе.
|
|
|
Неорганические соли, кислоты, основания повышают поверхностное натяжение водных растворов и потому их адсорбция отрицательна (концентрация вещества в поверхностном слое меньше, чем в объеме). Это поверхностно-инактивные вещества (ПИВ).
Взаимосвязь между адсорбцией и понижением поверхностного натяжения дает уравнение адсорбции Гиббса:
 (6.2)
(6.2)
Уравнение Гиббса позволяет рассчитать изотерму адсорбции − зависимость Г= f (С) по изотерме поверхностного натяжения σ=f (С) (рис.6.2). Для этого при разных С находят численное значение производной (  ) обычно графическим путем, т.е. по наклону касательных к кривой σ=f (С) в различных точках.
) обычно графическим путем, т.е. по наклону касательных к кривой σ=f (С) в различных точках.
|
|
|

Рис. 3.2. Изотермы адсорбции и поверхностного натяжения ПАВ
Изотерма мономолекулярной адсорбции описывается уравнением Ленгмюра:
 , (6.3)
, (6.3)
где С - равновесная концентрация ПАВ в объеме раствора; К - константа адсорбционного взаимодействия; А∞ − предельная адсорбция (или емкость монослоя) величина адсорбции, отвечающая образованию на межфазной поверхности насыщенного монослоя.
Гиббсовская адсорбция Г рассчитывается как избыток растворенного вещества в адсорбционном слое по сравнению с объемом, по Ленгмюру адсорбция А − полное его количество в адсорбционном слое (в обоих случаях − на единице поверхности). При условии С→0, А ≈ Г.
Изотерму адсорбции Ленгмюра также можно рассчитать по зависимости σ= f (С). Для этого необходимо найти значения констант А и К. Их можно получить, используя уравнение Шишковского, описывающее изотерму поверхностного натяжения а (С):
σ = σ 0 - а ln ( bc +1), (6.4)
где σo − поверхностное натяжение растворителя; а и b - константы. Это эмпирическое уравнение. Объединяя уравнения Гиббса и Ленгмюра, можно получить следующие отношения:
a = RTA ∞ (6.5) b = K (6.6)
Зависимость σ= f (С) , согласно уравнению (3.4), нелинейная. Для расчета констант А∞ и К уравнение изотермы поверхностного натяжения приводят к линейному виду. В области не очень малых концентраций КС»1 тогда, пренебрегая единицей под знаком логарифма, получим уравнение (3.4) в виде:
Δσ = σ 0 - σ = a ∙ ln ( b ) - a ∙ ln ( C ), (6.7)
т.е. Δσ линейно зависит от 1пС. Из графика зависимости Δσ − ln ( C ) находят константы а и b, а по соотношениям (6.6) -А∞ и К.
Зная величину А∞ можно рассчитать параметры адсорбционного слоя − площадь, приходящуюся на 1 молекулу в насыщенном адсорбционном слое Sm ("молекулярная площадка") и толщину адсорбционного слоя h, равную длине молекулы, из следующих соображений:
1) На 1 м поверхности адсорбировано A ∞ N молекул ( N − число Авогадро), отсюда следует, что:
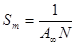 (6.8)
(6.8)
2) Масса вещества т9 адсорбированного на 1 м2 поверхности, равна:
т = А∞М, (6.9)
где М - молярная масса ПАВ.
С другой стороны, величину т можно выразить как массу вещества, находящегося в объеме адсорбционного слоя с площадью 1 см2 и толщиной h:
т = ρ∙h (6.10)
(ρ − плотность вещества, г/м3 ).
Таким образом, А∞М= ρh , откуда h = А∞М ρ (6.11)
При адсорбции на твердых пористых адсорбентах, например, активированном угле, также образуется насыщенный мономолекулярный слой на поверхности твердой фазы при достижении предельной адсорбции Г'∞
Зная предельную адсорбцию Г'∞ и молекулярную площадку ПАВ (Sm ) можно рассчитать удельную поверхность адсорбента Sуд.
Удельная поверхность − суммарная площадь поверхности всех пор единицы массы адсорбента (м /г) находят по уравнению:
Sуд = Sm∙.Г'∞∙ N (6.12)
В качестве ПАВ применяют один из спиртов жирного ряда. В таблице 6.1 приведены некоторые характеристики ПАВ и рекомендуемые условия проведения опытов.
Таблица 6.1
Характеристики ПАВ, рекомендуемых для проведения опыта
| Свойства | ПАВ: спирты | |||
| этиловый | н-пропиловый | н-бутиловый | н-амиловый | |
| Молярная масса, г/моль | 46 | 60 | 76 | 88 |
| Плотность, г/см3 | 0,79 | 0,80 | 0,81 | 0,81 |
| Исходная концентрация, моль/л | 0,5 | 0,5 | 0,5 | 0,2 |
| Навеска угля, г | 4 | 4 | 2 | 1 |
ПРИБОРЫ И РЕАКТИВЫ:
Прибор для измерения поверхностного натяжения (сталагмометр).
Мерные колбы, объёмом 50 мл, 6 шт.
Химические стаканы, объёмом 50 мл, 6 шт.
Бюретка, объёмом 50 мл.
Весы технохимические.
Фарфоровая ступка
Воронки для фильтрования.
Фильтровальная бумага.
Растворы ПАВ.
Активированный уголь.
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ:
Из исходного раствора ПАВ готовят ряд растворов таким образом, чтобы концентрация каждого последующего раствора была вдвое больше предыдущего. Для этого в мерную колбу на 50 мл вводят из бюретки последовательно 1,6; 3,2; 6,3; 12,5; 25 мл исходного раствора ПАВ и доводят содержимое колбы до метки дистиллированной водой.
Хорошо перемешав содержимое колбы, переливают растворы в чистые сухие склянки на 50 мл. Отбирают в такую склянку также 50 мл исходного раствора.
На технических весах берут 6 навесок активированного угля. (Если уголь в гранулах, то его хорошо перетирают в ступке.) Взятые навески (согласно таблице 3.1) через воронку с широким горлом вносят в чистые сухие склянки объемом 30-50 мл. В склянки с навесками пипеткой переносят по 30 мл приготовленных растворов. Склянки закрывают пробками, перемешивают встряхиванием в течение 1−2 минут и оставляют на 1−1,5 часа для установления адсорбционного равновесия. В течение этого времени периодически повторяют встряхивание. Пока в растворах с углем устанавливается адсорбционное равновесие, измеряют поверхностное натяжение приготовленных растворов (без угля) в порядке возрастания концентрации. Измерения проводят методом счета капель (сталагмометрический метод). После выдерживания растворов с углем необходимое время растворы фильтруют и измеряют поверхностное натяжение фильтратов. Данные фиксируют.
Для построения изотермы адсорбции ПАВ на поверхности раздела раствор − воздух и расчет адсорбционных характеристик молекул ПАВ используют либо графический метод, либо расчет по уравнениям Ленгмюра и Шишковского (по указанию преподавателя).
Порядок расчета при построении изотермы адсорбции с помощью уравнений Ленгмюра и Шишковского
Строят кривую зависимости σ от С (рис.3.3). На экспериментальной кривой зависимости σ (С) выбирают 5−6 точек, вычисляют для них Δσ и 1пС. Строят график зависимости Δσ − (1пС) (рис.10). 2. По наклону прямой Δσ − (1пС) находят величину константы а уравнения Шишковского (как тангенс угла наклона) и рассчитывают предельную адсорбцию А∞ используя формулу (6.5).
При расчете наклона прямой Δσ − (1пС) необходимо помнить, что длины катетов треугольника, выбранного для расчета, должны быть выражены в единицах тех величин, которые отложены на осях координат, с учетом масштаба.

Рис.6.3 Зависимость Δσ − (1пС)
Экстраполируют прямую Δσ − (1пС) до пересечения с линией (нормалью к оси абсцисс), проходящей через точку 1п( C ) = 0, и находят ординату точки пересечения. Согласно уравнению (7), при 1п(С) =0, Δσ = а 1п( b ). Используя найденные значения а и Δσ, рассчитывают b. Величина b равна К в уравнении Ленгмюра (единица измерения константы а − Дж/м2 , К - л/моль).
По уравнению Ленгмюра рассчитывают значение А для различных концентраций и строят изотерму адсорбции А(С). Необходимые для расчета данные записывают в таблицу 6.2:
Таблица 6.2.
Расчетные данные для построения изотермы адсорбции ПАВ на границе
жидкость−газ
| Концентрация раствора ПАВ, моль/л | КС | 1+КС | КС/1+КС | Адсорбция А∙106 , моль/м2 |
Вычисляют значение площади молекулы Sm (в м2) и толщины адсорбционного слоя h (в м) по формулам (6.8) и (6.9).
Порядок расчета при построении изотермы адсорбции графическим методом
Строят кривую зависимости σ от С (рис. 6.4,а). На экспериментальной кривой зависимости σ − (С) выбирают 5-6 точек, проводят к ним касательные (методом зеркала) и определяют отрезки z. (Длину отрезков выражают в единицах поверхностного натяжения.)

Рис. 6.4. Построение изотермы адсорбции 2 по изотерме поверхностного натяжения 1. Вычисляют значения Г по формуле (6.2) и строят изотерму адсорбции Г= f (С). Вычисляют значения С/Г и строят график зависимости С/Г = f (С). По графику находят константы Г∞ (равняется котангенсу угла наклона прямой) и К (учитывая, что отрезок, отсекаемый прямой на оси ординат, равен 1/Г∞ К). Необходимые для расчета данные записывают в таблицу 6.3. Вычисляют значение площади молекулы Sm (в м2) и толщины адсорбционного слоя h (в м) по формулам (6.10) и (6.11).
Таблица 6.3.
Данные для построения изотермы адсорбции ПАВ на границе
жидкость газ, определенные графическим методом
| № | Концентрация раствора ПАВ, моль/л | σ, мН/м | Z, mH/m | Г, моль/м | С/Г |
Расчет удельной поверхности активированного угля
Ha построенном ранее графике зависимости σ − (С) строят изотерму поверхностного натяжения σ' − (С) после адсорбции на угле (рис.6.5).

Рис.6.5. Изотермы поверхностного натяжения до и после адсорбции на активированном угле
По повышению поверхностного натяжения растворов после адсорбции на угле находят графическим путем остаточную равновесную концентрацию ПАВ Ср. Для этого используют кривую σ − (С) как калибровочную. Схема определения Ср для любого раствора с исходной концентрацией С показана на рис.6.5.
Адсорбцию ПАВ на угле Г (в молях на 1 г адсорбента) рассчитывают по формуле
 ,
,
где V - объем раствора (л);
т - навеска адсорбента (г).
Результаты расчета записывают в таблицу 6.4.
Таблица 6.4.
Данные для расчета адсорбции ПАВ на границе жидкость газ.
| № образца | Концентрация ПАВ, моль / л | С-Ср , моль/л | Г, моль / г | |
| Исходная С | Равновесная Ср | |||
|
| ||||
Строят изотерму адсорбции на угле Г − ( Ср). По графику находят предельное значение адсорбции Г∞. Если на изотерме нет участка, отвечающего предельной адсорбции, её спрямляют как описано выше в координатах Ср/Г – Ср и находят Г∞ графическим методом. Вычисляют удельную поверхность активированного угля по формуле (6.12), используя значение молекулярной площадки Sm, полученное в первой части работы.
Дата добавления: 2019-02-26; просмотров: 2066; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
