Глава I II. Эксперимент для нахождения параметров уравнения
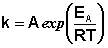 С помощью эксперементальных данных об температурах, тангенса угла наклона и табличных данных k скорости химреакции вычислим Е активации и предэкспоненциальный множитель:
С помощью эксперементальных данных об температурах, тангенса угла наклона и табличных данных k скорости химреакции вычислим Е активации и предэкспоненциальный множитель:
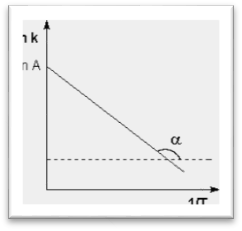 Рис. 2.7 Зависимость логарифма константы скорости химической
Рис. 2.7 Зависимость логарифма константы скорости химической
реакции от обратной температуры.
Здесь A – постоянная интегрирования. Из уравнения (II.37) нетрудно показать физический смысл предэкспоненциального множителя A, который равен константе скорости реакции при температуре, стремящейся к бесконечности. Как видно из выражения (II.36), логарифм константы скорости линейно зависит от обратной температуры (рис.2.7); величину энергии активации EA и логарифм предэкспоненциального множителя A можно определить графически (тангенс угла наклона прямой к оси абсцисс и отрезок, отсекаемый прямой на оси ординат).
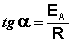 (II.38)
(II.38)
Зная энергию активации реакции и константу скорости при какой-либо температуре T1, по уравнению Аррениуса можно рассчитать величину константы скорости при любой температуре T2:
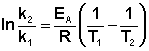 (II.39)
(II.39)
Заключение
Для написания курсовой подобрана тематическая литература о роли уравнения Аррениуса в кинетике химических реакций, которая дает исчерпывающую информацию по требуемому вопросу. Тема работы актуальная и оригинальная.
При написании работы, опора была сделана на том, что в лаборатории кинетики проводят физико-химические реакции, где без вычисление энергии активации и предэкспоненциального множителя невозможно утверждать о вероятности инициирования процесса в системе. Поэтому любому химику необходимо разбираться в установках и процессах химической кинетики.
|
|
|
Подводя итоги, следует обобщить систематизацию, чтоэнергия активации – это энергия, необходимая для перехода частиц в состояние активированного комплекса, а предэкспоненциальный множитель - это то число столкновений реагирующих молекул в единицу времени в единице объема при их концентрациях, равных одному молю( макс.k скорости).
Таким образом, уравнение Аррениуса, в отличие от приближенного уравнения с температурным коэффициентом, обоснованно выражает константу скорости химической реакции от температуры.
Список литературы
1. Герасимов В.П. Формальная кинетика. М.:Химия. 1973.40с.
2. Краснов К.С., Воробьев Н.К., Годнев И.Н.. Теория элементарного акта химического взаимодействия// Учеб. для вузов 2001. 3-е изд., С.134.
3. Химия // Studfiles - файловый архив студентов [Электронный ресурс].
режим доступа: https://studfiles.net/preview/1671805/page:9/ (дата обращения: 16.12.18).
4. Справочник Седьмое издание, Л.: Химия, 1974 г. – 200 стр под редакцией К. П. Мищенко и А. А Равделя, 200 стр. [Электронный ресурс]. -
|
|
|
Режим доступа: http://rushim.ru/books/spravochniki/mishenko.pdf (дата обращения: 23.12.18).
5. Электронная библиотека БашГУ/ Практикум по химической кинетике. - С. 44. - [Электронный ресурс]. - Режим доступа: https://elib.bashedu.ru/dl/read/Zimin_Hursan_Gerchikov_Praktikum%20po%20him_kinetike_up_2010.pdf/view (дата обращения: 23.12.18).
Дата добавления: 2019-02-26; просмотров: 546; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
