Фосфорилирование белков как регуляторный механизм клетки
Билет 10. 2 вопрос. Фосфорилирование сигнальных белков. (Фосфорилирование – это присоединение фосфатной группы (PO43-) к белку или другой органической молекуле. Оно активирует или инактивирует множество белковых энзимов. Фосфорилирование белков играет важную роль в большом количестве клеточных процессов.) Общие представления о путях сигнальной трансдукции. Для большинства регуляторных молекул между их связыванием с мембранным рецептором и окончательной реакцией клетки, т.е. изменением ее работы, вклиниваются сложные серии событий - определенные пути передачи сигнала, иначе называемые путями сигнальной трансдукции. Регуляторные вещества принято подразделять на эндокринные, нейрокринные и паракринные. Эндокринные регуляторы (гормоны) выделяются эндокринными клетками в кровь и переносятся ею к клеткам-мишеням, которые могут находиться в любом месте организма. Нейрокринные регуляторы выделяются нейронами в непосредственной близости от клеток-мишеней. Паракринные вещества освобождаются несколько дальше от мишеней, но все же достаточно близко к ним, чтобы достичь рецепторов. Паракринные вещества секретируются одним типом клеток, а действуют на другой, однако в некоторых случаях регуляторы предназначены тем клеткам, которые их выделили, или соседним клеткам, относящимся к тому же типу. Это называется аутокринной регуляцией. В ряде случаев последний этап сигнальной трансдукции состоит в фосфорилировании определенных эффекторных белков, что ведет к усилению или угнетению их активности, а это, в свою очередь, определяет необходимую организму клеточную реакцию. Фосфорилирование белков осуществляют протеинкиназы, а дефосфорилирование - протеинфосфатазы. Изменения протеинкиназной активности происходят в результате связывания регуляторной молекулы (в общем случае называемой лигандом) с ее мембранным рецептором, что запускает каскады событий, некоторые из которых приведены на рисунке (рис. 2-1). Активность различных протеинкиназ регулируется рецептором не прямо, а через вторичные мессенджеры (вторичные посредники), в роли которых выступают, например, циклический АМФ (цAMФ), циклический ГМФ (цГMФ), Са2+, инозитол-1,4,5-три- фосфат (IP3) и диацилглицерол (DAG). При этом связывание лиганда с мембранным рецептором изменяет внутриклеточный уровень вторичного мессенджера, что, в свою очередь, отражается на активности протеинкиназы. Многие регуляторные молекулы влияют на клеточные процессы через пути сигнальной трансдукции с участием гетеротримерных ГТФ-связывающих белков (гетеротримерных G-белков) или мономерных ГТФ-связывающих белков (мономерных G-белков). Когда молекулы лиганда связываются с мембранными рецепторами, взаимодействующими с гетеротримерными G-белками, происходит переход G-белка в активное состояние путем связывания с ГТФ. Активированный G-белок может затем взаимодействовать со многими эффекторными белками, прежде всего ферментами, такими, как аденилатциклаза, фосфодиэстераза, фосфолипазы С, А2 и D. Это взаимодействие запускает цепи реакций (рис. 2-1), которые заканчиваются активацией различных протеинкиназ, таких, как протеинкиназа А (ПКА), протеинкиназа G (ПKG), протеинкиназа C (ПИС). В общих чертах пути сигнальной трансдукции с участием G-белков - протеинкиназ включает следующие этапы. 1. Лиганд связывается с рецептором на мембране клетки. 2. Связанный с лигандом рецептор, взаимодействуя с G-белком, активирует его, и активированный G-белок связывает ГТФ. 3. Активированный G-белок взаимодействует с одним или несколькими следующими соединениями: аденилатциклазой, фосфодиэстеразой, фосфолипазами С, А2, D, активируея или ингибируя их. 4. Внутриклеточный уровень одного или нескольких вторичных мессенджеров, таких, как цАМФ, цГМФ, Са2+, IP3 или DAG, возрастает или снижается. 5. Увеличение или уменьшение концентрации вторичного мессенджера влияет на активность одной или нескольких зависимых от него протеинкиназ, таких, как цАМФ-зависимая протеинкиназа (протеинкиназа А), цГМФ-зависимая протеинкиназа (ПКG), кальмодулинзависимая протеинкиназа (КМПК), протеинкиназа С. Изменение концентрации вторичного мессенджера может активировать тот или иной ионный канал. 6. Уровень фосфорилирования фермента или ионного канала изменяется, что влияет на активность ионного канала, обуславливая конечный ответ клетки. Рис. 2-1. Некоторые каскады событий, реализующиеся в клетке благодаря вторичным посредникам. Обозначения: * - активированный фермент Фосфорилирование белков осуществляют протеинкиназы, а дефосфорилирование - протеинфосфатазы. Протеинкиназа переносит фосфатную группу (Pi) от АТФ на сериновые, треониновые или тирозиновые остатки белков. Это фосфорилирование обратимо меняет структуру и функции клеточных белков. Оба типа ферментов - киназы и фосфатазы - регулируются различными внутриклеточными вторичными мессенджерами Рис. 2-6. Примеры путей сигнальной трансдукции через гетеротримерные G-белки. (Источник: https://meduniver.com/Medical/genetika/fosfolirirovanie_belkov.html):
|
|
|
|
|
|
|
|
|
Фосфорилирование белков как регуляторный механизм клетки
|
|
|
• Протеинкиназы представляют собой большое семейство белков
• Протеинкиназы фосфорилируют Ser (серин) и Thr (треонин) либо Tyr (тирозин) или же все три аминокислотных остатка
• Протеинкиназы узнают последовательность аминокислот, окружающую сайт фосфорилирования
• Протеинкиназы преимущественно узнают сайты фосфорилирования, расположенные в скрученных доменах
Фосфорилирование белков представляет собой наиболее распространенную форму их регуляторной посттрансляционной модификации. Оно происходит у всех организмов, и показано, что примерно 1/3 всех белков в клетке млекопитающих в определенные моменты времени подвергается фосфорилированию. Фосфорилирование может стимулировать или ингибировать каталитическую активность ферментов, сродство, с которым белок связывается с другими молекулами, его внутриклеточную локализацию и способность к дальнейшим ковалентным модификациям, или изменять его стабильность. При фосфорилировании одного остатка активность белка может измениться в 500 и более раз, и часто белки фосфорилируются по нескольким сайтам сложными и взаимозависимыми путями.
Большинство белков клеток эукариот и практически все в клетках животных фосфорилируются с участием протеинкиназ; их дефосфорилирование катализируется фосфопротеинфосфатазами. Оба класса ферментов находятся под контролем различных механизмов. Часто, наряду с этим, белки фосфорилируются несколькими протеинкиназами, что приводит к возникновению фосфорилированных форм, обладающих различной активностью. Это позволяет интегрироваться различным входным сигналам, обеспечивая активацию белков-мишеней.
У бактерий, растений и грибов важную роль играет еще одна система фосфорилирования белков, которая называется двухкомпонентной сигнальной системой. Участвующие в этой системе протеинкиназы отличаются от соответствующих ферментов эукариот и фосфорилируют остатки аспарагиновой кислоты, а не серина, треонина или тирозина.
Протеинкиназы переносят фосфатную группу с АТФ на остатки Ser, Thr и Tyr в белковых субстратах, образуя химически устойчивые фосфорные эфиры. У животных фосфатные группы неравномерно распределяются среди трех остатков аминокислот: 90-95% приходится на остатки Ser, 5-8% на Thr, и менее 1% — на Tyr. В геноме человека содержится примерно 500 генов, кодирующих протеинкиназы, и для многих их мРНК характерен альтернативный сплайсинг. Это делает семейство генов протеинкиназ одним из наиболее представительных. Количество протеинкиназ и их разнообразие служат подтверждением широкого участия этих ферментов в регуляции клеточных функций. Хотя некоторые протеинкиназы характеризуются ограниченным тканевым распределением и участвуют не во всех процессах развития, многие из них распространены достаточно широко.
Классификация протеинкиназ основывается на их специфичности по отношению к остаткам аминокислот. Киназы, которые фосфорилируют остатки Ser, обычно также узнают остатки Thr; отсюда их название Ser/Thr киназы. У многоклеточных организмов Tyr киназы специфичны только по отношению к остаткам Tyr. Протеинкиназы, обладающие двойной специфичностью, могут фосфорилировать Ser, Thr и Tyr при строго определенной конформации субстрата и обычно являются наиболее селективными из протеинкиназ.
Анализ киномов нескольких организмов привел к более подробной классификации киназ, основанной на степени гомологии их первичной структуры. В какой-то степени эта классификация также отражает специфику регуляторных механизмов и субстратную специфичность киназ. Например, группа AGC называется в соответствии с входящими в нее цАМФ-зависимой протеинкиназой (РКА), циклоГМФзависимой протеинкиназой (PKG), Са2+ и фосфолипидзависимой проотеинкиназой (РКС). Эти протеинкиназы регулируются с участием вторичных мессенджеров и предпочитают субстраты, которые содержат остатки основных аминокислот, расположенные рядом с сайтом фосфорилирования.
Наряду со специфичностью по отношению к остаткам аминокислот, большинство протеинкиназ проявляет селективность в отношении локальных последовательностей, окружающих субстратный сайт. Разработаны методы скрининга, позволяющие выяснить, содержат ли белки в субстратном сайте консенсусную последовательность для широкого набора протеинкиназ. Для идентификации и общей оценки степени фосфорилирования белков в специфических сайтах можно использовать антитела. Наряду с узнаванием отдельных белков, протеинкиназы могут обнаруживать заметную субстратную специфичность среди родственных белков, например, основанную на их общей трехмерной структуре, или среди белков, которые были дифференциально ковалентно модифицированы, например, фосфорилированы или убиквитинилированы.
Некоторые протеинкиназы клеток млекопитающих представляют собой гормональные рецепторы, проходящие через плазматическую мембрану. Рецепторы некоторых протеинкиназ представляют собой такие серин/треонин киназы, как рецептор трансформирующего фактора роста-b (TGF-b). Однако в большинстве случаев они являются протеин-тирозинкиназами, включая инсулиновые рецепторы, эпидермальный ростовой фактор (PDGF), и другие регуляторы роста и дифференцировки клеток. Прочие протеинкиназы представляют собой растворимые внутриклеточные ферменты, хотя они могут связываться с мембраной одной или нескольких органелл.
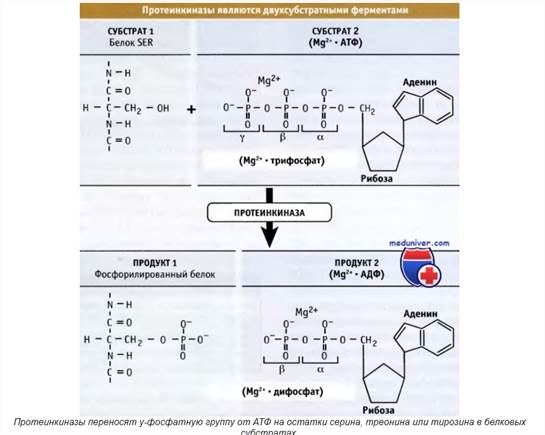
Тут покороче (Источник: http://humbio.ru/humbio/cell_sign3/00040629.htm ):
Дата добавления: 2019-02-26; просмотров: 706; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
