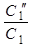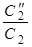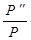ЗАДАНИЕ ДЛЯ КОНТРОЛЬНОЙ РАБОТЫ
Общие указания
Выполнение контрольной работы является необходимым этапом самостоятельной работы студента при изучении химии. Зачтенная преподавателем контрольная работа, наряду с зачтенными лабораторными работами, служит основанием для допуска к сдаче экзамена.
Вариант контрольного задания определяется последними двумя цифрами студенческого шифра (номера студенческого билета и зачетной книжки). Например, если шифр 86-0220, студент должен выполнять вариант № 20.
Контрольная работа оформляется по следующим правилам:
-все задачи должны строго соответствовать варианту и быть представлены в последовательности, указанной в таблице вариантов;
-условия задач должны быть переписаны в тетрадь полностью;
-необходимо пользоваться современной химической номенклатурой;
-все физические величины должны быть выражены в единицах Международной системы (СИ
-на каждой странице необходимо оставлять поля.
Перед решением задач следует ознакомиться с теоретическими основами соответствующего раздела, пользуясь указанной литературой.
Выполненную контрольную работу студенты сдают пре подавателю на первом занятии сессии.
ТАБЛИЦА ВАРИАНТОВ КОНТРОЛЬНОГО ЗАДАНИЯ
Заочники 2016-2017 уч года делают задания из тем №№ 1, 6,7, 8, 10, 11, 12 - на установочной лекцииназвание тем электрохимии с номером темы названо ошибочно - извините
| № вариант варианта | Номера задач
| ||||||||||||||
| 01 | 1 | 21 | 41 | 61 | 81 | 101 | 121 | 141 | 161 | 181 | 201 | 240 | 241 | ||
| 02 | 2 | 22 | 42 | 62 | 82 | 102 | 122 | 142 | 162 | 182 | 203 | 222 | 242 | ||
| 03 | 3 | 23 | 43 | 63 | 83 | 103 | 123 | 143 | 163 | 183 | 205 | 238 | 243 | ||
| 04 | 4 | 24 | 44 | 64 | 84 | 104 | 124 | 144 | 164 | 184 | 207 | 224 | 244 | ||
| 05 | 3 | 23 | 43 | 63 | 83 | 103 | 123 | 143 | 163 | 183 | 205 | 238 | 243 | ||
| 06 | 6 | 26 | 46 | 66 | 86 | 106 | 126 | 146 | 166 | 186 | 211 | 226 | 246 | ||
| 07 | 7 | 27 | 47 | 67 | 87 | 107 | 127 | 147 | 167 | 187 | 213 | 234 | 247 | ||
| 08 | 8 | 28 | 48 | 68 | 88 | 108 | 128 | 148 | 168 | 188 | 215 | 228 | 248 | ||
| 09 | 9 | 29 | 49 | 69 | 89 | 109 | 129 | 149 | 169 | 189 | 217 | 232 | 249 | ||
| 10 | 10 | 30 | 50 | 70 | 90 | 110 | 130 | 150 | 170 | 190 | 219 | 228 | 250 | ||
| 11 | 11 | 31 | 51 | 71 | 91 | 111 | 131 | 151 | 171 | 191 | 220 | 230 | 251 | ||
| 12 | 12 | 32 | 52 | 72 | 92 | 112 | 132 | 152 | 172 | 192 | 218 | 221 | 252 | ||
| 13 | 13 | 33 | 53 | 73 | 93 | 113 | 133 | 153 | 173 | 193 | 216 | 239 | 253 | ||
| 14 | 14 | 34 | 54 | 74 | 94 | 114 | 134 | 154 | 174 | 194 | 214 | 223 | 254 | ||
| 15 | 15 | 35 | 55 | 75 | 95 | 115 | 135 | 155 | 175 | 195 | 212 | 237 | 255 | ||
| 16 | 16 | 36 | 56 | 76 | 96 | 116 | 136 | 156 | 176 | 196 | 210 | 225 | 256 | ||
| 17 | 17 | 37 | 57 | 77 | 97 | 117 | 137 | 157 | 177 | 197 | 208 | 235 | 257 | ||
| 18 | 18 | 38 | 58 | 78 | 98 | 118 | 138 | 158 | 178 | 198 | 206 | 227 | 258 | ||
| 19 | 19 | 39 | 59 | 79 | 99 | 119 | 139 | 159 | 179 | 199 | 204 | 233 | 259 | ||
| 20 | 20 | 40 | 60 | 80 | 100 | 120 | 140 | 160 | 180 | 200 | 202 | 229 | 260 | ||
| 21 | 1 | 22 | 43 | 64 | 84 | 106 | 127 | 159 | 171 | 190 | 200 | 231 | 251 | ||
| 22 | 2 | 23 | 44 | 65 | 85 | 107 | 128 | 141 | 172 | 191 | 210 | 223 | 252 | ||
| 23 | 3 | 24 | 45 | 66 | 86 | 108 | 129 | 142 | 173 | 192 | 213 | 232 | 253 | ||
| 24 | 4 | 25 | 46 | 67 | 87 | 109 | 130 | 143 | 174 | 193 | 216 | 227 | 254 | ||
| 25 | 5 | 26 | 47 | 68 | 88 | 110 | 131 | 144 | 175 | 194 | 219 | 239 | 255 | ||
| 26 | 6 | 27 | 48 | 69 | 89 | 111 | 132 | 145 | 161 | 195 | 207 | 222 | 256 | ||
| 27 | 7 | 28 | 49 | 70 | 90 | 112 | 133 | 146 | 162 | 196 | 204 | 236 | 257 | ||
| 28 | 8 | 29 | 50 | 71 | 91 | 113 | 134 | 147 | 163 | 197 | 201 | 228 | 258 | ||
| 29 | 9 | 30 | 51 | 72 | 92 | 114 | 135 | 148 | 164 | 198 | 203 | 234 | 259 | ||
| 30 | 10 | 31 | 52 | 73 | 93 | 115 | 136 | 149 | 165 | 199 | 206 | 221 | 241 | ||
| 31 | 11 | 32 | 53 | 74 | 94 | 116 | 137 | 150 | 166 | 200 | 208 | 224 | 242 | ||
| 32 | 12 | 33 | 54 | 75 | 95 | 117 | 138 | 151 | 167 | 190 | 212 | 237 | 243 | ||
| 33 | 13 | 34 | 55 | 76 | 96 | 118 | 139 | 152 | 168 | 191 | 214 | 225 | 244 | ||
| 34 | 14 | 35 | 56 | 77 | 97 | 119 | 140 | 153 | 169 | 192 | 215 | 233 | 245 | ||
| 35 | 15 | 36 | 57 | 78 | 98 | 120 | 121 | 154 | 170 | 193 | 217 | 235 | 246 | ||
| 36 | 16 | 37 | 58 | 79 | 99 | 101 | 122 | 155 | 171 | 194 | 218 | 226 | 247 | ||
| 37 | 17 | 38 | 59 | 80 | 100 | 102 | 123 | 156 | 172 | 195 | 211 | 229 | 248 | ||
| 38 | 2 | 24 | 41 | 61 | 81 | 101 | 121 | 141 | 161 | 181 | 201 | 240 | 241 | ||
| 39 | 5 | 22 | 49 | 66 | 85 | 109 | 127 | 141 | 164 | 185 | 208 | 237 | 243 | ||
| 40 | 7 | 29 | 43 | 63 | 83 | 103 | 123 | 143 | 163 | 183 | 205 | 238 | 244 | ||
| 41 | 11 | 37 | 47 | 67 | 87 | 107 | 127 | 147 | 167 | 187 | 213 | 234 | 247 | ||
| 42 | 10 | 32 | 49 | 69 | 89 | 109 | 129 | 149 | 169 | 189 | 217 | 232 | 269 | ||
| 43 | 18 | 39 | 51 | 71 | 91 | 111 | 131 | 151 | 171 | 191 | 220 | 230 | 251 | ||
| 44 | 14 | 32 | 53 | 73 | 93 | 113 | 133 | 153 | 173 | 193 | 216 | 239 | 253 | ||
| 45 | 19 | 35 | 56 | 77 | 98 | 110 | 132 | 151 | 179 | 196 | 214 | 235 | 258 | ||
| 46 | 17 | 37 | 57 | 77 | 97 | 117 | 137 | 157 | 177 | 197 | 208 | 235 | 257 | ||
| 47 | 19 | 39 | 59 | 79 | 99 | 119 | 139 | 159 | 179 | 199 | 204 | 233 | 259 | ||
| 48 | 1 | 22 | 43 | 64 | 84 | 106 | 127 | 159 | 171 | 190 | 200 | 231 | 251 | ||
| 49 | 3 | 24 | 45 | 66 | 86 | 108 | 129 | 142 | 173 | 192 | 213 | 232 | 253 | ||
| 50 | 5 | 26 | 47 | 68 | 88 | 110 | 131 | 144 | 175 | 194 | 219 | 239 | 255 | ||
| 51 | 7 | 28 | 49 | 70 | 90 | 112 | 133 | 146 | 162 | 196 | 204 | 236 | 257 | ||
| 52 | 9 | 30 | 51 | 72 | 92 | 114 | 135 | 148 | 164 | 198 | 203 | 234 | 259 | ||
| 53 | 11 | 32 | 53 | 74 | 94 | 116 | 137 | 150 | 166 | 200 | 208 | 224 | 242 | ||
| 54 | 13 | 34 | 55 | 76 | 96 | 118 | 139 | 152 | 168 | 191 | 214 | 225 | 244 | ||
| 55 | 15 | 36 | 57 | 78 | 98 | 120 | 121 | 154 | 170 | 193 | 217 | 235 | 246 | ||
| 56 | 17 | 38 | 59 | 80 | 100 | 102 | 123 | 156 | 172 | 195 | 211 | 229 | 248 | ||
| 57 | 2 | 22 | 42 | 62 | 82 | 102 | 122 | 142 | 162 | 182 | 203 | 222 | 242 | ||
| 58 | 4 | 24 | 44 | 64 | 84 | 104 | 124 | 144 | 164 | 184 | 207 | 224 | 244 | ||
| 59 | 8 | 28 | 48 | 68 | 88 | 108 | 128 | 148 | 168 | 188 | 215 | 228 | 248 | ||
| 60 | 15 | 35 | 55 | 75 | 95 | 115 | 135 | 155 | 175 | 195 | 212 | 237 | 255 | ||
| 61 | 6 | 26 | 46 | 66 | 86 | 106 | 126 | 146 | 166 | 186 | 211 | 226 | 246 | ||
| 62 | 10 | 30 | 50 | 70 | 90 | 110 | 130 | 150 | 170 | 190 | 219 | 228 | 250 | ||
| 63 | 12 | 32 | 52 | 72 | 92 | 112 | 132 | 152 | 172 | 192 | 218 | 221 | 252 | ||
| 64 | 14 | 34 | 54 | 74 | 94 | 114 | 134 | 154 | 174 | 194 | 214 | 223 | 254 | ||
| 65 | 16 | 36 | 56 | 76 | 96 | 116 | 136 | 156 | 176 | 196 | 210 | 225 | 256 | ||
| 66 | 18 | 38 | 58 | 78 | 98 | 118 | 138 | 158 | 178 | 198 | 206 | 227 | 258 | ||
| 67 | 20 | 40 | 60 | 80 | 100 | 120 | 140 | 160 | 180 | 200 | 202 | 229 | 260 | ||
| 68 | 2 | 23 | 44 | 65 | 85 | 107 | 128 | 141 | 172 | 191 | 210 | 223 | 252 | ||
| 69 | 4 | 25 | 46 | 67 | 87 | 109 | 130 | 143 | 174 | 193 | 216 | 227 | 254 | ||
| 70 | 6 | 27 | 48 | 69 | 89 | 111 | 132 | 145 | 161 | 195 | 207 | 222 | 256 | ||
| 71 | 8 | 29 | 50 | 71 | 91 | 113 | 134 | 147 | 163 | 197 | 201 | 228 | 258 | ||
| 72 | 10 | 31 | 52 | 73 | 93 | 115 | 136 | 149 | 165 | 199 | 206 | 221 | 241 | ||
| 73 | 14 | 35 | 56 | 77 | 97 | 119 | 140 | 153 | 169 | 192 | 215 | 233 | 245 | ||
| 74 | 12 | 33 | 54 | 75 | 95 | 117 | 138 | 151 | 167 | 190 | 212 | 237 | 243 | ||
| 75 | 16 | 37 | 58 | 79 | 99 | 101 | 122 | 155 | 171 | 194 | 218 | 226 | 247 | ||
| 76 | 6 | 27 | 48 | 69 | 89 | 115 | 136 | 149 | 165 | 199 | 215 | 233 | 245 | ||
| 77 | 11 | 32 | 53 | 74 | 94 | 116 | 121 | 154 | 170 | 193 | 217 | 235 | 246 | ||
| 78 | 7 | 27 | 47 | 67 | 87 | 107 | 134 | 155 | 168 | 184 | 219 | 234 | 244 | ||
| 79 | 3 | 23 | 43 | 63 | 83 | 103 | 137 | 150 | 166 | 200 | 208 | 224 | 242 | ||
| 80 | 20 | 40 | 60 | 80 | 100 | 120 | 140 | 160 | 178 | 198 | 206 | 227 | 258 | ||
| 81 | 14 | 35 | 56 | 77 | 97 | 119 | 132 | 152 | 172 | 192 | 218 | 221 | 252 | ||
| 82 | 11 | 31 | 51 | 71 | 91 | 111 | 131 | 151 | 175 | 195 | 212 | 237 | 255 | ||
| 83 | 4 | 24 | 44 | 64 | 84 | 104 | 135 | 155 | 175 | 195 | 212 | 237 | 257 | ||
| 84 | 5 | 26 | 47 | 68 | 88 | 110 | 131 | 151 | 167 | 190 | 212 | 237 | 253 | ||
| 85 | 4 | 24 | 44 | 64 | 98 | 110 | 132 | 151 | 179 | 184 | 207 | 224 | 244 | ||
| 86 | 9 | 29 | 49 | 69 | 89 | 109 | 129 | 146 | 162 | 196 | 204 | 236 | 257 | ||
| 87 | 7 | 27 | 47 | 67 | 87 | 107 | 138 | 158 | 178 | 198 | 206 | 227 | 258 | ||
| 88 | 12 | 32 | 52 | 72 | 92 | 112 | 132 | 152 | 172 | 192 | 218 | 221 | 252 | ||
| 89 | 11 | 32 | 53 | 74 | 94 | 117 | 137 | 157 | 177 | 197 | 208 | 235 | 257 | ||
| 90 | 9 | 30 | 51 | 72 | 92 | 114 | 139 | 159 | 179 | 199 | 204 | 233 | 259 | ||
| 91 | 4 | 24 | 44 | 64 | 84 | 104 | 129 | 149 | 169 | 189 | 217 | 232 | 249 | ||
| 92 | 12 | 32 | 52 | 72 | 92 | 112 | 132 | 148 | 168 | 188 | 215 | 228 | 248 | ||
| 93 | 18 | 38 | 58 | 78 | 99 | 119 | 139 | 159 | 179 | 194 | 219 | 239 | 255 | ||
| 94 | 9 | 30 | 51 | 72 | 92 | 114 | 135 | 145 | 161 | 195 | 207 | 222 | 256 | ||
| 95 | 11 | 32 | 53 | 74 | 94 | 116 | 137 | 153 | 169 | 192 | 215 | 233 | 245 | ||
| 96 | 16 | 36 | 56 | 76 | 96 | 106 | 127 | 159 | 171 | 190 | 214 | 223 | 254 | ||
| 97 | 3 | 24 | 45 | 66 | 86 | 106 | 126 | 146 | 166 | 186 | 215 | 233 | 249 | ||
| 98 | 16 | 37 | 58 | 79 | 99 | 119 | 132 | 152 | 172 | 192 | 217 | 232 | 253 | ||
| 99 | 7 | 27 | 47 | 67 | 87 | 107 | 131 | 151 | 171 | 191 | 215 | 233 | 241 | ||
| 100 | 11 | 31 | 51 | 71 | 91 | 111 | 131 | 151 | 175 | 195 | 212 | 237 | 265 | ||
|
|
|
|
|
|
|
|
|
КОНТРОЛЬНОЕ ЗАДАНИЕ
Тема 1. СТРОЕНИЕ АТОМА Теоретические основы
Квантово-механическая модель атома. Квантовые числа. Атомные орб итали. Принцип Паули. Правило Хунда. Электронные и электронно- графические формулы атомов. Ядро атома, атомный номер и массовое число. Состав ядра.
Задачи 1... 20
Определите символы элементов и найдите величины, помеченные знаком "?", в табл. 1. Составьте электронные и электронно-графические формулы для атомов соответствующего элемента в основном состоянии.
Таблица 1
| Номер задачи | Символ | Атомный номер | Массовое число | Число протонов | Число нейтронов |
| 1 | 48Ti | ? | ? | ? | ? |
| 2 | ? | 23 | 51 | ? | ? |
| 3 | ? | ? | ? | 24 | 28 |
| 4 | ? | ? | 55 | 25 | ? |
| 5 | 73Ge | ? | ? | ? | ? |
| 6 | ? | ? | ? | 31 | 39 |
| 7 | ? | 33 | 75 | ? | ? |
| 8 | ? | ? | ? | 34 | 45 |
| 9 | ? | ? | 80 | 35 | ? |
| 10 | 91Zr | ? | ? | ? | ? |
| 11 | ? | 41 | 93 | ? | ? |
| 12 | ? | 39 | 89 | ? | ? |
| 13 | ? | ? | ? | 42 | 54 |
| 14 | ? | ? | 98 | 43 | ? |
| 15 | 119Sn | ? | ? | ? | ? |
| 16 | ? | 51 | 122 | ? | ? |
| 17 | ? | ? | 115 | 49 | ? |
| 18 | ? | ? | ? | 52 | 76 |
| 19 | ? | ? | 127 | 53 | ? |
| 20 | 45Sc | ? | ? | ? | ? |
Тема 2. ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА
Теоретические основы
периодическая система элементов Д. И. Менделеева. Периоды, группы, под группы. Связь между положением элемента в периодической системе и элек тронным строением его атомов. Периодичность изменения свойств элемен тов в свете современной теории строения атома. Свойства соединений эле ментов.
Задачи 21... 40
На основании положения химического элемента (порядковый номер определите по табл. 2) в периодической системе Д. И. Менделеева и его электронной формулы составьте прогноз его химических свойств, а также свойств его соединений, ответив на следующие вопросы:
2.В каких периоде, группе и подгруппе располагается данный элемент в периодической системе Д. И. Менделеева?
3.Укажите соответствие между положением элемента в периодической системе Д. И. Менделеева и его электронной формулой (номером внешнего энергетического уровня, общим числом валентных электронов, характером их распределения по орбиталям).
4.К какому электронному семейству относится данный элемент?
5.Не делать
6.Чему равны максимальная и минимальная степени окисления атомов этого элемента?
7.Является ли он металлом или неметаллом?
8. Не делать
9. Не делать
10.Каковы формулы высшего оксида и соответствующего гидроксида этого элемента?
10.Какими кислотно-основными свойствами обладают высший оксид и соответствующий гидроксид? Напишите уравнения химических реакций, подтверждающих наличие указанных свойств.
Таблица 2
| Номер задачи | Порядковый номер элемента | Номер задачи | Порядковый номер элемента |
| 21 | 19 | 31 | 49 |
| 22 | 20 | 32 | 50 |
| 23 | 31 | 33 | 35 |
| 24 | 32 | 34 | 51 |
| 25 | 37 | 35 | 49 |
| 26 | 38 | 36 | 15 |
| 27 | 55 | 37 | 14 |
| 28 | 56 | 38 | 13 |
| 29 | 52 | 39 | 33 |
| 30 | 53 | 40 | 34 |
Тема 3. ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ
Теоретические основы
Основные типы и характеристики химической связи. Ковалентная и ионная связь. Метод валентных связей. Строение и свойства простейших молекул.
Задачи 41... 60
1.Определите тип химической связи (ковалентная неполярная, ковалентная полярная или ионная) в веществах, указанных в табл. 3 (необходимые для анализа данные см. в Приложении 2).
2. В случае ковалентной полярной укажите направление смещения электронов.
Таблица 3
| Номер задачи | Вещества | Номер задачи | Вещества |
| 41 | хлорид фосфора (V) гидрид бериллия | 51 | бромид калия силан |
| 42 | бромид кремния (IV), бромид стронция | 52 | хлорид лития аммиак |
| 43 | хлорид бора (III), хлорид магния | 53 | бромид кальция оксид брома(III) |
| 44 | фосфин фторид бериллия | 54 | фторид цезия хлорид азота (III) |
| 45 | хлорид мышьяка(III) селеноводород | 55 | бромид углерода (IV) бромид бария |
| 46 | бромид бора (III) бромид бериллия | 56 | бромид цезия бромид фосфора (III) |
| 47 | бромид лития теллуроводород | 57 | нитрид лития хлорид серы (II) |
| 48 | хлорид кремния (IV) хлорид кальция | 58 | иодид углерода (IV) иодид цезия |
| 49 | арсин бромид натрия | 59 | бромид мышьяка(III) бромид рубидия |
| 50 | бромид германия(IV) фторид азота (III) | 60 | хлорид калия хлорид фосфора (III) |
Тема 4. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Теоретические основы
Термодинамические функции. Их изменение при протекании химических процессов.
Задачи 61... 80
1.Вычислите величины 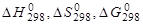 , для реакций, уравнения которых приведены в табл. 4 (необходимые для расчетов данные см. в Приложении 4). Объясните знак изменения энтальпии и энтропии. Возможна ли данная реакция при стандартных условиях?
, для реакций, уравнения которых приведены в табл. 4 (необходимые для расчетов данные см. в Приложении 4). Объясните знак изменения энтальпии и энтропии. Возможна ли данная реакция при стандартных условиях?
2.Постройте график зависимости ∆G от Т и определите по графику температуру равновесия.
Примечание: заочники ускоренного курса делают только п.1, заочники общей формы делают п.1 и п.2
Таблица 4
| Номер задачи темы 4 | Номер задачи темы 5 | Уравнения реакций |
| 61 | 81 | СН3СНО(Г) ↔ СН4(г) + СО(Г) |
| 62 | 82 | 2NO(r) + 2Н2(Г) ↔N2(r) + 2Н20(Г) |
| 63 | 83 | 2NO(r) + 02(г) ↔ 2N02(r) |
| 64 | 84 | C2Cl4(г)+ С12(г) ↔ С2Сl6(г) |
| 65 | 85 | 4Н2(Г) + 2N02(r) ↔4Н20(Г) + N2(r) |
| 66 | 86 | 2NO(r) + С12(г) ↔ 2NOCl(r) |
| 67 | 87 | 2NO(r) + Н2(г) ↔N20(r) + Н20(г) |
| 68 | 88 | С0(г)+ Сl2(г) ↔ СОС12(г) |
| 69 | 89 | Н2(г) + Вr2(г) ↔2НВr(Г) |
| 70 | 90 | Н2О2(Г) + Н2(г) ↔2Н2О(Г) |
| 71 | 91 | CdO(TB) + Н2(г) ↔ Cd(ТВ) + Н2О(Г) |
| 72 | 92 | Н2(г) + J2(г)↔ 2НJ(г) |
| 73 | 93 | Fe(ТВ) + С12(г) ↔ FeCl2(TB) |
| 74 | 94 | 2NO(r) + Вr2(г) ↔2NOBr(r) |
| 75 | 95 | 2N205(r) ↔ 4N02(r) + 02(г) |
| 76 | 96 | НСНО(г) ↔ Н2(г) + СО(г) |
| 77 | 97 | С(ТВ) + СО2(г) ↔ 2СО(г) |
| 78 | 98 | 2О3(г) ↔ ЗО2(г) |
| 79 | 99 | СО(г) + Н2О(г) ↔ СО2(г) + Н2(г) |
| 80 | 100 | N2(r) + 02(г) ↔ 2NO(r) |
Тема 5. ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
Студенты ускоренного обучения расчетные задачи не делают, кратко излогают теорию:
Скорость химической реакции и ее зависимость от концентрации, давления. Закон действующих масс.
Зависимость скорости от температуры. Правило Вант-Гоффа. Уравнение Аррениуса. Понятие об энергии активации.
Химическое равновесие и его сме щение по принципу Ле-Шателье.
Заочники общей формы, согласно своего варианта, делают расчетные задания:
Задачи 81... 100
Для реакции, соответствующей номеру Вашей задачи (см. табл. 4):
1) составьте кинетическое уравнение;
2) составьте выражение для константы равновесия;
3) вычислите, во сколько раз изменится скорость реакции при заданных изменениях:
а) температуры, б) общего давления (при изменении объема системы), в) концентраций реагентов;
4) укажите, как необходимо изменить внешние параметры (температуру, общее давление, концентрации реагентов), чтобы сместить равновесие вправо.
Все необходимые для решения данные приведены в табл.5 [температурный коэффициент - у; в трех последних столбцах указано, во сколько раз увеличили концентрацию первого реагирующего вещества (столбец 5), второго реагирующего вещества (столбец 6) и общее давление в системе (столбец 7)].
Таблица 5
| Номер | γ | Т1,К | Т2,К |
|
|
|
| задачи | ||||||
| 81 | 3,0 | 273 | 293 | 3 | - | 3 |
| 82 | 2,5 | 345 | 365 | 2 | 5 | 4 |
| 83 | 2,1 | 448 | 498 | 3 | 4 | 3 |
| 84 | 2,7 | 345 | 355 | 4 | 8 | 8 |
| 85 | 3,2 | 256 | 276 | 2 | 2 | 2 |
| 86 | 2,0 | 364 | 394 | 3 | 2 | 3 |
| 87 | 3,0 | 372 | 392 | 5 | 5 | 4 |
| 88 | 2,1 | 283 | 293 | 2 | 8 | 4 |
| 89 | 2,6 | 291 | 321 | 5 | 4 | 3 |
| 90 | 2,5 | 217 | 257 | 5 | 1 | 5 |
| 91 | 3,3 | 328 | 378 | 10 | 5 | 5 |
| 92 | 3,7 | 339 | 399 | 3 | 4 | 3 |
| 93 | 2,7 | 341 | 381 | 20 | 9 | 4 |
| 94 | 3,4 | 253 | 273 | 2 | 5 | 2 |
| 95 | 3,5 | 245 | 265 | 10 | - | 10 |
| 96 | 2,8 | 347 | 377 | 3 | - | 5 |
| 97 | 3,3 | 259 | 289 | 20 | 4 | 8 |
| 98 | 3,2 | 292 | 322 | 4 | - | 7 |
| 99 | 2,1 | 224 | 274 | 5 | 3 | 6 |
| 100 | 3,1 | 296 | 336 | 2 | 4 | 4 |
Тема 6. РАСТВОРЫ. СПОСОБЫ ВЫРАЖЕНИЯ СОДЕРЖАНИЯ ВЕЩЕСТВА В РАСТВОРЕ
Теоретические основы
Классификация растворов. Количественные характеристики состава растворов.
Задачи 101... 120
Произведите необходимые вычисления и найдите недостающие величины, обозначенные знаком "?" в строке табл.6, соответствующей номеру Вашей задачи (все растворы - водные).
Таблица 6
| № задачи | Растворенное вещество | Масса растворенного вещества, г | Масса растворителя , г | Объем раствора, мл | Плотность раствора, г/см3 | Массовая доля, % | Мольная доля, % | Молярная концентрация, моль/л |
| 101 | HNO3 | 149,1 | ? | 150 | 1,42 | ? | ? | ? |
| 102 | NH4OH | ? | ? | 120 | 0,90 | 29 | ? | ? |
| 103 | HBr | 144 | 156 | ? | 1,50 | ? | ? | ? |
| 104 | KOH | ? | ? | 300 | ? | ? | 20,80 | 11,60 |
| 105 | NaOH | ? | 38,75 | ? | 1,53 | 50 | ? | ? |
| 106 | HJ | ? | ? | 110 | ? | ? | 15,7 | 7,57 |
| 107 | H2SO4 | ? | 8,83 | 120 | ? | ? | ? | 18 |
| 108 | HCl | 97,46 | ? | 130 | 1,19 | ? | ? | ? |
| 109 | CH3COOH | ? | ? | 140 | ? | ? | 99,3 | 17,4 |
| 110 | H3PO4 | 216,75 | ? | 150 | 1,70 | ? | ? | ? |
| 111 | HF | ? | ? | 225 | 1,16 | 49 | ? | ? |
| 112 | HClO4 | ? | ? | 75 | ? | ? | 29,46 | 11,6 |
| 113 | Na2CO3 | 42,13 | 195,87 | ? | 1,19 | ? | ? | ? |
| 114 | NH4NO3 | ? | 61,3 | ? | 1,23 | 50 | ? | ? |
| 115 | NaCl | ? | ? | 300 | ? | ? | 3,30 | 1,83 |
| 116 | CaCl2 | ? | 125,64 | 150 | ? | ? | ? | 5,03 |
| 117 | (NH4)2SO4 | ? | ? | 250 | ? | ? | 3,29 | 1,69 |
| 118 | Na2SO4 | 43,64 | ? | 400 | 1,09 | ? | ? | ? |
| 119 | NH4Cl | ? | ? | 50 | 1,06 | 20 | ? | ? |
| 120 | C2H5OH | ? | ? | 125 | ? | ? | 20,6 | 8,08 |
Тема 7. Растворы электролитов. Расчет рН растворов кислот, солей, оснований.
Теоретические основы
Электролитическая диссоциация. Сильные и слабые электролиты.Качественный состав растворов электролитов разной силы. Иннно-молекулярные уравнения.
Ионное произведение воды. Расчет рН водных растворов кислот, солей, оснований.
Задачи 121 ... 140
1.Для предложенных водных растворов электролитов написать уравнения электролитической диссоциации, указать силу электролита, качественный состав раствора. Назвать соединения.
2.Расчитать значение рН растворов кислот и оснований из Вашего варианта, если молярная концентрация растворов равна 0,01моль/л.
3. Для солей написать уравнения гидролиза по первой ступени, указать кислотность среды.
Таблица 7
| Номер варианта | Электролит 1 | Электролит 2 | Электролит 3 | Электролит 4 | Электролит 5 | Электролит 6 |
| 121 | LiOH | HNO3 | H3PO4 | NH4NO3 | Na2B 4 O7 | K2SO4 |
| 122 | H2SO4 | NaOH | NH4OH | Na2C2O4 | CuCl2 | KBr |
| 123 | KOH | HBr | H2C2O4 | (NH4)2SO4 | Na2SO3 | Na2SeO4 |
| 124 | H2SeO4 | RbOH | NH4OH | Na2S | Cd(NO3)2 | KNO3 |
| 125 | CsOH | HCl | H2S | NH4Cl | K2SiO3 | KI |
| 126 | HClO4 | Ca(OH)2 | NH4OH | K3AsO4 | AlBr3 | Na2ClO3 |
| 127 | Sr(OH)2 | HBrO3 | H3AsO4 | NH4ClO4 | Na2 СО3 | NaClO4 |
| 128 | HI | Ba(OH)2 | NH4OH | K2Se | FeSO4 | Sr(NO3)2 |
| 129 | LiOH | H2SO4 | H2Se | NH4 С lO3 | K2CO3 | Ba(NO3)2 |
| 130 | HIO3 | NaOH | NH4OH | NaCN | Pb(NO3)2 | KCl |
| 131 | KOH | H2SeO4 | HCN | (NH4 )2 SO 4 | NaHCOO | Na2SO4 |
| 132 | HBrO3 | RbOH | NH4OH | KHCOO | CuSO4 | BaCl2 |
| 133 | CsOH | HBr | HCOOH | NH4NO3 | Na2SiO3 | SrCl2 |
| 134 | HCl | Ca(OH)2 | NH4OH | NaCH3 С OO | MgSO4 | KClO3 |
| 135 | Sr(OH)2 | HNO3 | CH3СOOH | NH4ClO4 | KNO2 | BaBr2 |
| 136 | HI | Ba(OH)2 | NH4OH | K2C2O4 | NiSO4 | LiClO4 |
| 137 | LiOH | HClO4 | H2C2O4 | NH4Cl | K2SO3 | NaNO3 |
| 138 | HIO3 | NaOH | NH4OH | Na3AsO4 | ZnSO4 | K2SeO4 |
| 139 | KOH | HBbO3 | H3AsO4 | NH4ClO3 | Na2B4O7 | LiCl |
| 140 | HBr | RbOH | NH4OH | Na3PO4 | Al2 ( SO 4 )3 | KbrO3 |
Тема 8. Коллигативные свойства растворов.
Теоретические основы
Закон Рауля, следствия из него : понижение температуры кристаллизации, повышение температуры кипения раствора по сравнению с характеристиками растворителя. Диффузия. Осмос.Изотонический коэффициент, его смысл.
Задачи 141 ... 160
141.При 0 0С осмотическое давление раствора сахарозы С12Н22О11 равно 3,55∙105 Па. Какая масса сахарозы содержится в 1 л раствора?
142. При какой температуре будет замерзать водный 100г раствора этилового спирта, если массовая доля С2Н5ОН равна 25%? (К(Н2О) =1,87 К·Кг/моль)
143.Раствор, содержащий 0,162 г серы в 20 г бензола, кипит при температуре на 0,081 0С выше, чем чистый бензол. Рассчитайте молекулярную массу серы в растворе. Сколько атомов содержится в одной молекуле серы?
144. Расчитать и сравнить осмотические давления двух растворов при 25 0С: хлорида калия (С(KCl)=0,01 моль/л; i=1,96) и раствора карбоната калия (С(К2СО3)=0,05 моль/л; i=2,40).
145. В 100 мл водного раствора содержится 11,71г сахарозы С12Н22О11 . Чему равно осмотического давления раствора при 25 0С?
146. Раствор 1,05 г неэлектролита в 30 г воды замерзает при температуре -0,7 0С. Вычислите молекулярную массу неэлектролита.. (К(Н2О) =1,87 К·Кг/моль)
147. При какой температуре будет кристаллизоваться (замерзать) 40%-ный раствор этилового спирта С2Н5ОН ? (К(Н2О) =1,87 К·Кг/моль)
148. Раствор, содержащий 8 г NaOH в 1000 г Н2О, кипит при температуре 100,184 0С. Определите изотонический коэффициент i (Э(Н2О) =0,516 К·Кг/моль).
149. Определите осмотическое давление раствора, содержащего 90,08 г глюкозы С6Н12О6 в 4 л раствора при 27 0С.
150. Рассчитайте молекулярную массу неэлектролита, если в 5 л раствора содержится 2,5 г неэлектролита. Осмотическое давление этого раствора равно 230 кПа при 20 0С.
151. Определите температуры кипения раствора, содержащего 1 г нитробензола С6Н5NО2 в 10 г бензола. Эбулоскопическая константа бензола равна 2,57 К∙кг/моль. Температура кипения чистого бензола 80,2 0С.
152. Раствор, в 100 мл которого находится 2,3 г вещества обладает при 298 К осмотическим давлением равным 618, 5 кПа. Определите молекулярную массу вещества.
153. Какова температура замерзания водного раствора этиленгликоля С2Н6О2, содержащего 30г вещества в одном литре воды? (К(Н2О) =1,87 К·Кг/моль).
154. Температура кипения водного раствора хлорида калия с концентрацией 1 моль/кг равна 100,94 0С. Вычислите изотонический коэффициент хлорида калия в этом растворе.
(Э(Н2О) =0,516 К·Кг/моль).
155. Вычислите осмотическое давление раствора, содержащего 16 г сахарозы С12Н22О11 в 350 г воды при 293 К. Плотность раствора считать равной 1 г/мл.
156. Растворы камфары массой 0,522 г в 17 г эфира кипит при температуре на 0,461 0С выше, чем чистый эфир. Эбуллиоскопическая константа эфира 2,16 К∙кг/моль. Определите молекулярную массу камфары.
157. Какова температура замерзания водного раствора глицерина С3Н8О3 ,содержащего 50г глицерина 1 л воды? (К(Н2О) =1,87 К·Кг/моль).
158. Сколько грамм поваренной соли необходимо растворить в 1л воды, чтобы образовавшейся растов замерзал при температуре -5 0С ? Изотонический коэффициент принять равным 2. (К(Н2О) =1,87 К·Кг/моль).
159. Определите температуры замерзания раствора, содержащего 5 г нитробензола С6Н5NО2 в 30 г бензола. Криоскопическая константа бензола равна 5,1 К∙кг/моль. Температура замерзания чистого бензола -5,4 0С.
160. Некоторый водный раствор неэлектролита кипит при температуре 373,52 К. Определите моляльную концентрацию этого раствора. (Э(Н2О) =0,516 К·Кг/моль).
Задание темы 9 делают заочники общей формы обучения,
Дата добавления: 2019-02-22; просмотров: 162; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!